牛白血病病毒抑制奶牛免疫系统功能的研究进展
李思妍,王 雍,连 帅,王建发,武 瑞*
(1. 黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319;2. 黑龙江省牛病防制重点实验室,黑龙江 大庆 163319)
牛白血病(Bovine leucosis,BL)是由BL 病毒(BLV)引起的一种牛的传染病,根据该病的流行特点和表现形式分为流行性牛白血病(Enzootic bovine leukosis,EBL)和散发性牛白血病(Sporadic bovine leukosis,SBL)。BLV 感染几乎遍布世界各地且主要在奶牛中广泛传播,其传播方式有水平传播、垂直传播和哺乳传播。1871 年立陶宛Leisering 等最早报道BLV 后,EBL 开始在世界各地的奶牛中广泛发生,最新的调查结果显示,中国各地区奶牛群中该病感染率为0~61.7%[1],呈现出感染率高和发病率低的特点[2]。
BLV 感染牛后的发展进程分3 个阶段:发病初期,大多数牛不表现任何临床症状,血清学鉴定为阳性,表现为非淋巴细胞增多症(Alymphocytosis,AL);30% 的BLV 感染牛会进一步发展为持续性淋巴 细胞增多症(Persistant lymphocytosis,PL),此时,病毒和机体处于平衡状态;最终仅有1%~10%的BLV 感染牛会发展为淋巴肉瘤(Lymphosarcoma,LS)。研究结果表明,PL 不是恶性增生,只有LS 才属于恶性增生,并可以在数月后导致患病牛死亡[3]。因此对BLV 感染来说,只有表现出LS 时才可以称为地方流行型白血病[4],EBL 潜伏期很长,老龄牛发病率高。BLV 对牛群造成的经济损失主要来自产奶量下降,泌乳性能降低,淘汰率升高,国际贸易的限制及屠宰带有淋巴瘤的牛对销售价格造成的影响[5]。近年来美国、澳大利亚和阿根廷等国家乳腺癌患者的乳腺组织中接连被检测出BLV 基因片段,虽然尚无充分证据表明BLV 就是人乳腺癌的元凶[6],但研究BLV 的感染机制和风险对于阐明逆转录病毒的感染机制和防控养牛业的安全风险意义重大。
BLV 主要感染牛淋巴细胞和外周血单核细胞。在感染期间,BLV 能够逃避宿主的免疫反应,使宿主的免疫应答发生变化,继而导致患病牛存在继发其他疾病及免疫失败等风险。本文综述BLV 导致宿主细胞免疫和体液免疫功能的异常,旨在为探究BLV 感染引起牛机体的免疫抑制奠定基础。
1 BLV感染导致宿主细胞免疫功能的异常
1.1 Th1 细胞功能异常Th1 反应的特征性促炎细胞因子主要包括IFN-γ、IL-2 和IL-12,且BLV 感染后这些细胞因子的表达水平均出现了异常(表1)。与正常牛和AL 时期患牛相比,PL 时期患牛体内的外周血单个核细胞(PBMC)中,IL-2 mRNA 的转录水平均显著减少[7];将不同时期牛的PBMC 同刀豆球蛋白(ConA)共培养后, 结果显示PL 时期牛的IL-2活性最高[8],且PL 与AL 时期的牛IL-2 mRNA 转录水平均较高[9]。而PL 时期牛的CD4+T 淋巴细胞中,只有较少的IL-2表达,当经ConA刺激后,PL牛IL-2的表达水平则与阴性牛相似[10],结果表明BLV 在体内可以抑制IL-2 的表达,进而对淋巴细胞的生长、增殖、分化、免疫应答等功能均起到抑制作用。
奶牛感染BLV 后, IFN-γ 在病牛体内的变化趋势与IL-2 类 似, PL 与AL 时期牛的PBMC 中,IFN-γ mRNA 转录水平与阴性牛相比均降低。在PBMC 中加入ConA 刺激后,PL 和AL 时期牛之间,IFN-γ mRNA 的转录水平无差异,但患病牛的IFN-γ mRNA 转录水平均显著高于阴性牛。体外培养的PBMC 经ConA 刺激后,3 个时期牛的IFN-γ 均具有相同的转录趋势[9]。在BLV 感染的免疫应答期,浆细胞样树突细胞(pDC)活化时,IFN-γ 的表达量显著增加,但在经典树突细胞(cDC)中,IFN-γ 的表达量减少[11]。
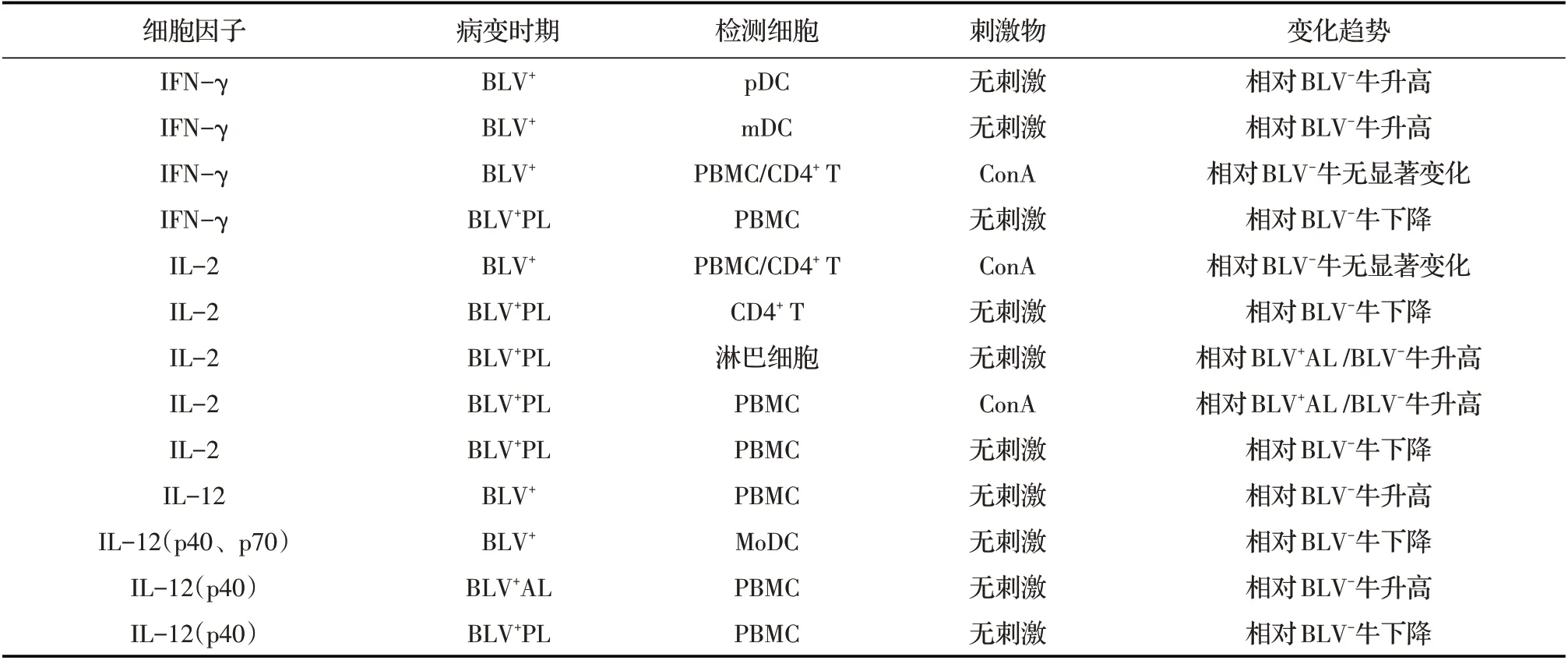
表1 BLV 阳性牛异常的Th1 型细胞因子
IL-12 作为Th1 型细胞免疫反应的特征性细胞因子,在BLV 感染后其mRNA 转录水平显著升高,但在BLV 阳性牛之间IL-12 mRNA 转录水平无显著差异[12]。 IL-12 具有不同亚基成分,这些成分在淋巴瘤中的转录水平也不尽相同, PL 期牛的PBMC中, IL-12(p40)mRNA 转录水平减少,而AL 期牛的PBMC 中, IL-12(p40)mRNA 转录水平却是升高的[13]。在BLV 感染期间,单细胞来源的树突细胞(MoDC)群体均被活化, IL-12 p40 和IL-12 p70 的表达量均减少,由此推进了BLV 对机体的感染[14]。
PD-L1 作为一种T 细胞抑制因子,在BLV 阳性牛体内表达PD-L1 的B 细胞要明显多于阴性牛,PD-L1 的表达被阻断后阳性牛PBMC 中的IL-2 和IFN-γ 的表达量均显著增加,表明PD-L1 在细胞因子的表达中发挥负调控作用[15]。 T 细胞中淋巴细胞活化基因3(LAG3)和T 细胞免疫球蛋白黏蛋白分子3(Tim3)的表达量均增加, B 细胞中PD-L1 的表达量增加,T 细胞IFN-γ 的表达量减少,均表明BLV感染牛的经典T 细胞的活性受到了抑制。将表达Tim3 的细胞作为配体诱捕剂添加到细胞中培养12 h后, BLV 阳性牛PBMC IFN-γ 的表达量显著增加,表明BLV 可以通过增加Tim3 表达水平而降低T 细胞的反应性[16]。
1.2 CD8+ T 细胞功能异常与阴性牛相比,BLV阳性牛与CD8+T 细胞活化和增殖相关的负调节因子mRNA 转录水平均显著增加,如LAG3[17]、Tim3[15]和Gal9。BLV阳性牛的CD8+T也会表现出一些异常的活性,当体外培养牛的PBMC 经 IL-2 刺激10 d~12 d后, AL 牛PBMC 的γδT 细胞数量较其他两个时期显著增加, CD8+T 细胞的比例则显著降低[10]。在BLV阳性牛体内分离的T 细胞中, MHC-Ⅱ类分子和CD25 表面受体的表达与阴性牛相比无显著差异[18],尽管如此, BLV 阳性牛经典的T 细胞活性也明显受到抑制,CD8+T 细胞的活化和增殖均受到抑制,这为BLV 在机体内的免疫逃避提供了机会。
1.3 单核细胞和巨噬细胞功能异常BLV 虽是一种以感染B 淋巴细胞为主的反转录病毒,但也可以从单核细胞或巨噬细胞中分离出其原病毒DNA。 BLV感染对PBMC 和巨噬细胞表面抗原的表达也会产生影响。
AL 时期牛新鲜分离的外周血白细胞(PBL)及单核细胞表面表达的CD11b 和CD32 相对百分含量与另外两个时期患牛相比呈增加趋势,但单核细胞CD14 和MHC-Ⅱ类分子的表达量则相对减少[18],表明AL 时期牛的抗原递呈能力受到抑制。有数据表明,虽然BLV 阴性牛单核细胞的CD11b 和MHC II 类分子的的总表达量更多,但单个单核细胞的这两种蛋白的表达水平均低于正常牛。与阴性牛的单核细胞相比,从AL 时期牛中分离的单核细胞对大肠杆菌的吞噬活性显著降低[19]。在培养的巨噬细胞中发现AL 时期牛表达CD11b 和CD14 的细胞百分比显著降低,表明它们的功能在BLV 感染后出现异常。CD11b、CD32 和CD14 这些表面受体是单核细胞和巨噬细胞的主要标志物,其中CD11b 对细胞粘附和迁移起到重要作用;CD32 是单核细胞与B 淋巴细胞共有的受体,对调节抗体水平很重要[20]; CD14 是一种能够结合细菌脂多糖(LPS)的受体。虽然在患牛体内BLV 对CD11b、CD32和CD14的表达水平造成了影响(表2),但在体外培养的单核细胞中加入BLV刺激后则不会对这几种受体的表达量造成影响[21],表明单核细胞或巨噬细胞的功能异常可能不是BLV感染的直接结果。

表2 BLV 阳性牛单核/巨噬细胞表面主要受体的异常表达
2 BLV感染导致的体液免疫功能异常
2.1 B 细胞功能异常当机体受到抗原刺激时,吞噬细胞首先发挥作用,对其进行摄取和处理以暴露出抗原决定簇,然后经T 细胞递呈给B 细胞,受抗原刺激的B 细胞增殖分化产生浆细胞和记忆细胞,从而产生特异性体液免疫反应,发挥免疫功能,但由于AL 期牛不表现临床症状,所以对该期牛B 细胞功能异常的研究相对较少。
与阴性牛最主要的区别是BLV 感染后B 细胞的异常增殖,CD5+B 细胞是BLV 原病毒整合的主要靶点, BLV所引起的B细胞增殖主要就发生在这一细胞亚群中(PL 期B 细胞的CD5 表达量达90.5%)[22]。在人和小鼠中,CD5+B 细胞代表一种独特的非经典B 细胞谱系,主要来源于胎儿肝脏,对T 细胞非依赖性抗原有反应,产生天然免疫球蛋白M(IgM),又被称作B-1a 细胞。而所有动物中的CD5+IgM+B 细胞群体均比其他细胞群体具有更高的BLV 前病毒载量[23], 表明CD5+B 细胞可能是BLV 所引起机体免疫抑制的关键因素之一。
在PL 期牛新鲜分离的IgM+细胞中,MHCⅠ和MHC Ⅱ类分子mRNA 的转录水平与另外两个时期的患牛相比均无明显差异,但与正常牛相比, BLV 阳性牛PBMC 中的MHC Ⅱ类分子表达水平增加[8],且表达MHC Ⅱ类分子B 细胞的比例明显更高[18]。有趣的是,在体外培养的PBMC 中, IL-2 刺激可以提高正常牛B 细胞表面MHC Ⅱ类分子的表达[24],但IL-2的刺激对PL 牛B 细胞MHC Ⅱ类分子的表达无影响。表明BLV 可能破坏了患牛体内的抗原递呈能力。
从BLV 阳性牛分离的B 细胞中, CD25 受体的表达量较阴性牛显著减少[18],但体外培养20 h 后,无论是否用ConA 刺激, PL 时期牛分离的B 细胞表面CD25 的表达量均增加[18]。在培养的PBMC 中加入IL-2 刺激后, PL 时期牛B 细胞CD25 的表达量显著提高,但若单独培养B 细胞用IL-2 刺激后,则不能上调CD25 的表达量[9]。利用商陆丝裂原(PWN)刺激PBMC 后,阴性牛及PL 期牛B 细胞CD25 的表达量均显著增加,且PL 期牛B 细胞表面CD25 受体表达量的上调更加明显[25]。CD25 是IL-2 受体的α 链,其表达量的降低表明细胞对IL-2 的识别能力降低;且体外分离的B 细胞脱离BLV 感染牛的体内环境后,经药物刺激增殖后,CD25 的表达量上升,表明CD25表达量的降低可能是BLV 间接调控所引起的。
产生响应病原侵袭的抗体是B 细胞的关键免疫功能之一,也是BLV感染宿主后免疫系统产生应答的方式之一。BLV感染牛产生某些特定抗体的功能会出现异常,如正常情况下,牛机体产生抗体IgM∶IgG 为1∶10,但BLV 感染牛产生的抗体比例并不稳定,如将合成抗原接种PL 牛时,其产生的抗体水平是正常牛的两倍。BLV 感染的牛,多种抗体的转录水平会产生异常,如BLV 感染牛的PBMC 中Igμ mRNA的转录水平增加,而IgA 的转录水平则会降低;BLV 感染牛的血清IgM 水平在短暂升高后呈降低趋势,IgG 水平则无明显变化。当BLV 感染牛接种J5大肠杆菌疫苗后,其血清中抗原特异性IgG2 显著减少,IgG2 抗体作为抗大肠杆菌感染最有效的调理素,其显著减少表明了BLV 阳性牛抗体水平的异常很可能会下调疫苗对机体的保护功能,使BLV 感染牛可能面临免疫失败的风险[26]。
2.2 Th2 型细胞功能异常BLV 感染后,会造成Th2 型细胞IL-4、IL-10 和IL-6 细胞因子的异常表达(表3),而对AL 牛Th2 型细胞功能的相关研究结果较少。在BLV 感染牛的PBMC 中, IL-4 mRNA 的转录水平较低。但在体外培养的PBMC中,BLV阳性牛IL-4 的转录水平与正常牛趋势相同,且加入ConA 共培养后,3 个时期患牛IL-4 的转录水平无差异[9]。在PL 期牛的CD4+T 淋巴细胞中,IL-4 mRNA 转录水平降低,用ConA 刺激后PL 牛IL-4 的转录水平与阴性牛相似[7],表明IL-4 不是受BLV 直接调控的细胞因子,其变化可能是BLV 对机体免疫功能造成的间接影响。
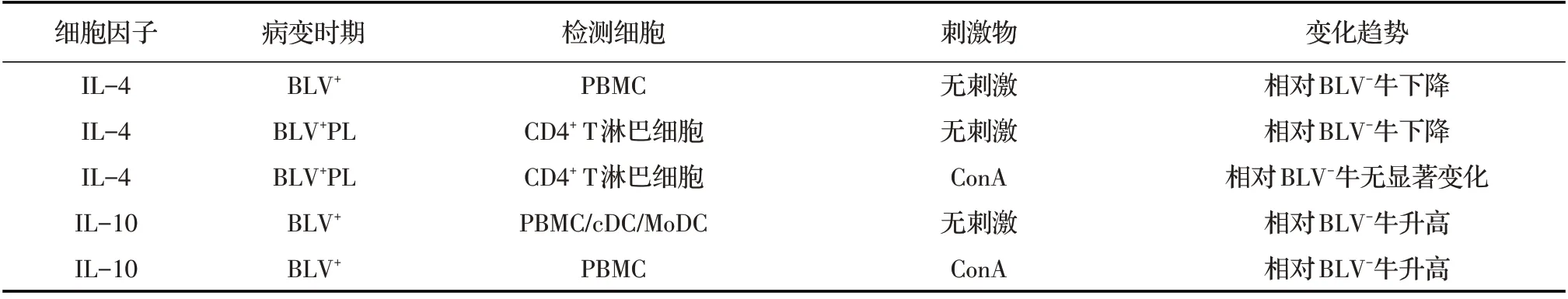
表3 BLV 阳性牛Th2 型细胞因子的异常表达水平的变化
与IL-4 相反的是,牛体内IL-10 的表达量随着BLV 感染的发展则呈增加趋势。IL-10 具有免疫抑制作用,可以抑制BLV 在PBMC 中复制时Tax 和pol mRNA 的转录水平,体外试验也证实了其确实可以抑制BLV 的复制[27]。PL 时期牛的PBMC 被ConA 刺激后, IL-10 mRNA 的转录水平显著增加[9];BLV 感染后,患牛的cDC 和MoDC 中IL-10 的转录水平也呈显著增加趋势[11],表明IL-10 在BLV 感染过程中具备成为检测靶标的可能。
IL-6 也是机体参与调节免疫系统功能的重要细胞因子之一,在PL 时期牛的血清中,IL-6 转录水平显著升高。在体外同ConA、细胞内毒素(LPS)、BLV gp-51 抗原共培养的PBMC 中, PL 期比另外两个时期牛IL-6 的转录水平更高,流式细胞术测定结果也显示,在BLV 阳性牛MoDCs 群体中,促炎细胞因子IL-6 的分泌量显著升高[11]。表明BLV 感染导致机体发生了炎症反应。
IL-4 是机体Th2 和体液免疫反应的特征性细胞因子, IL-10 可以调节并抑制促炎免疫反应,IL-6可以诱导T 细胞活化和B 细胞发育为成纤维细胞。PL 牛的PBMC 对IL-6 的亲和力较低,这也恰好解释了为什么PL 牛体内的IL-6 水平要高于阴性牛。大多数细胞因子的功能都是广泛的,牛体内炎症因子表达量的改变对牛外伤感染病原的清除、疫苗反应、组织重塑及牛体内炎症的发生都有着不同且广泛的影响。
3 小结与展望
BLV 可以通过多种途径造成动物机体免疫抑制(图1)和免疫紊乱。首先,在B 细胞方面, BLV 可直接引起牛MHC Ⅱ类分子的表达量增多,使B 细胞的抗原递呈能力异常,从而引起机体免疫抑制;同时BLV 感染后,T 细胞和B 细胞表面CD25 受体的表达量显著升高。CD25 作为IL-2 受体的α 链,影响IL-2 高亲和力受体的表达水平,结合恶变的B 细胞表面会表达IL-2 高亲和力受体这一现象,表明BLV可能通过B 细胞恶变使机体出现免疫抑制。在T 细胞方面, BLV 感染牛后体内的CD4+T 细胞和CD8+T细胞的活化和增殖能力均降低;B 细胞中的PD-L1表达量增多,阻断了T 细胞表面的PD-1 对肿瘤细胞的识别,导致机体的细胞免疫功能下降。在细胞因子方面,在患病牛体内,IL-2表达水平呈下降趋势,IFN-γ 的表达水平整体呈上升趋势,表明机体内Th1型细胞因子在BLV感染后出现紊乱,机体细胞免疫功能失调;而作为Th2 型细胞因子的IL-4 的表达量在BLV 感染后下调,IL-6和IL-10的表达量则均上调,Th2型细胞因子功能出现紊乱。因此,BLV 感染后牛体内的细胞免疫和体液免疫功能均出现异常。
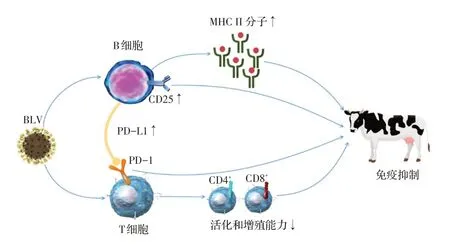
图1 BLV 造成牛体内免疫抑制的多条途径
综上所述:(1)BLV 在机体内可以通过多个途径对机体免疫功能造成影响,从而造成机体的免疫抑制。(2)由于BL 的临床症状不明显,因此该病的诊断一直是难点[28]。可以通过综合分析牛体内细胞因子的变化水平,在此基础上将特异变化的细胞因子作为BL 的诊断标志物,可以为该早期的诊断提供参考。(3)研究显示BLV 患病牛原代B 细胞淋巴瘤中的病毒基因会出现转录沉默,无法检测到病毒的mRNA 和蛋白质,但可以检测到BLV 编码的mi⁃croRNA(miRNA),这种只能检测到BLV miRNA 的淋巴细胞仍会呈现免疫抑制[29],因此,可以考虑从沉默BLV miRNA 的角度开发只具有感染性而不具有致瘤性的BLV 活疫苗。
重大传染病和生物安全风险事关国家安全和发展、社会大局的稳定。BLV 在我国广泛流行,可造成患牛免疫系统功能下降,降低牛奶质量。研究表明,BLV 可跨物种致使黑猩猩等动物发生白血病,BLV 还可能是导致乳腺癌发生的重要风险因素,BLV 编码的miRNA 还可跨界调控多个人类基因[30]。在无BLV 商品化疫苗可供使用的情况下,一旦无BLV 国家以此作为乳制品国际贸易的营销卖点,我国奶业将可能遭受比三聚氰胺事件更加严重的打击。本研究室目前正在探究BLV 对荷斯坦牛乳脂乳蛋白合成机制的影响;由于BLV miRNA 具有跨界调控人源基因的风险性,本研究室将考虑针对BLV 与宿主受体互作、逃避宿主识别、诱导宿主免疫损伤、跨细胞类型传递等BLV 持续性潜伏感染形成和维持的关键环节,系统开展BLV 结合受体阻断疗法、共刺激信号激活疗法、免疫损伤修复疗法、阻断跨细胞类型传递疗法等的研究,探究多靶点协同干预的奶牛体内BLV 储存库的清除策略。该研究既有助于保障奶牛免疫系统功能、提升牛奶质量及安全,又对防范和化解潜在的公共卫生风险具有重要意义。

