固本清目方对实验性干性年龄相关性黄斑变性小鼠的干预作用
张晶,许凯,梁丽娜,庄曾渊,梁洁
年龄相关性黄斑变性(age-related macular degeneration,AMD)属于视网膜变性类疾病的范畴,是严重威胁视力的致盲性眼病,患者多为50 岁以上人群,并且随着年龄增加发病率也逐渐升高。在我国经济发展程度较高的城市,AMD 甚至已成为老年人群致盲性眼病的第2 位原因[1]。根据临床特点的不同,AMD 可分为渗出性(湿性)和非渗出性(干性)。对于湿性AMD 的治疗随着抗新生血管药物的使用已取得了较好的临床效果。但对于干性AMD 引起的视力丧失,目前仍缺乏有效的治疗药物。
中医辨证论治和整体治疗的理念为AMD 的治疗提供了新的思路[2]。一项关于中药治疗干性AMD疗效meta 分析的结果显示,中药治疗后,患者视力以及视觉诱发电位振幅都有明显改善[3]。固本清目方是庄曾渊研究员临床治疗AMD 的基本方,临床初步观察显示有较好的效果,为进一步明确固本清目方保护AMD 的作用及机制,本实验模拟AMD 发生的高危因素建立小鼠AMD 模型,观察固本清目方对实验性视网膜变性的保护作用,并就其相关机制进行探讨,为固本清目方的临床应用提供理论依据及支持。
1 材料与方法
1.1 实验动物
4 月龄健康雄性SPF 级C57BL/6J 小鼠60 只(购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。实验动物饲养于中国中医科学院眼科医院实验动物中心屏障级动物房内[SYXK(京)2019-0049]。温度(22±5)℃,湿度(50±5)℃。所有实验操作遵循《北京市实验动物管理条例》,并按实验动物3R 原则给予人道关怀。
1.2 试剂与仪器
固本清目方水煎剂(组成:枸杞子,当归,刺五加,郁金,山栀子,由中国中医科学院眼科医院药剂科煎制),煎制浓缩到0.6 g/ml;氢醌(Sigma-Aldrich,H9003);TUNEL 细胞原位凋亡试剂盒(Roche Life Science,12156792910);HE 染色试剂盒(北京博奥森生物技术有限公司,C02-04004);4′,6-二脒基-2-苯基吲哚染色液(4′,6-diamidino-2-phenylindole,DAPI,BD PharmingenTM,564907);抗荧光淬灭剂(北京博奥森生物技术有限公司,C-101);DNA 酶I(大连TaKaRa 公司,D2270A);冰冻包埋剂(optimal cutting temperature compound,OCT,美 国SAKURA Sakura 公司,4583);4%多聚甲醛(北京Unique 生物科技有限公司,P1110);Fas(Abcam,ab216991);FasL(Abcam,ab15285);罗丹明标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司,ZF0316);牛血清白蛋白(bovine serum albumin,BSA,北京博奥森生物技术有限公司,bs-2315)。荧光定量PCR(qualitative real-time PCR,RT-PCR)试剂盒(TAKAR宝生物工程(大连)有限公司,DRR820A),引物(上海生物工程公司),SuperScript III 逆转录酶试剂盒(ThermoFisher,12574018)小动物视觉电生理检测仪(Diagnosis,D430),光学显微镜(Leica,DM2500),冰冻切片机(Leica,CM1850),光照度计(北京师范大学光电仪器厂,ST-85),大鼠SPF 级生长繁育饲料(北京科奥协力饲料有限公司),实验性慢性视网膜光损伤装置(自主设计研发,实用新型专利证书号:ZL201721043922.6)。
1.3 动物模型的建立与分组
4 月龄C57BL/6J 小鼠40 只,每日喂以含8g/(kg.bw)氢醌的饲料,同时每日接受12 h、强度2500 lux 的光照以建立视网膜变性模型[4]。3.5 个月后,将小鼠随机分为中药组、模型组,每组20 只。中药组小鼠每日给予0.6 kg/kg 固本清目方0.3 ml 灌胃1 次;模型组小鼠每日给予同体积蒸馏水灌胃1 次。取正常未干预C57BL/6J 小鼠20 只作为正常组,常规饲养作为对照。
1.4 视网膜电图检测
各组小鼠于检测前暗适应24 h,复方托吡卡胺滴眼液点双眼常规散瞳20 min;采用盐酸氯胺酮-盐酸塞拉嗪混合麻醉剂(比例为1∶7)肌注(0.01 ml/kg)麻醉小鼠。视网膜电图(electroretinogram,ERG)检测操作全程均在弱红光灯下进行操作。将双侧角膜电极置于小鼠双侧眼角膜正中,保持各电极间阻抗始终<5 kΩ。根据国际临床视觉电生理协会(ISCEV)制定的最新国际标准[5],依次选定视杆细胞反应,最大反应,暗适应震荡电位,(自动明适应5 min)视锥细胞反应以及10 Hz 闪烁光反应进行检测。依次记录各组振幅值(μV)。
1.5 组织病理学检查
于干预后14 d 及28 d,每组分别颈椎脱臼法处死3 只小鼠用于病理学检查,快速摘取眼球,1 ml 注射器角膜穿刺置于4%多聚甲醛固定20 min,解剖显微镜下小心去除眼前节和部分玻璃体,余下组织继续固定24 h,梯度酒精脱水、二甲苯透明后浸蜡包埋。连续4 μm 切片,切片常规脱蜡至水后行HE 染色,光学显微镜观察视网膜各层病理改变。
1.6 TUNEL 检测视网膜细胞凋亡
于干预后14 d 及28 d,每组分别处死3 只小鼠制作眼球冰冻切片,小鼠眼球取材同HE 染色,4%多聚甲醛液中4℃固定24 h 后,冰冻包埋剂OCT 包埋后液氮冷冻。冰冻切片机-23℃下行垂直视网膜的8 μm 冰冻切片。冰冻切片磷酸缓冲液(PBS)室温15 min×3 次洗脱包埋剂,进行TUNEL 检测,具体操作参见试剂盒说明,完成后进行DAPI 复染细胞核,抗荧光衰减封片剂封片,荧光显微镜下观察。每组随机选取10 张片子,每张片子计数一个高倍视野下凋亡的感光细胞数及感光细胞总数。计算凋亡率,凋亡率=(凋亡阳性细胞数)/(视网膜总细胞数)×100%。
1.7 Fas 及FasL 的表达
免疫荧光检测:将冰冻切片置于磷酸缓冲液(PBS)室温10 min×3 次,然后置于1% TritonX-100溶液30 min,2%牛血清白蛋白的室温封闭2 h 后滴加分别一抗Fas、FasL,4℃孵育过夜。PBS 溶液室温洗涤10 min×3 次,滴加罗丹明标记的山羊抗兔二抗,室温下孵育1 h,PBS 清洗10 min×3 次,DAPI 复染细胞核5 min。抗荧光衰减封片剂封片,荧光显微镜下观察。
RT-PCR 检测Fas 及FasL mRNA 的表达:于干预后14 d 及28 d,每组分别处死4 只小鼠用于RT-PCR 检查,采用Trizol 法提取视网膜组织总RNA,参照试剂盒SuperScriptTM III 提供的操作方法,逆转录合成cDNA,紫外分光光度计测定其浓度。引物序列见表1。常规PCR 操作扩增程序检测Fas、FasL 的mRNA 表达水平。数据进行2-ΔΔCt转换后,进行分析比较。
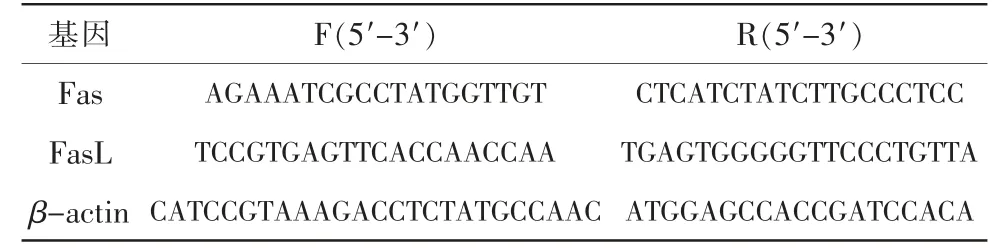
表1 RT-PCR 引物序列
1.8 统计学方法
采用SPSS 24.0 软件包进行分析,计量资料以均数±标准差()表示,经正态性检验后,对符合正态分布的两样本均数比较采用独立样本t 检验;多个样本均数比较采用单因素方差分析,组间比较采用LSD-t 检验。对于不符合正态分布的数据采用秩和检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 各组视网膜电图(ERG)比较
14 d:(1)与正常组比较,中药组10 Hz 闪烁光反应降低(t=7.360,P=0.000),但视杆细胞反应、最大反应、暗适应震荡电位以及视锥细胞反应各项差异均无统计学意义(P>0.05);(2)中药组与模型组比较,视杆细胞反应(t=2.937,P=0.022)、最大反应(t=3.153,P=0.016)、暗适应震荡电位(t=3.597,P=0.009)、视锥细胞反应(t=2.988,P=0.020)振幅均升高,差异均有统计学意义,但在10 Hz 闪烁光反应方面差异无统计学意义(P>0.05)(表2)。
表2 干预14 d 时各组小鼠ERG 结果比较(,n=10)
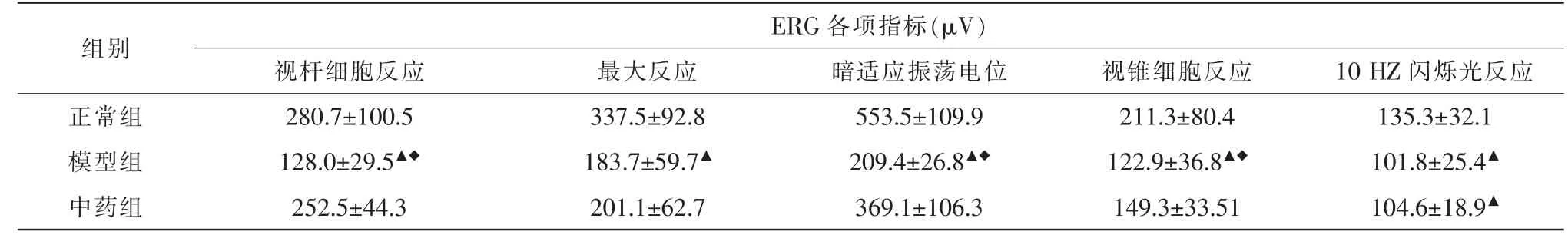
表2 干预14 d 时各组小鼠ERG 结果比较(,n=10)
注:▲与正常组比较,P<0.05;◆与中药组比较,P<0.05。ERG 视网膜电图
28d:(1)与正常组比较,中药组最大反应(t=13.229,P=0.000)、10 Hz 闪烁光反应(t=10.651,P=0.000)振幅值均降低,差异均有统计学意义。但视杆细胞反应、暗适应震荡电位、视锥细胞反应各项,差异均无统计学意义(P>0.05);(2)中药组与模型组比较,视杆细胞反应(t=4.687,P=0.002)、暗适应震荡电位(t=3.371,P=0.012)、视锥细胞反应(t=4.176,P=0.004)振幅仍升高,差异均有统计学意义;而最大反应、10 Hz 闪烁光反应的差异均无统计学意义(P>0.05)(表3)。
表3 干预28 d 各组小鼠ERG 结果比较(,n=10)
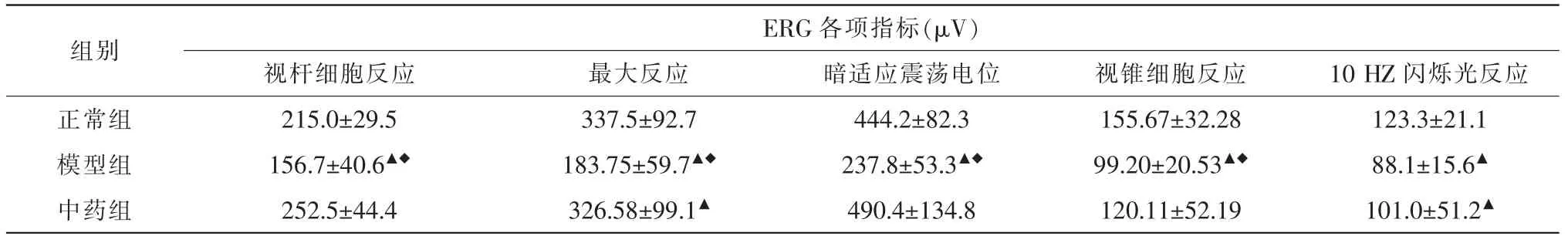
表3 干预28 d 各组小鼠ERG 结果比较(,n=10)
注:▲与正常组比较,P<0.05;◆与中药组比较,P<0.05。ERG 视网膜电图
2.2 组织病理学
HE 染色显示,正常组小鼠视网膜各层结构清晰,细胞形态均一,视网膜色素上皮(retina pigment epithelium,RPE)细胞呈单层连续排列(图1A、1D)。与正常组相比,模型组小鼠RPE 层呈现萎缩样改变(图1B、1E),中药组小鼠RPE 细胞排列较规整,色素均匀分布于细胞内,Bruch 膜结构相对完整,(图1C、1F)。14 d 时,中药组的视网膜感光细胞个数(231.67±9.71)较模型组(203.67±10.26)显著升高(t=6.346,P=0.000),而与正常组(235.33±17.00)比较差异无统计学意义(P>0.05);28 d 时,中药组感光细胞个数(182.67±12.12)仍显著高于模型组(176.67±36.17)(t=5.827,P=0.001),而与正常组(213.33±15.00)的差异无统计学意义(P>0.05)。

图1 小鼠视网膜病理图像观察(HE 染色×400)。1A 正常组14 d;1B 模型组14 d;1C 中药组14 d;1D 正常组28 d;1E 模型组28 d;1F 中药组28 d
2.3 TUNEL 法观察各组小鼠视网膜细胞凋亡
TUNEL 染色结果显示,正常组视网膜罕见凋亡细胞(图2A、2D),14 d 及28 d 时,中药组(图2C、2F)和模型组(图2B、2E)均可见凋亡阳性细胞呈现红色荧光(图2B),主要分布于视网膜内、外核层及RPE 细胞层。14 d 时,中药组凋亡率(16.00±2.34)%明显低于模型组(43.00±2.17)%,差异有统计学意义(t=2.714,P=0.030);28 d 时,中药组与模型组细胞凋亡率分别为(7.00±2.35)%和(36.00±2.13)%,差异具有统计学意义(t=3.231,P=0.014)。
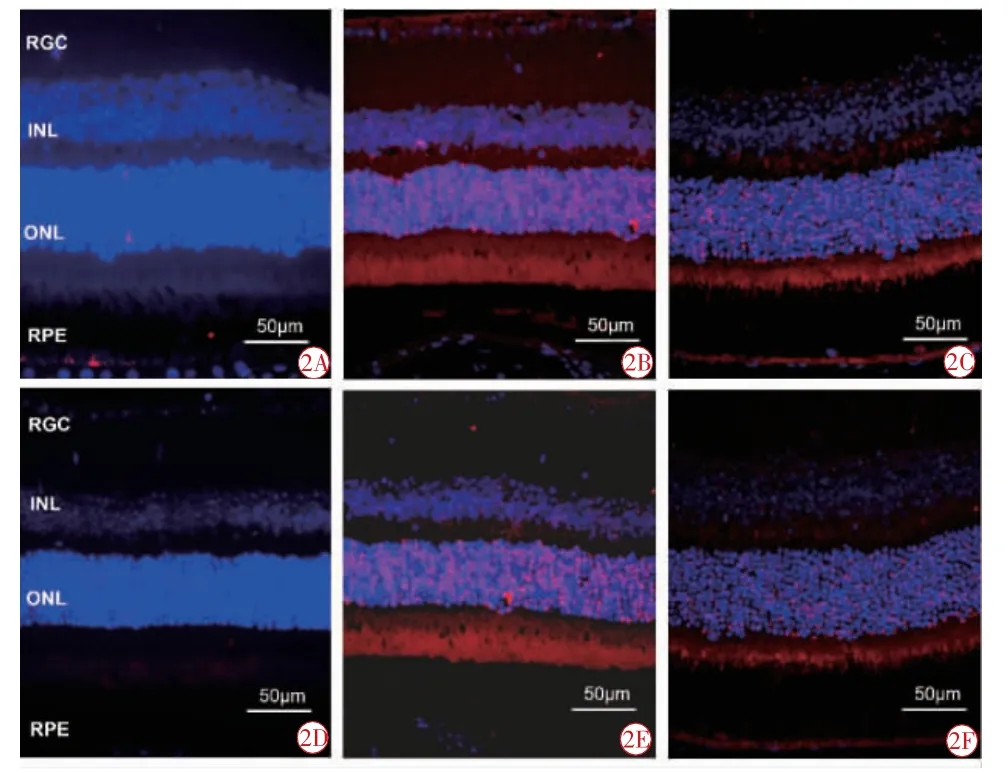
图2 TUNEL 法检测各组小鼠视网膜细胞凋亡(TUNEL 染色×400)。2A 正常组14 d;2B 模型组14 d;2C 中药组14 d;2D 正常组28 d;2E 模型组28 d;2F 中药组28 d
2.4 免疫荧光检测各组视网膜组织Fas 及FasL 的表达
Fas:正常组视网膜中可见少量Fas 蛋白表达,呈红色荧光,主要分布在RPE 层(图3A,3D),14 d时,中药组Fas 蛋白表达趋势与正常组类似,主要集中于RPE 层(图3C),而模型组Fas 表达较正常组增强,RPE 层可见到明显的阳性信号(图3B)。28 d时,中药组(图3F)和模型组(图3E)Fas 蛋白表达均较14 d 时减弱,但表达分布趋势与14 d 相似。
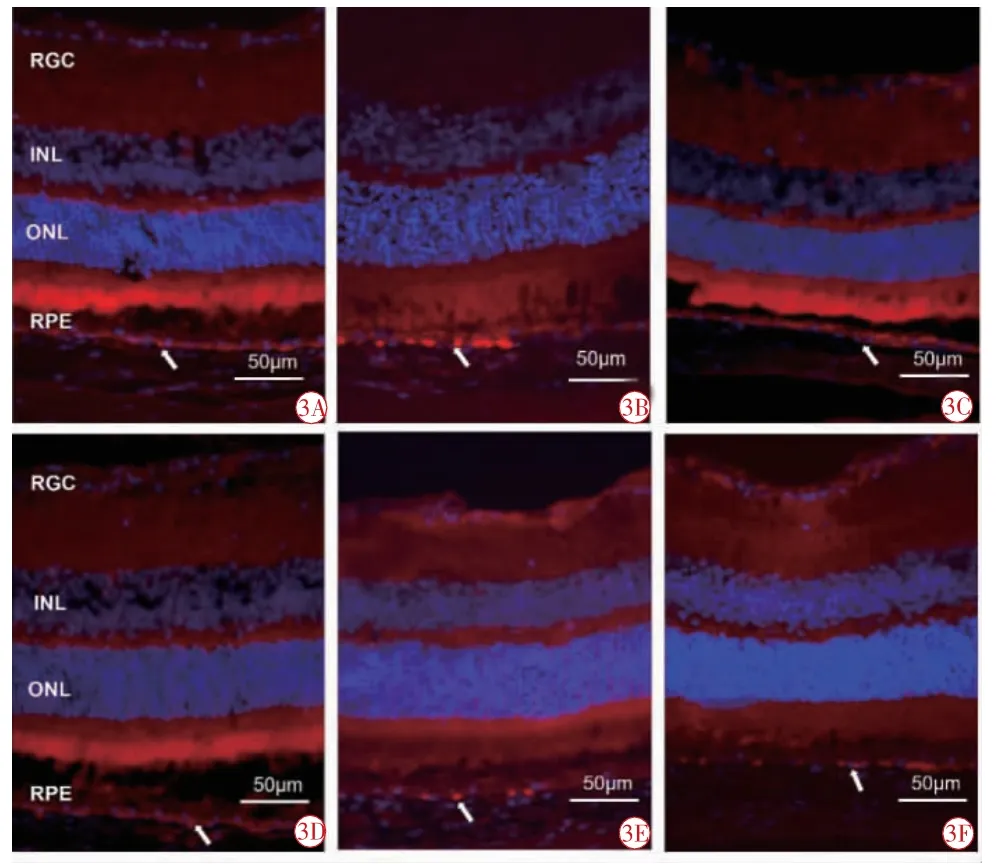
图3 免疫荧光检测各组小鼠视网膜Fas 表达情况(×400)。3A 正常组14 d;3B 模型组14 d;3C 中药组14 d;3D 正常组28 d;3E 模型组28 d;3F 中药组28 d
FasL:正常组可见FasL 少量表达(图4A,4D),呈红色荧光,主要分布在RPE 层。14 d 时,模型组表达较正常组增强,在RPE 层和感光细胞内核层均可见到红色荧光信号(图4B);中药组仅在RPE层可见少量表达(图4C)。28 d 时,中药组(图4F)和模型组(图4E)FasL 的表达分布于14 d 时相近,在RPE 层以及内核层均可见阳性信号,中药组表达弱于模型组。
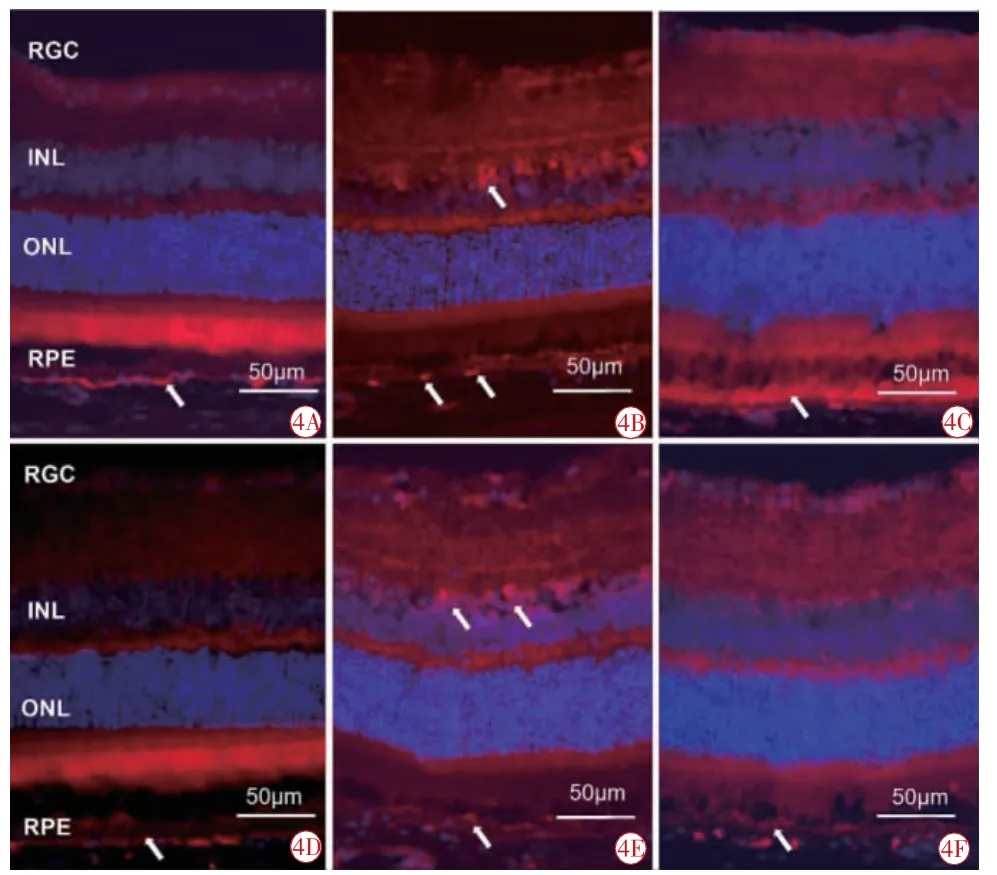
图4 免疫荧光检测各组小鼠视网膜FasL 表达情况(×400)。4A 正常组14 d;4B 模型组14 d;4C 中药组14 d;4D 正常组28 d;4E模型组28 d;4F 中药组28 d
2.5 RT-PCR 检测各组视网膜组织Fas 及FasL mRNA 的表达
Fas:14 d 时,中药组Fas 表达较模型组降低,差异有统计学意义(t=7.153,P=0.000);中药组与正常组相比差异无统计学意义(P>0.05);28 d 与14 d 趋势相近,中药组表达低于模型组,差异有统计学意义(t=11.204,P=0.000),而与正常组比较无统计学意义(P>0.05)(图5)。
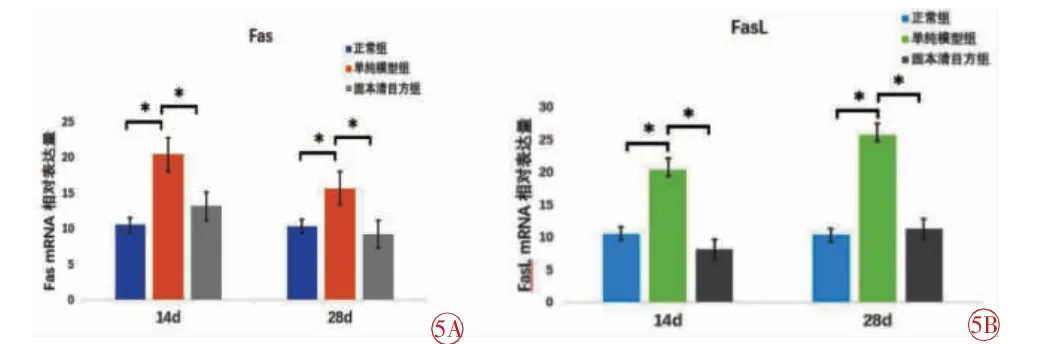
图5 RT-PCR 检测各组Fas、FasL mRNA 的表达情况。5A FasmRNA的表达;5B FasL mRNA 的表达
FasL:14 d 时,中药组FasL 表达低于模型组(t=8.372,P=0.000),而与正常组比较无统计学意义(P>0.05);28 d 时,中药组FasL 表达仍低于模型组,差异有统计学意义(t=7.011,P=0.000),而与正常组比较无统计学意义(P>0.05)。
3 讨论
目前AMD 具体发病机制尚不十分明确,但大量研究显示AMD 一个多因素作用、光感受器细胞、RPE 细胞和脉络膜毛细血管之间相互影响形成的复杂系统的表现。因此,联合多种发病诱因,尽可能模拟AMD 发生的环境因素,可能会建立更接近人AMD 发病机制的动物模型。年龄、吸烟及光损伤是AMD 发生的重要诱因[6-7]。动物实验发现,处于吸烟环境的老龄小鼠视网膜色素上皮层下出现沉积物、Bruch 膜层胶原增厚及RPE 细胞凋亡,与人AMD早期病理改变相似[8]。另1 项动物实验显示:利用可见光持续照射2 月龄猪3 个月以上,多焦视网膜电图、光镜、电镜观察证实视网膜发生了变性损伤,光损伤部位主要在光感受器细胞[9]。上述模型分别以吸烟、光照2 个AMD 危险因素模拟出部分AMD 病理改变,本课题组前期将老龄、吸烟(氢醌为香烟中的有害成分)、可见光持续照射三因素联合建立小鼠AMD 模型,观察到小鼠视网膜变化与临床AMD的病变特点更加接近[4]。因此本研究仍采用此种模型小鼠,观察固本清目方对AMD 的干预作用。
AMD 在中医眼科属“视瞻昏渺”“视直如曲”等病证范畴。虽然临床上所见证型复杂,但其主要病机是由于机体老化,五脏皆虚,脾肾为重。一方面脾肾虚衰致精血不足,真元耗伤,精气不能上荣于目,则目失濡养而目视不明;另一方面脾肾功能衰弱,则水湿运化无度,气机不利,清阳不升,浊阴不降,痰浊之邪内生,加之长期光照、吸烟等外邪刺激皆能化火,耗伤气血,使痰湿积聚加重,变生玻璃膜疣、渗出、水肿等导致AMD 发生。
固本清目方组成包括枸杞子、黄芪、当归、刺五加、郁金、山栀,其中枸杞子补肾填精,黄芪、当归益气养血,刺五加补肾益气,郁金、山栀行气解郁,诸药合用,共奏补肾固本、行气解郁功效。现代药理学研究显示,组方中刺五加水提取物能够有效清除自由基,减轻缺血-再灌注过程中过氧化引起的线粒体损伤[10],对胰腺细胞急性炎症损伤所致的凋亡和自噬等具有确切保护作用[11];此外,刺五加功能成分可改善辐射造成的小鼠脑组织细胞的损伤,具体机制与其黄酮及皂苷等减少辐射小鼠大脑皮质与海马组织的细胞空洞,提高存活神经元数量密切相关[12]。组方中的枸杞子富含枸杞多糖(lycium barbarum polysaccharide,LBP),研究证实枸杞子及LBP 对角膜损伤、视网膜色素变性、AMD 以及糖尿病视网膜病变等多种眼科疾病的防治均具有一定效果。此外在辐射所致的大鼠海马神经元损伤模型中,LBP 通过增加SOD、Bcl-2 的含量、抑制caspase-3 蛋白表达水平,实现对神经元细胞的保护作用[13-18];组方中黄芪的功能成分黄芪多糖对视网膜神经节细胞的炎症损伤以及凋亡均具有保护作用[19-20]。本研究结果显示,固本清目方干预14 d 及28 d 后,小鼠ERG 中视杆细胞反应、暗适应震荡电位、视锥细胞反应的振幅显著高于模型组,视网膜病理结果显示中药组小鼠的视网膜内、外核层细胞数量高于模型组,表明固本清目方对模型小鼠视网膜视杆细胞和视锥细胞的结构和功能具有维持和改善作用。
Fas 蛋白为肿瘤坏死因子受体(tumor necrosis family receptor,TNFR)家族成员,FasL 为Fas 的配体,属于肿瘤坏死因子(tumor necrosis family,TNF)家族[21]。生理状态下,FasL 存在于虹膜、睫状体、脉络膜以及视网膜等眼部组织中[22],在损伤、炎症、缺血等因素刺激下活化,与FAS+的细胞结合,介导细胞凋亡过程[23]。本研究中,RT-PCR 及免疫荧光结果显示固本清目方可以抑制AMD 模型小鼠视网膜组织中Fas/FasL 的表达及分泌,TUNEL 结果显示中药组凋亡阳性细胞显著低于模型组,提示固本清目方可能通过调控Fas/FasL 介导的细胞凋亡通路,抑制视网膜细胞凋亡从而发挥保护作用。
综上所述,本研究从形态学及功能学角度证实固本清目方对实验性小鼠AMD 具有较好的保护作用,并发现其机制与调节Fas/FasL 的表达,进而抑制Fas/FasL 介导的视网膜细胞凋亡有关。在今后的工作中,一方面需要开展规范的临床试验,为固本清目方的临床推广提供高质量的循证依据;另一方面进一步深入揭示其作用机制,为固本清目方的应用提供理论支持。

