猪繁殖与呼吸综合征病毒GP5蛋白在昆虫细胞中的可溶性表达
尹园英,高雁怩,夏婷婷,白娟,姜平
(南京农业大学动物医学院/农业农村部动物细菌学重点实验室,江苏 南京 210095)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)是引起母猪繁殖障碍和新生仔猪呼吸道疾病的重要病原,给全球生猪养殖造成巨大经济损失[1]。目前,PRRSV商品疫苗尚不理想,该病仍严重影响我国养猪业的健康发展。
PRRSV为单股正链RNA病毒,分为欧洲型、美洲型2个基因型,同一基因型毒株中又有多种基因亚型。我国主要流行的美洲型毒株包括经典型、高致病性和NADC30样等基因亚型毒株。该病毒基因组全长约15 kb,编码16种非结构蛋白和8种结构蛋白[2]。其中,GP5是病毒的主要囊膜糖基化蛋白,其序列在各毒株之间变异较大,GP5蛋白大小约25 ku,含有A和B 2个重要抗原表位。B表位高度保守,可诱发中和抗体。A表位为非中和性表位[3]。GP5蛋白是PRRSV亚单位疫苗研究的重要靶标抗原。
为了提高PRRSV疫苗免疫保护广谱性和GP5蛋白表达效力,本研究根据我国流行的3种基因亚型PRRSV代表性毒株的GP5基因序列,设计合成了杂合GP5基因(xGP5m),并用PCR方法在其前端分别添加TAT、ppTG20以及MPG 3种穿膜肽[4-6],构建获得4株重组杆状病毒,获得了可溶性表达的GP5蛋白,证明其具有的较好抗原性。
1 材料与方法
1.1 主要材料
pFastBacTMDual表达系统和Lipofectamine 3000为Invitrogen公司产品。PRRSV阳性血清为本实验室制备保存。His单克隆抗体购自翼飞雪生物科技有限公司。SPA-HRP、羊抗小鼠IgG-HRP购自武汉博士德生物工程公司。Sf-900Ⅲ SFM无血清培养基为Gibco公司产品。Mini plasmid、DNA凝胶回收试剂盒、2×TaqMix均购自南京诺唯赞公司。限制性核酸内切酶购自Thermo Fisher公司。ECL化学发光试剂盒购自购Biouniquer公司。IPTG购自大连宝生物工程有限公司。大肠杆菌DH5α和DH10Bac菌株、Sf9细胞均为本实验室冻存。6~8周龄BALB/c雌鼠50只,购自南京青龙山动物场。
1.2 目的基因设计与合成
选择PRRSV代表性流行毒株S1、BB0907和FJ1402基因序列,比对分析GP5蛋白氨基酸序列,选取其共有的氨基酸组合为杂合GP5序列(xGP5),并在C端引入6×His标签序列,再将其对应基因序列按昆虫细胞偏嗜性优化,命名为xGP5m。基因合成由南京金斯瑞生物科技有限公司完成。根据合成基因序列,设计引物(表1),采用PCR方法,在xGP5m基因N端分别添加3种穿膜肽(TAT、ppTG20、MPG)基因序列,实现融合表达(图1)。

表1 PCR引物基因序列

A. PRRSV 3种毒株的GP5蛋白序列比对分析;B.重组蛋白示意图及3种穿膜肽序列
1.3 重组杆状病毒的构建
将目的基因克隆到昆虫杆状病毒表达载体pFastBacTMDual的PH启动子下的EcoRⅠ和HindⅢ 2个酶切位点,获得重组转移质粒pF-xGP5m、pF-TAT-xGP5m、pF-ppTG20-xGP5m和pF-MPG-xGP5m,基因测序正确。按常规方法,将重组转移质粒转化至DH10Bac,在X-gal、IPTG、四环素、庆大霉素和卡那霉素的平板上进行2轮蓝白斑筛选。挑取白斑进行PCR鉴定,鉴定正确后提取重组Bacmids,转染入Sf9细胞,28 ℃培养5 d,收获上清即为第一代重组杆状病毒。将获得的重组病毒于Sf9细胞上扩增至第3代,-80 ℃冻存。
1.4 间接免疫荧光鉴定重组杆状病毒
将重组杆状病毒接种长满单层的Sf9细胞,28 ℃培养72 h,用PBS洗涤3次后用预冷的无水乙醇于4 ℃固定30 min,洗涤3次,加入以PBS 1∶200倍稀释的His单抗,37 ℃孵育1 h,洗涤后加入1∶200稀释的FITC标记的山羊抗小鼠二抗,37 ℃孵育30 min,洗涤后置于荧光显微镜下观察。细胞胞浆中出现绿色荧光的细胞判定为重组蛋白表达成功。
1.5 重组杆状病毒TCID50测定
Sf9细胞铺96孔细胞板,待细胞长满单层时准备接毒用于各重组杆状病毒TCID50的测定,方法如下:10倍比稀释各重组杆状病毒液,弃去96孔板中营养液,每孔加入各稀释度的病毒液100 μL,每个稀释度设置8个重复,然后于28 ℃培养箱培养72 h后进行间接免疫荧光试验,方法如1.4,细胞胞浆中出现绿色荧光则判定为阳性孔,并使用Karber法计算各重组病毒TCID50。
1.6 Western blot检测重组蛋白表达
将重组杆状病毒接种Sf9细胞,28 ℃培养96 h,收集细胞并超声破碎,4 ℃ 12 000 r/min离心5 min分离上清沉淀,沉淀再用相同体积的PBS重悬,采用Western blot检测,分别用His单抗(PBS 1∶5 000稀释)、PRRSV阳性血清(PBS 1∶200稀释)作为一抗,二抗分别为HRP标记的山羊抗鼠IgG抗体(PBS 1∶1 000稀释)、HRP-SPA(PBS 1∶10 000稀释),最后用ECL化学发光剂显色。
1.7 小鼠免疫试验
将4种重组杆状病毒分别接种Sf9细胞(T75细胞瓶,500 μL/瓶),接毒96 h病变明显后弃培养上清,每瓶细胞加入2 mL PBS,冻融1次后,超声破碎收获2 mL细胞破碎液,采用Western blot半定量的方法将目的蛋白浓度调整一致,再分别与ISA206佐剂1∶1混合充分乳化制备疫苗。将6周龄BALB/c雌鼠50只随机分为5组,每组10只,1~4组每只小鼠皮下免疫疫苗200 μL,21 d后加强免疫1次,第5组为空白对照组。
首免后21和42 d每组分别采血测定血清ELISA抗体效价,以P/N大于2.1的最大血清稀释度作为血清的ELISA效价。ELISA具体步骤如下:使用碳酸盐缓冲液(pH=9.6)将纯化的PRRSV全病毒抗原稀释至2 μg/mL,100 μL/孔加入酶标板条,37 ℃包被2 h;之后弃去孔内液体,每孔加入200 μL PBST,振摇洗涤3次;每孔加入200 μL 5%脱脂乳,于37 ℃温箱封闭2 h后洗涤;将分离的小鼠血清按照1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800依此倍比稀释,每孔加入100 μL稀释后的待测血清,并设置标准阴阳性血清对照,37 ℃孵育1 h后洗涤;再以PBST 1∶1 000倍稀释HRP标记的山羊抗鼠IgG抗体作为二抗,100 μL/孔,37 ℃孵育30 min后洗涤;避光加入TMB显色液,100 μL/孔,37 ℃显色10 min后每孔加入50 μL终止液,酶标仪读取OD450 nm,并计算P/N值。
2 结果与分析
2.1 重组转移载体的构建与鉴定
将设计合成的xGP5m基因作为模板,采用PCR方法扩增TAT-xGP5m、ppTG20-xGP5m、MPG-xGP5m基因片段,并将4种目的基因分别克隆至pFastBacTMDual载体上的PH启动子下,获得重组质粒pF-xGP5m、pF-TAT-xGP5m、pF-ppTG20-xGP5m和pF-MPG-xGP5m,双酶切鉴定结果见图2。基因测序结果为,xGP5m、TAT-xGP5m、ppTG20-xGP5m和MPG-xGP5m基因长度分别为642、675、702和723 bp,与设计的目的基因条带完全一致。
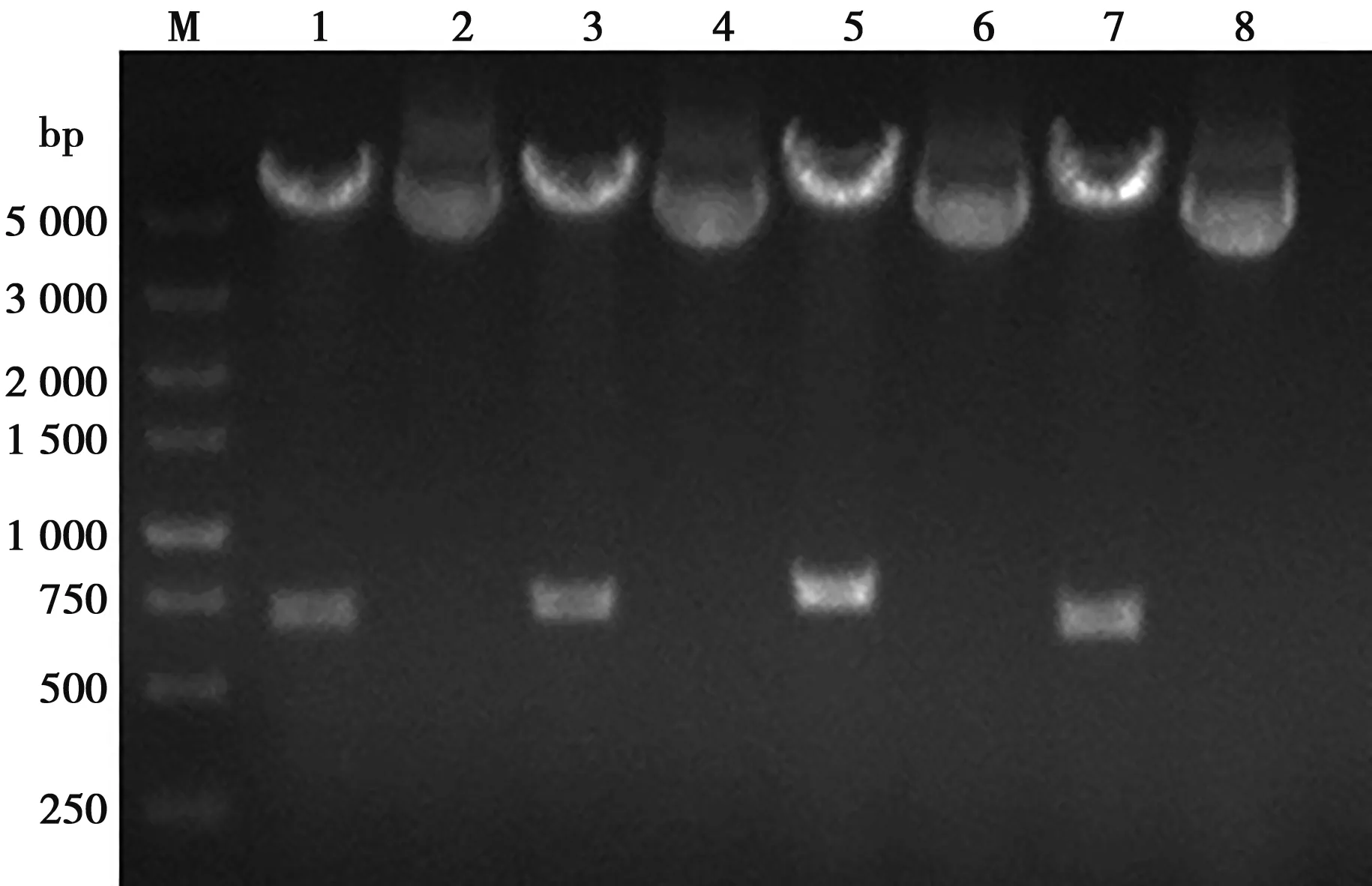
M. DL5000; 1.pF-xGP5酶切产物; 2.pFxGP5m; 3.pF-TAT-xGP5m酶切产物; 4.pF-TAT-xGP5m; 5.pF-ppTG20-xGP5m酶切产物; 6.pF-ppTG20-xGP5m; 7.pF-MPG-xGP5m酶切产物; 8.pF-MPG-xGP5m
2.2 重组杆状病毒的获得
重组转移载体转化入DH10Bac,获得含有目的基因的重组Bacmids,以pUC/M13引物对重组Bacmids进行P鉴定。分别将鉴定为阳性的重组Bacmids转染Sf9细胞,培养5 d后收获细胞培养液,于Sf9细胞传代2次,出现细胞病变,表现为细胞变大变圆、通透性增加、脱落(图3A),获得4株重组杆状病毒rAc-xGP5m、rAc-TAT-xGP5m、rAc-ppTG20-xGP5m和rAc-MPG-xGP5m。重组病毒TCID50分别为10-8.5/0.1 mL、10-9.0/0.1 mL、10-8.5/0.1 mL和10-8.75/0.1 mL。
2.3 间接免疫荧光鉴定重组杆状病毒
将重组杆状病毒接种长满单层的Sf9细胞,培养72 h,用His单抗进行间接免疫荧光试验,荧光显微镜下观察,重组杆状病毒感染细胞胞浆中出现绿色荧光(图3B)。
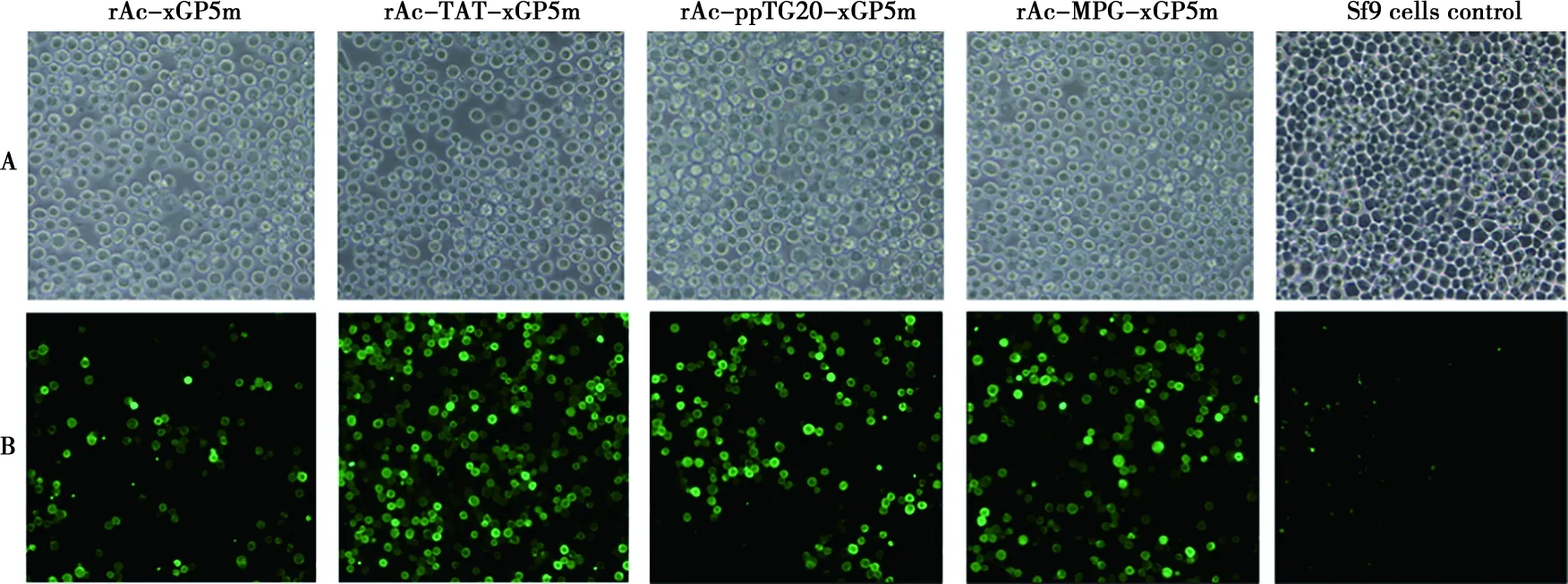
图3 重组杆状病毒感染Sf 9细胞引起的细胞病变(A)及间接免疫荧光试验(B)
2.4 Western blot检测重组蛋白表达
将重组杆状病毒接种长满单层的Sf9细胞,96 h后收样分别用His-Tag单抗、PRRSV阳性血清作为一抗进行Western blot鉴定,结果(图4)显示在上清和沉淀中均可检测到特异性条带,与目的蛋白大小一致,并且目的蛋白获得了较好的糖基化修饰,表明4种重组蛋白均可以表达,且rAc-TAT-xGP5m表达量最高。
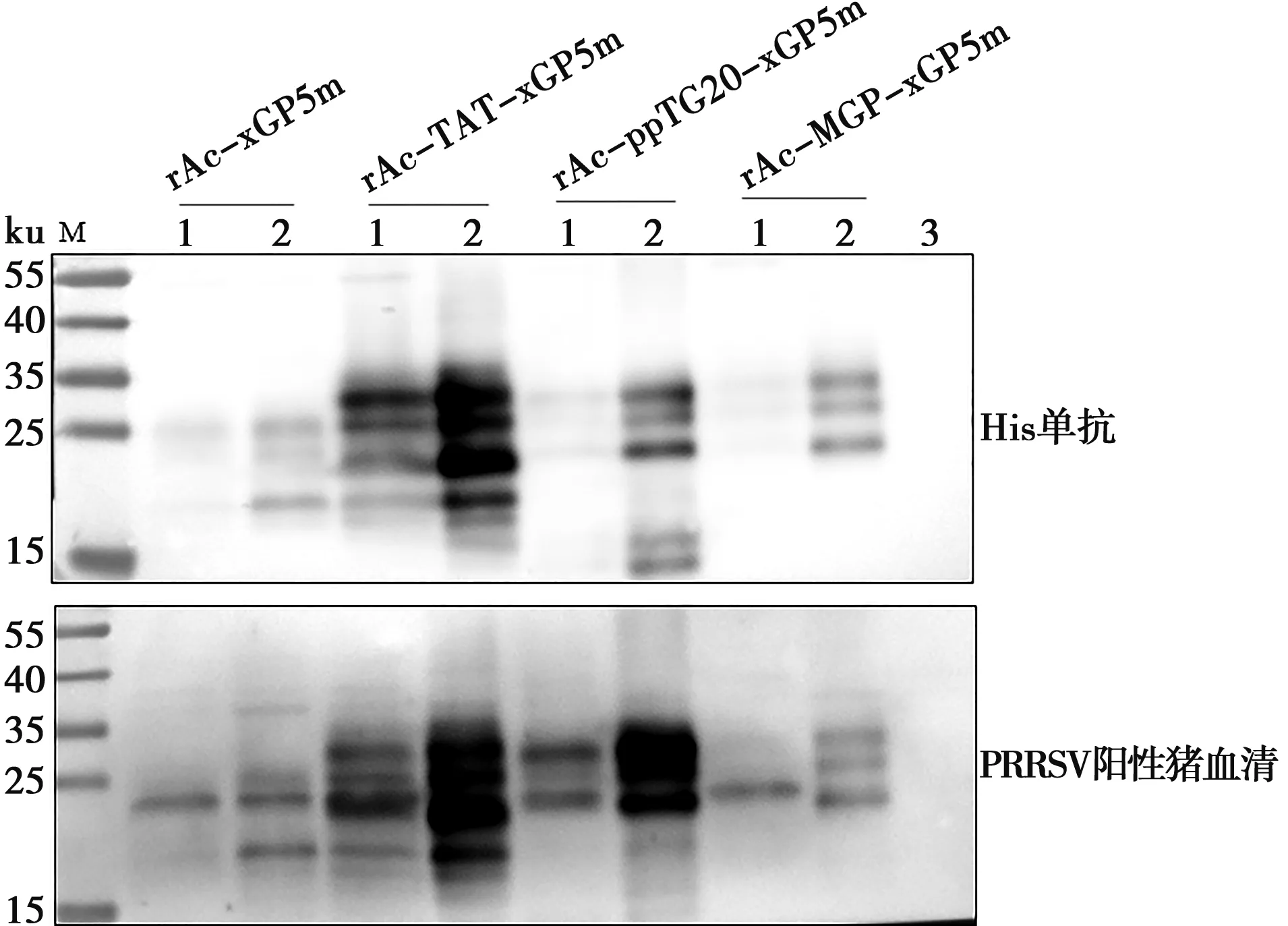
M.蛋白质分子质量标准;1. 重组杆状病毒感染细胞裂解液离心上清液;2. 重组杆状病毒感染细胞裂解液离心沉淀物;3. Sf9细胞裂解液
2.5 重组蛋白免疫原性分析
小鼠首次免疫后21和42 d采集小鼠血清,采用纯化的PRRSV全病毒作为包被抗原,进行间接ELISA检测PRRSV抗体,结果见图5。首免后42 d rAc-TAT-xGP5m免疫组抗体水平极显著高于其他3个免疫组(P<0.001),表明融合TAT穿膜肽可有效增强xGP5m免疫效果,rAc-TAT-xGP5m重组蛋白具有良好的免疫原性。
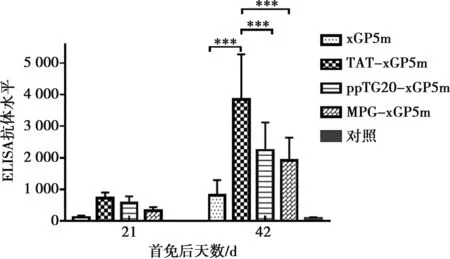
***表示P<0.001
3 讨论
我国自1995年首次暴发PRRSV以来,先后出现高致病性PRRSV和NADC30-like毒株流行[7]。目前呈现多种基因亚型PRRSV流行,而且不同基因亚型毒株之间基因重组频发,新的变异毒株不断增多,猪场经济损失十分严重。
PRRSV商品化的灭活苗和弱毒苗免疫保护效果有限,安全高效的新型疫苗研制受到国内外持续关注,包括基因疫苗、活载体疫苗和亚单位疫苗等[8-11]。Plana等[11]运用杆状病毒表达PRRSV的ORF2~ORF7基因,证明GP5蛋白可对免疫母猪提供部分保护。但PRRSV流行毒株GP5基因变异较大,不同毒株间交叉免疫保护作用不够理想[12]。本研究比对了我国PRRSV主要流行毒株S1(经典型)、BB0907(高致病型)和FJ1402(NADC30-like毒株)的GP5蛋白氨基酸序列,选取其共有的氨基酸组合为杂合GP5序列,构建重组杆状病毒,实现了GP5与3种穿膜肽的融合表达,其中TAT-xGP5m重组杆状病毒感染细胞目的蛋白呈现可溶性表达,具有PRRSV抗原性和免疫原性,为PRRSV新型疫苗研制奠定了基础。
PRRSV GP5蛋白为糖基化跨膜蛋白,基因工程表达产物一般与细胞膜结合,表达效率较低。穿膜肽又称细胞穿透肽(cell-penetrating peptides,CPPs),一般由碱性氨基酸组成,可携带大分子直接穿越磷脂双分子层实现跨膜转运,并且能通过提高免疫细胞的聚集来调控先天性和适应性免疫应答[13]。Keogan等[14]报道穿膜肽TAT能够抑制HIV-1复制。肖少波等[15]研究发现融合表达穿膜肽VP22与PRRSV GP5能增强GP5蛋白诱导的体液免疫和细胞免疫反应。本研究将3种穿膜肽(TAT、ppTG20、MPG)序列添加至xGP5m基因N端,成功构建4种重组杆状病毒。其中TAT-xGP5m上清和沉淀的表达量均明显高于xGP5m、ppTG20-xGP5m和MPG-xGP5m,实现了GP5蛋白的高水平和可溶性表达,但是Western blot结果中存在杂带,可能是由于His单抗及PRRSV阳性血清与表达产物中的一些蛋白发生了非特异性结合。TAT-xGP5m重组杆状病毒感染细胞的裂解物免疫小鼠,其PRRSV抗体水平明显高于xGP5m免疫组,说明TAT能促进GP5蛋白可溶性表达,增强其小鼠体液免疫应答能力。当然,重组杆状病毒感染细胞目的蛋白的表达量及其猪体免疫特性尚需进一步研究。

