猪源盖塔病毒Cap蛋白与E2蛋白多克隆抗体的制备及其免疫特性分析
苏靖茵,燕诗雨,张萌,粟硕
(南京农业大学免疫研究所,江苏 南京 210095)
盖塔病毒(Getah virus, GETV)是典型的虫媒病毒,最早于1955年从马来西亚的白雪库蚊中分离并命名,随后陆续又从猪群、马群中分离出该病毒。近年来,世界各国出现母猪感染零星病例,而在2017年中国湖南猪场出现母猪和仔猪盖塔病疫情[1]。临床上,GETV对猪和马的侵害性较大,他们的症状主要表现为发热、浮肿等[2]。GETV在国内外均有流行,且我国陆续报道除马、猪以外的多种动物(牛和狐狸等)感染病例[3]。
GETV是单股正链RNA病毒,属于披膜病毒科甲病毒属的成员。GETV全基因组长11~12 kb,包含2个开放阅读框,分别编码非结构蛋白和结构蛋白。GETV的5个结构蛋白分别是C、E3、E2、6K和E1。在甲病毒中,Cap蛋白是一种多功能蛋白,包含N端RNA结合域和C端结构域[4]。Cap蛋白能与病毒基因组特性结合,这会影响病毒核衣壳形成和RNA合成[5]。此外,Cap蛋白不仅能促进核衣壳组装过程中Cap蛋白二聚作用,还能促进在出芽过程中与糖蛋白细胞质结构域的相互作用[6]。E2是糖蛋白,分子量约为50 kDa;pE2是E2的前体,能裂解成E2和E3[5]。在甲病毒粒子感染过程中,E2作为介导病毒进入宿主细胞的主要蛋白。
GETV的Cap蛋白与E2蛋白可能在病毒感染和病毒复制中起重要重要作用。但现今对于GETV的病毒蛋白与及致病机制等研究仍较少[7],而GETV的抗体能促进其相关研究。因此,本文通过了原核表达Cap和E2蛋白并制备了GETV的多抗,以用于GETV的基础研究。
1 材料与方法
1.1 材料
Vero、BHK细胞和pET-32a(+)载体均为本实验室保存。DH5α与BL21(DE3)感受态均购自康为公司。GETV由本实验室分离纯化后保存。6~8周龄雌性BALB/c小鼠,购自上海西普尔-必凯实验动物公司。
限制性内切酶购自NEB公司;DNA Marker购自TaKaRa公司;胎牛血清、DMEM培养基、标准蛋白Marker均购自赛默飞公司;高保真DNA聚合酶、同源重组连接试剂盒,化学发光试剂(ECL)显色液均购自诺唯赞公司;辣根过氧化物酶(HRP)标记的山羊抗鼠抗体、HRP标记的山羊抗兔抗体、异硫氰酸荧光素(FITC)标记的山羊抗鼠的抗体均购自KPL公司;His兔源抗体购自ABclonal公司。
1.2 方法
1.2.1 引物设计
以GenBank中登录的GETV毒株NC_006558.1为参考毒株,设计E2基因糖蛋白区域和Cap基因编码区特异性引物。引物由南京金斯瑞公司合成。
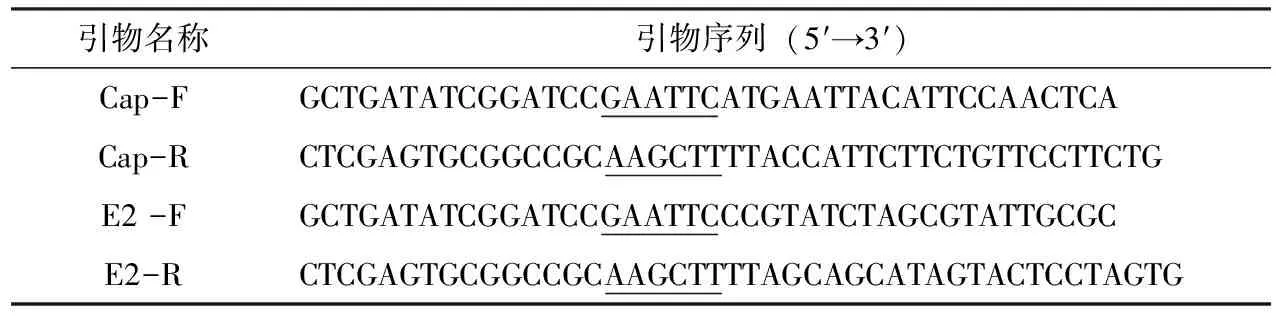
表1 GETV-Cap基因和GETV-E2基因扩增引物
1.2.2 目的基因的扩增
Vero细胞长至80%~90%时,接种GETV,细胞出现病变后,加入TRIzol裂解细胞。按照TRIzol试剂说明书,提取细胞培养物中病毒的RNA。使用RT-PCR方法扩增Cap基因及E2基因,反应体系为50 μL,反应条件为:94 ℃,4 min;98 ℃ 10 s,58 ℃ 30 s,72 ℃ 1 min,38 个循环;72 ℃ 10 min。PCR产物凝胶电泳后,回收目的片段。
针对水产品运输环节监管,2017年,佛山市建立鲜活水产品跨区域产销对接监管协作机制,与长沙市食安办、食药监、农业等部门联合签署《加强区域间鲜活水产品产销对接监管合作框架协议》。建立水产品质量安全联盟,以何氏水产为代表的10多家大型水产品经营企业共同建立了统一的“收贩运”质量标准体系,有效解决水产品运输环节非法添加问题。
1.2.3 原核表达质粒的构建
空载体pET-32a(+)经EcoRⅠ与HindⅢ双酶切后回收载体。使用同源重组酶将回收目的片段与回收后的载体连接。连接产物转DH5α,并涂布于含氨苄抗性的平板,37 ℃培养12~16 h。挑取单菌落,37 ℃扩培后,提质粒双酶切(EcoRⅠ与HindⅢ)鉴定。根据酶切鉴定的结果,将阳性克隆送公司测序,鉴定正确后获得质粒pET-Cap和pET-E2。
1.2.4 Cap与E2原核表达
将空载体pET-32a(+)、pET-Cap和pET-E2质粒分别转入BL21(DE3)感受态中,挑取单菌落获得pET-32a(+)、pET-Cap和pET-E2表达菌种。将pET-Cap 和pET-E2 菌种接种至含氨苄抗性的LB培养基中,37 ℃培养至菌液OD600值为0.6~0.8。摸索诱导条件分别为:诱导温度为37、25 和16 ℃;异丙基-β-D-硫代半乳糖苷(IPTG)浓度为0.5、1.0 和1.5 mmol/L;诱导时间为3、5和7 h。选取较优诱导条件,诱导后取菌体超声约30 min至菌体清亮。12 000 r/min离心,分离上清与沉淀。将沉淀溶于包涵体溶解液中,4 ℃过夜,具体操作参考文献[8]。SDS-PAGE分析pET-Cap和pET-E2原核表达蛋白主要分布于包涵体中。把原核表达蛋白经镍柱亲和层析纯化,通过SDS-PAGE分析纯化效果。纯化后的蛋白使用脲素梯度稀释法进行透析复性,4 ℃,12 h/次,前后经过复性液1~4,具体操作参考文献[9-10]。将复性蛋白和诱导空载体分别制备成蛋白样品,SDS-PAGE分析后,半干转至硝酸纤维素膜(NC膜);5% 脱脂奶封闭后,孵育His抗体和HRP标记的山羊抗兔抗体,ECL发光显色。
1.2.5 小鼠多抗血清制备
复性的Cap和E2蛋白分别作为免疫原,经皮下背部多点方式,100 μg/只,免疫6~8周龄雌性BALB/c小鼠。首免免疫原和等体积完全弗氏佐剂乳化,而二免和三免用不完全弗氏佐剂替代完全弗氏佐剂。每次免疫间隔为2周,三免后1周采血,分离免疫小鼠血清作为阳性血清,不免疫小鼠血清作为阴性血清。ELISA测定血清效价,分别测定梯度稀释后的阳性血清效价,操作参照文献[11],酶标仪读取各孔的OD值。
1.2.6 Westeron blot鉴定
BHK细胞以感染复数(MOI) 0.01接种GETV,细胞病变后48 h,制备接种与不接种GETV的蛋白样品,细胞裂解后收集样品,加入4×上样缓冲液后煮样。经SDS-PAGE分析后转至NC膜;封闭NC膜后,孵育Cap和E2 阳性血清一抗和HRP标记的山羊抗鼠二抗;洗膜后,ECL发光显色。
1.2.7 免疫荧光试验(IFA)鉴定
BHK细胞长至80%以上时,以MOI为0.01接种GETV,48 h后使用冰甲醇固定细胞。封闭后,分别与 E2、Cap血清和PBS(对照组)作用;接着以FITC标记的山羊抗鼠的抗体为二抗孵育,并使用4′,6-二脒基-2-苯基吲哚(DAPI)染核,最后倒置显微镜下观察拍照。
2 结果与分析
2.1 PCR目的条带扩增与质粒构建
以GETV的cDNA为模板,通过Cap特异性引物,RT-PCR方法扩增出约800 bp的片段(图1A),与GETV的Cap基因理论值(804 bp)相符;通过E2特异性引物,用RT-PCR方法扩增出约1 200 bp的片段(图1B),与GETV的E2基因理论值(1 209 bp)大小一致。
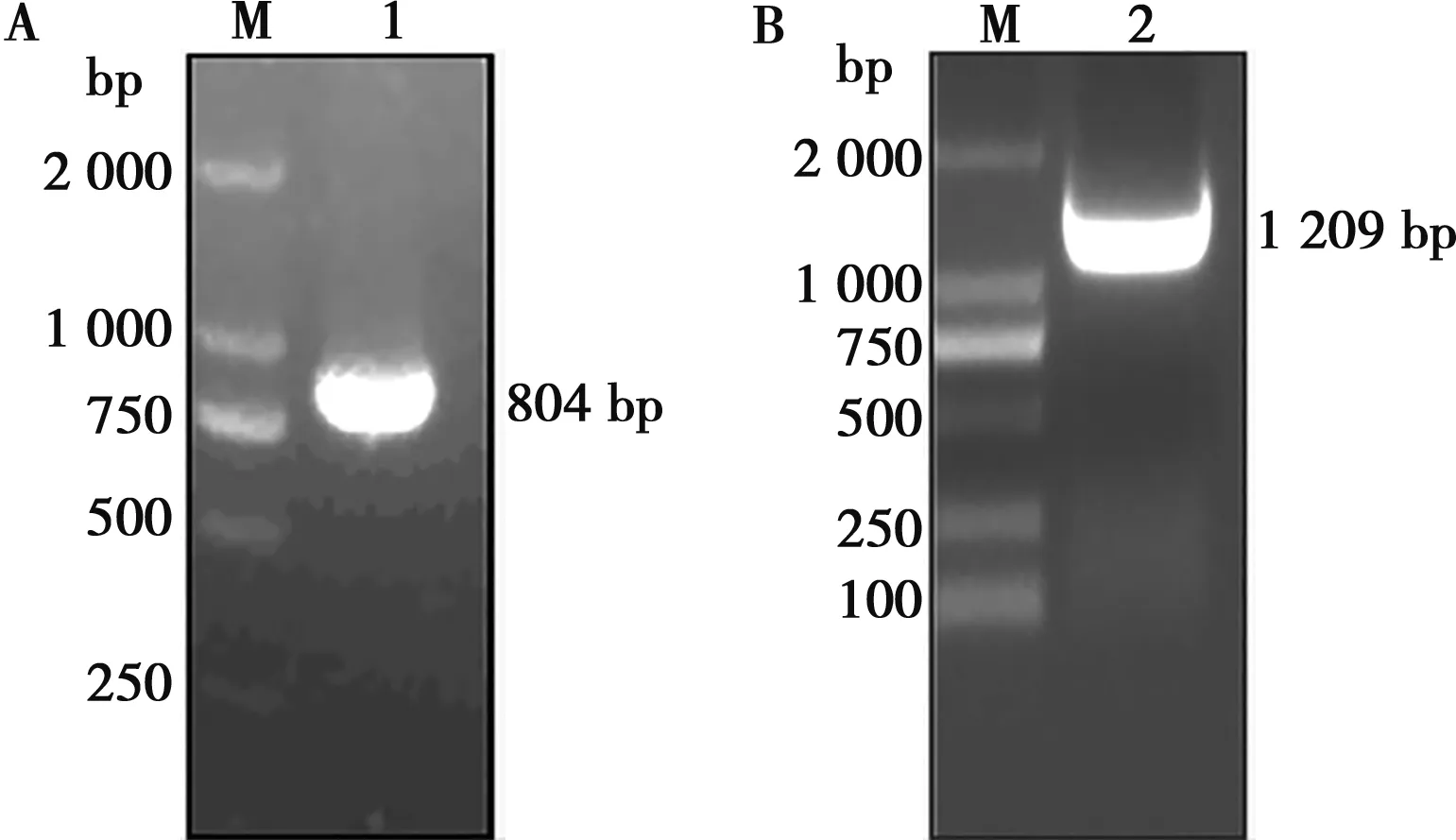
M. DNA Marker DL2000;1. Cap基因;2. E2基因
2.2 重组质粒的构建与鉴定
同源重组酶将目的片段与双酶切(EcoRⅠ和HindⅢ)的pET-32a(+)连接,构建成重组克隆质粒。分别使用Cap和E2的特异性引物,以Cap阳性质粒和E2阳性质粒为模板,分别扩增出804 bp与1 209 bp的单一条带。质粒酶切鉴定结果显示,空载体酶切后可见大小为5 900 bp条带;Cap阳性质粒有5 900和804 bp 2条带;E2阳性质粒有2条分别在5 900和1 209 bp附近的条带,均符合预期(图2)。将阳性质粒送公司测序,测序结果与原始序列比对一致,分别命名为pET-Cap和pET-E2。
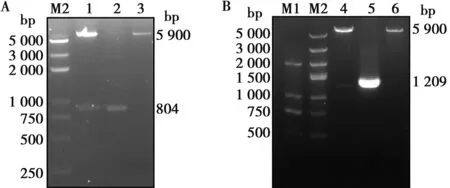
M1. DNA Marker DL2000;M2. DNA Marker DL5000;1.双酶切pET-Cap质粒;2.Cap基因扩增;3.双酶切空载体;4.双酶切pET-E2质粒;5.E2基因扩增;6.双酶切空载体
2.3 重组蛋白的表达与纯化
通过比较不同条件下诱导pET-Cap情况,最终选择诱导条件为:IPTG浓度为1 mmol/L,37 ℃,诱导3 h。诱导后包涵体中40~55 kDa附近有明显条带,而上清仅有少量蛋白,表明Cap蛋白主要在包涵体中大量表达(图3A)。包涵体中的蛋白经镍柱亲和层析纯化后获得重组Cap蛋白(图3B)。纯化复性后Cap蛋白样品与His抗体结合,在40~55 kDa附近有条带,纯化复性蛋白为重组Cap蛋白(图3C)。
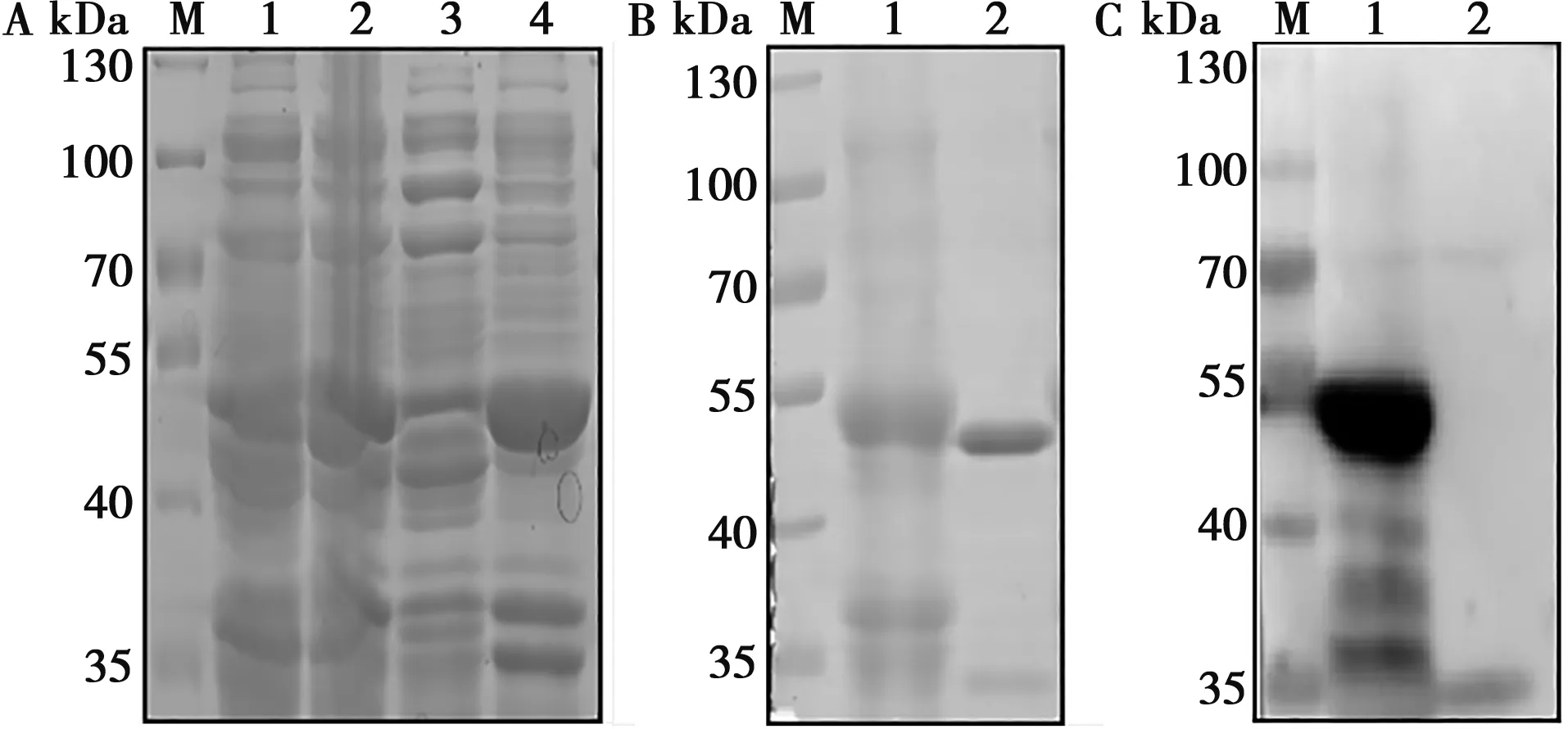
A.pET-Cap表达:M.标准蛋白Marker;1. pET-Cap未诱导;2.pET-Cap诱导;3.pET-Cap超声后上清;4.pET-Cap超声后沉淀;B.Cap蛋白纯化:M.标准蛋白Marker;1.纯化pET-Cap沉淀;2.复性Cap蛋白;C.Cap蛋白与His抗体反应:M.标准蛋白Marker;1.复性Cap蛋白;2.pET-32a(+)诱导
通过分析比较不同温度、时间与不同浓度的IPTG诱导pET-E2的效果,IPTG浓度为1 mmol/L时,在25 ℃,诱导5 h下E2蛋白大量表达,55~70 kDa附近有蛋白带,且蛋白主要存在于包涵体中(图4A)。经镍柱亲和层析纯化和复性透析包涵体中蛋白后,获得重组E2蛋白(图4B)。纯化复性后的E2蛋白与His抗体反应,在55 kDa处有明显条带而空载体没有,表明纯化复性的蛋白为重组E2蛋白(图4C)。
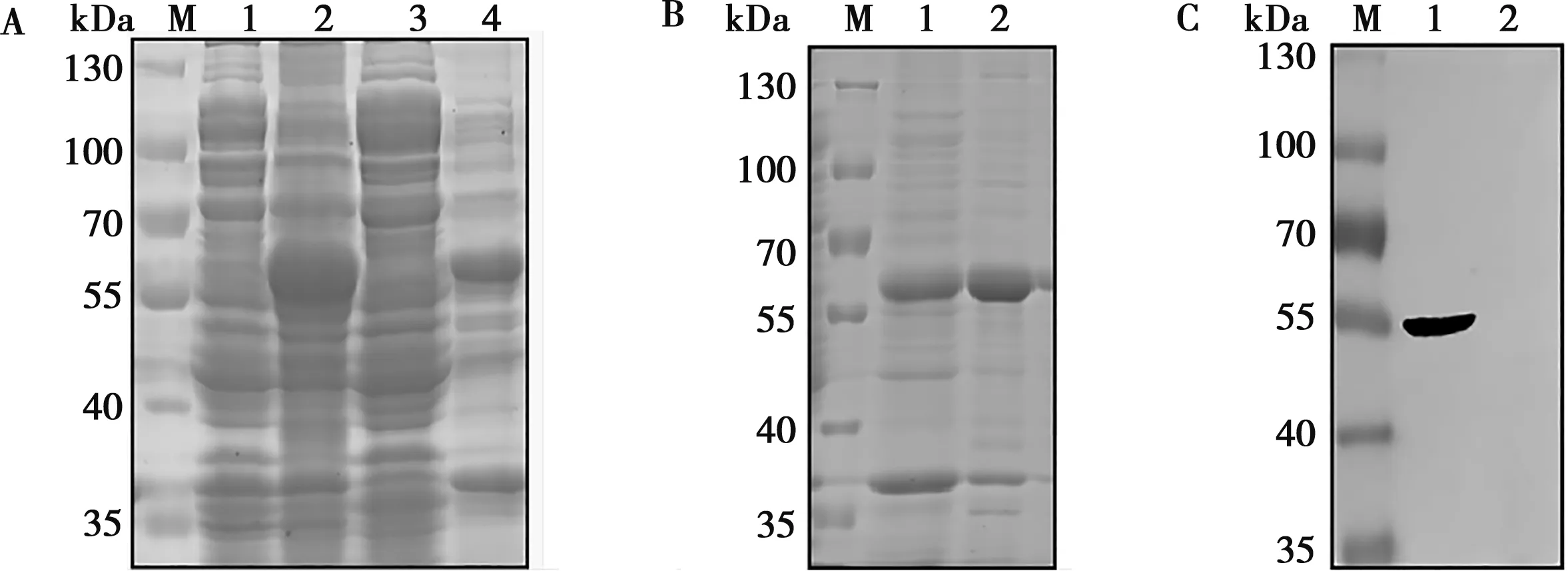
A.pET-E2表达:1. pET-E2未诱导;2.pET-E2诱导;3.pET-E2超声后上清;4.pET-E2超声后沉淀;M.标准蛋白Marker;B. E2蛋白的纯化:1. 纯化pET-E2沉淀;2.复性E2蛋白;C. E2蛋白与His抗体反应:1.复性E2蛋白;2.pET-32a(+)诱导
2.4 Cap蛋白与E2蛋白多克隆抗体的制备
Cap与E2原核表达蛋白分别免疫小鼠制备多克隆抗体,经3次免疫后ELISA检测小鼠血清抗体效价,结果2种抗体效价均达到1∶105以上。
2.5 Western blot 验证多抗效果
GETV的Cap蛋白理论大小约为30 kDa,BHK(图5A)和Vero(图5C)细胞接种病毒后不同时间点的样品在25~35 kDa附近可见有明显条带,而不接种病毒样品未见条带,说明Cap多抗能与GETV发生特异性结合。
GETV的E2蛋白理论大小为46 kDa,其前体pE2为62 kDa。BHK(图6B)和Vero(图6C)细胞接种病毒后不同时间点的样品在40~55 kDa与55~70 kDa附近均可见明显条带,而不接种病毒样品未见条带,说明E2多抗与GETV的反应性良好。
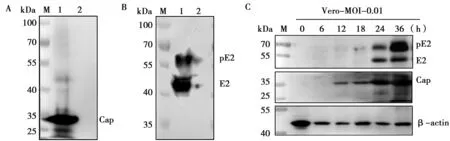
M.蛋白标准Marker;1.BHK细胞接种GETV;2.BHK细胞不接种病毒
2.6 IFA验证多抗效果
GETV接种于BHK细胞,以Cap多抗和E2多抗为一抗进行IFA,均可检测到绿色荧光,而对照组没有绿色荧光,说明Cap多抗和E2多抗能特异性识别GETV(图6)。
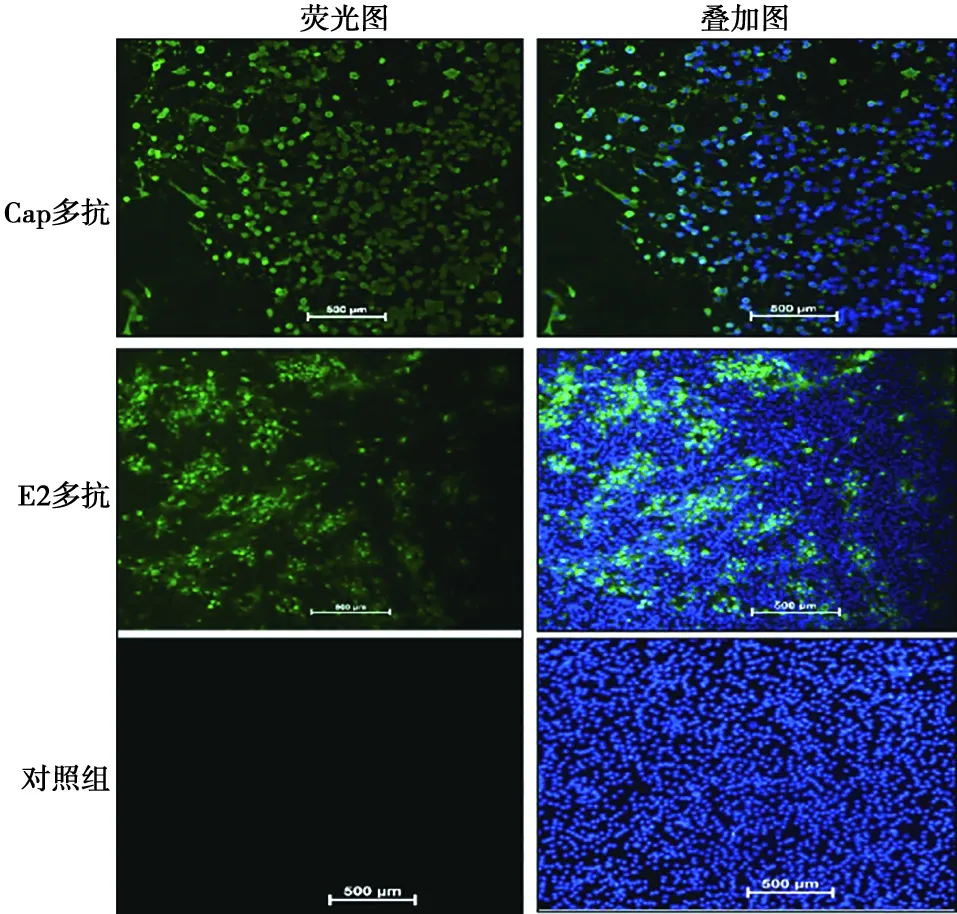
图6 Cap和E2多抗与GETV反应性的IFA鉴定(标尺=500 μm)
3 讨论
GETV在我国广西、四川、云南、海南、河北、湖南和甘肃等多地均有报道,表明该病毒在我国普遍流行[12]。在自然界中,GETV是一种虫媒病毒,带毒蚊虫通过叮咬猪、马、鼠等易感动物,使病毒在这些动物体内增殖[13]。Li等[14]对家畜血清样本进行调查后,发现在鸡、鸭、奶牛、猪和肉牛中均能检测GETV的中和抗体,其中猪和肉牛抗体阳性率较高(46%~72%)。2010年在河北省涉县出现正常人群和发烧患者感染GETV情况,流行病学筛查后发现正常人群的总感染率高达16.67%,远高于海南琼中地区的阳性率(约2.0%)[15]。这说明GETV可能具有重要的公共卫生学意义。
近年来对甲病毒的功能报道较多,而GETV的报道相对较少。研究发现甲病毒囊膜蛋白E2存在糖基化位点、宿主细胞受体识别位点和中和抗体的识别位点[5]。甲病毒科辛德比斯病毒(Sindbis virus)E2蛋白单抗能够影响病毒在体内和体外的复制[16]。E2单抗处理后感染病毒,尽管细胞内核衣壳蛋白和囊膜蛋白仍持续合成,但病毒粒子释放减少[17]。甲病毒囊膜糖蛋白E2蛋白C端接触的是由Cap蛋白和基因组RNA组成的病毒核衣壳[6]。一旦核衣壳蛋白从初生的多肽链中释放出来,N端信号序列将发挥作用,导致糖蛋白pE2插入内质网[5]。甲病毒的Cap蛋白N端结构域虽保守性较低,富含正电荷。Cap蛋白存在核定位信号和核出口信号位点,在核胞质运输中发挥作用[18]。而Cap蛋白的C端蛋白酶结构域高度保守,Cap蛋白的114~264残基表面存在疏水区域,并被誉为疏水口袋。该口袋能与E2蛋白C端的16个残基相互作用[19],该结合在甲病毒组装中发挥积极作用。
目前,国内外对于GETV的E2蛋白研究主要是基于原核表达E2蛋白并建立ELISA方法[20- 21],而对于其抗体制备报道较少。E2与Cap蛋白抗体对研究GETV蛋白的功能起着重要的作用。姜焱等[22]成功制备了GETV的Cap蛋白多抗,但没有进一步验证Cap多抗与GETV的反应性。GETV的Cap蛋白与E2蛋白多抗不仅能应用于分离鉴定GETV,还能应用于流行病学调查。为深入了解GETV,本文制备了其鼠源Cap多抗与E2多抗,Western blot和IFA均证实此2种多抗均能特异性识别GETV,为进一步探究GETV致病机制提供了物质基础。

