HER2阳性乳腺癌细胞来源的可溶性PD-L1对巨噬细胞极化的调控作用探讨*
袁惠玲,吴丽华,陈桂林,黄珂铭
(南方医科大学附属东莞人民医院乳腺科,广东东莞 523000)
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌(以下简称HER2+乳腺癌)是一类由HER2/neu引发的低免疫力型恶性乳腺肿瘤,占原发性浸润性乳腺癌的15%~30%[1-2]。研究发现,HER2/neu是一种具有酪氨酸激酶活性的免疫原性蛋白,可在HER2+肿瘤患者中引起体液和细胞免疫反应[3]。无论是通过“免疫编辑”还是其他免疫逃逸机制,在HER2+乳腺癌肿瘤微环境中对HER2/neu的细胞免疫反应减弱都与较差的预后相关[4]。相反,针对HER2/neu的细胞和体液反应增加与肿瘤发生减少和预后改善有关[5]。HER2/neu过表达的癌症患者通常表现出针对该蛋白的现有免疫力降低[5]。因此,HER2/neu在刺激致瘤性免疫微环境中起关键调节作用,然而HER2/neu是否参与乳腺癌免疫微环境稳态调节尚未明确。
巨噬细胞是一群具有调控肿瘤免疫微环境稳态作用的固有免疫细胞亚群,根据其表型分为M1或M2样状态[6]。M1型巨噬细胞与促炎反应有关,而M2型巨噬细胞与血管新生和炎症抑制相关[6]。乳腺癌中的肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)主要是M2型巨噬细胞亚群,其促进乳腺肿瘤细胞的多种生物学进程,包括肿瘤细胞生长、侵袭和转移[7];其次,TAM还可以在乳腺癌模型中诱导对多种治疗的耐药性[8]。重要的是,HER2蛋白过表达或基因扩增发生在20%~30%的新诊断的晚期乳腺癌患者中,且晚期乳腺癌表现出高度极化的M2型TAM[8]。然而,HER2+乳腺癌细胞是否影响巨噬细胞极化仍不清楚。因此,在本研究中:(1)论证HER2+乳腺癌患者外周血和癌组织中可溶性程序性死亡配体1(soluble programmed death-ligand 1,sPD-L1)和癌组织局部巨噬细胞极化的关系;(2)体外探究HER2-腺癌细胞系和HER2+腺癌细胞系培养上清sPD-L1水平的差异;(3)探究HER2-腺癌细胞系和HER2+腺癌细胞系培养上清对巨噬细胞极化和功能的影响,以揭示HER2+和HER2-乳腺癌细胞对巨噬细胞极化的影响,并为HER2+和HER2-乳腺癌的抗PD-L1治疗提供新的理论支持。
1 资料与方法
1.1 一般资料
征集2018年4月至2020年6月HER2-和HER2+乳腺癌患者各20例。纳入标准:(1)术后经病理检查诊断为浸润性乳腺癌;(2)术前未进行放化疗和免疫治疗;(4)符合HER2+乳腺癌或HER2-乳腺癌判定标准,即免疫组织化学染色雌激素受体阴性(ER-)孕激素受体阴性(PR-)和HER2+细胞80%以上判为HER2+乳腺癌,ER-PR-和HER2-细胞80%以上判为HER2-乳腺癌。排除标准:(1)有远端转移者;(2)其他肿瘤转移到乳腺者;(3)合并严重心、肝、肾衰竭者;(4)合并严重心血管疾病者;(5)合并其他系统严重原发病者,如消化道疾病、泌尿系统疾病等。收集患者一般临床资料,两组年龄、体重指数(BMI)、肿瘤尺寸,以及淋巴结阳性、3级肿瘤、HER1+、ER+、PR+患者百分比比较,差异均无统计学意义(P>0.05);两组Ki-67+患者百分比比较,差异有统计学意义(P<0.05),见表1。本文研究经本院伦理委员会审核批准,所有患者、志愿者均对本研究知情并签署知情同意书。
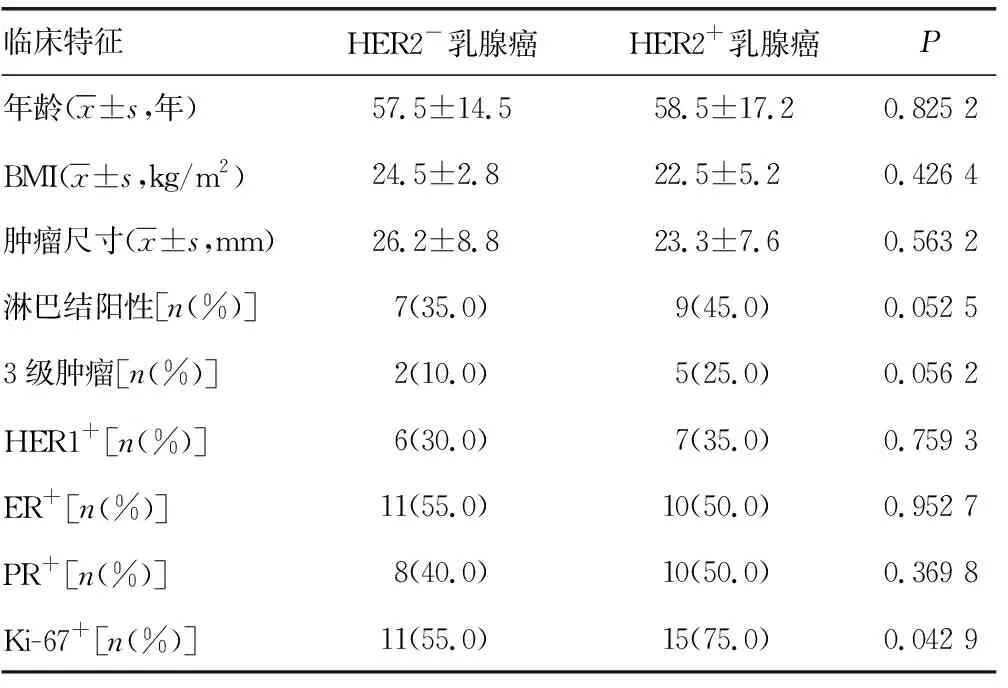
表1 HER2-和HER2+乳腺癌患者临床特征比较(n=20)
1.2 方法
1.2.1细胞培养和干预
乳腺癌细胞系BT-474、SK-BR-3、MDA-MB 453和MDA-MB 468购自武汉普诺赛生命科技有限公司。所有细胞系在含有100 U/mL青霉素、100 mg/mL链霉素(美国Thermo Fisher Scientific公司)和10%胎牛血清(四季青,浙江天杭生物科技股份有限公司)的RPMI-1640培养基(美国Thermo Fisher Scientific公司)中常规培养。培养条件:37 ℃,5% CO2培养箱。5×105个细胞接种于6孔板,培养24 h贴壁后,收集0、12、24和48 h的培养上清液,1 000×g离心10 min。弃去沉淀后保留上清液,即为乳腺癌细胞条件性培养基(breast cell conditional medium,BCM)。
1.2.2ELISA
根据人PD-L1 ELISA说明书(武汉华美生物工程有限公司)检测HER2-和HER2+乳腺癌患者外周血浆和组织匀浆液中sPD-L1表达。称取约100 mg组织,用1 mL磷酸盐缓冲液(PBS)漂洗组织。然后加入含苯甲基磺酰氟(PMSF,武汉塞维尔生物科技有限公司)的RIPA裂解液匀浆破碎后14 000×g 4 ℃离心20 min,收集上清液。将50 μL血浆和组织匀浆液加入微孔中,然后在室温下于黑暗处孵育60 min。将液体从孔中倒出,并用吸收纸轻拍以确保液体完全通过孔排出。然后将偶联酶(50 μL)加入孔中,在室温下于黑暗处孵育60 min。洗涤过程重复3次。这些过程之后,将底物(50 μL)添加到每个孔中,并在室温下在黑暗处孵育30 min。每孔加入终止试剂,并测定450 nm处的吸光度值(A450值)。每个样品重复测量3次。
1.2.3人外周血单个核细胞分离和原代巨噬细胞培养
HER2-和HER2+乳腺癌患者外周血单个核细胞(peripheral blood mononuclear cells,PBMC)收集至乙二胺四乙酸(EDTA)处理抗凝采血管中,混匀后加入至等体积的单个核细胞淋巴分离液(天津市灏洋生物制品科技有限责任公司)上层,800×g离心30 min后吸取单个核细胞层。加入PBS漂洗3次。加入含有100 U/mL青霉素、100 mg/mL链霉素(美国Thermo Fisher Scientific公司)和10%胎牛血清(美国Thermo Fisher Scientific公司)的RPMI-1640培养基(美国Thermo Fisher Scientific公司)中重悬并计数。1×105个细胞接种于12孔板,每孔加入50 ng/mL重组人巨噬细胞集落刺激因子(recombinant human macrophage colony-stimulating factor,rhM-CSF,美国PeproTech公司),培养7 d贴壁后加入BCM培养24 h。
1.2.4流式细胞术
巨噬细胞的表型检测采用异硫氰酸荧光素(FITC)偶联的抗人CD68(61D3)、PE-Cyanine7偶联的抗人CD86(IT2.2)和PE-Cyanine7偶联的抗人CD206(19.2),均购自美国eBioscience公司。采用1% TritonX-100破膜10 min后,加入PBS漂洗重悬,加入上述抗体2.5 mL。室温孵育30 min 后加入PBS漂洗重悬。通过NovoCyte流式细胞仪分析巨噬细胞的表型,使用Treestar FlowJo 10.0.7版软件(美国TreeStar公司)分析数据。
1.2.5总RNA提取和实时荧光定量PCR(qRT-PCR)
采用Trizol法提取巨噬细胞总RNA。使用Nanodrop分光光度计(美国Thermo Fisher Scientific公司)分析RNA浓度和纯度。1 000 ng RNA采用第一岛链cDNA合成试剂盒(美国Thermo Fisher Scientific公司)合成cDNA。以10 ng为模板,采用SYBR Green Ⅰ染料(日本TaKaRa公司)在qRT-PCR仪(型号:Applied Biosystems 7900)检测mRNA基因表达水平。反应条件:98 ℃ 3 min,98 ℃ 10 s,60 ℃ 30 s,扩增40个循环,采用2-ΔΔCt计算扩增倍数。引物见表2。

表2 qPCR引物序列
1.2.6Western blot
乳腺癌细胞系总蛋白采用RIPA裂解液(上海碧云天生物技术有限公司)提取。5×105个细胞接种于6孔板,培养24 h贴壁后培养48 h。弃去上清液后PBS漂洗1次,加入300 μL含1 mmol/L的PMSF(武汉塞维尔生物科技有限公司)孵育10 min。收集至1.5 mL EP管中,超声5 s。14 000×g 4 ℃离心20 min。上清液采用Broadford检测蛋白浓度并变性。以50 μg蛋白上样量在10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离胶电泳分离,300 mA恒流湿转2 h至聚偏二氟乙烯膜上,含5%牛血清清蛋白(BSA)的TBST溶液室温封闭1 h,加入HER2一抗(北京博奥森生物技术有限公司)后4 ℃摇床孵育12 h,第2天TBST室温漂洗3次,每次5 min。室温孵育二抗(北京博奥森生物技术有限公司)1 h,TBST溶液以1∶5 000稀释,TBST室温漂洗3次,每次5 min。电化学发光(ECL)试剂盒(上海碧云天生物技术有限公司)发光显示。蛋白表达采用ImageJ软件分析灰度值,标准化至β-actin(北京博奥森生物技术有限公司)灰度值。
1.3 统计学处理

2 结 果
2.1 HER2-和HER2+患者外周血浆和组织匀浆液中sPD-L1表达水平
HER2+患者外周血浆和组织匀浆液中sPD-L1表达水平明显高于HER2-患者,见图1。
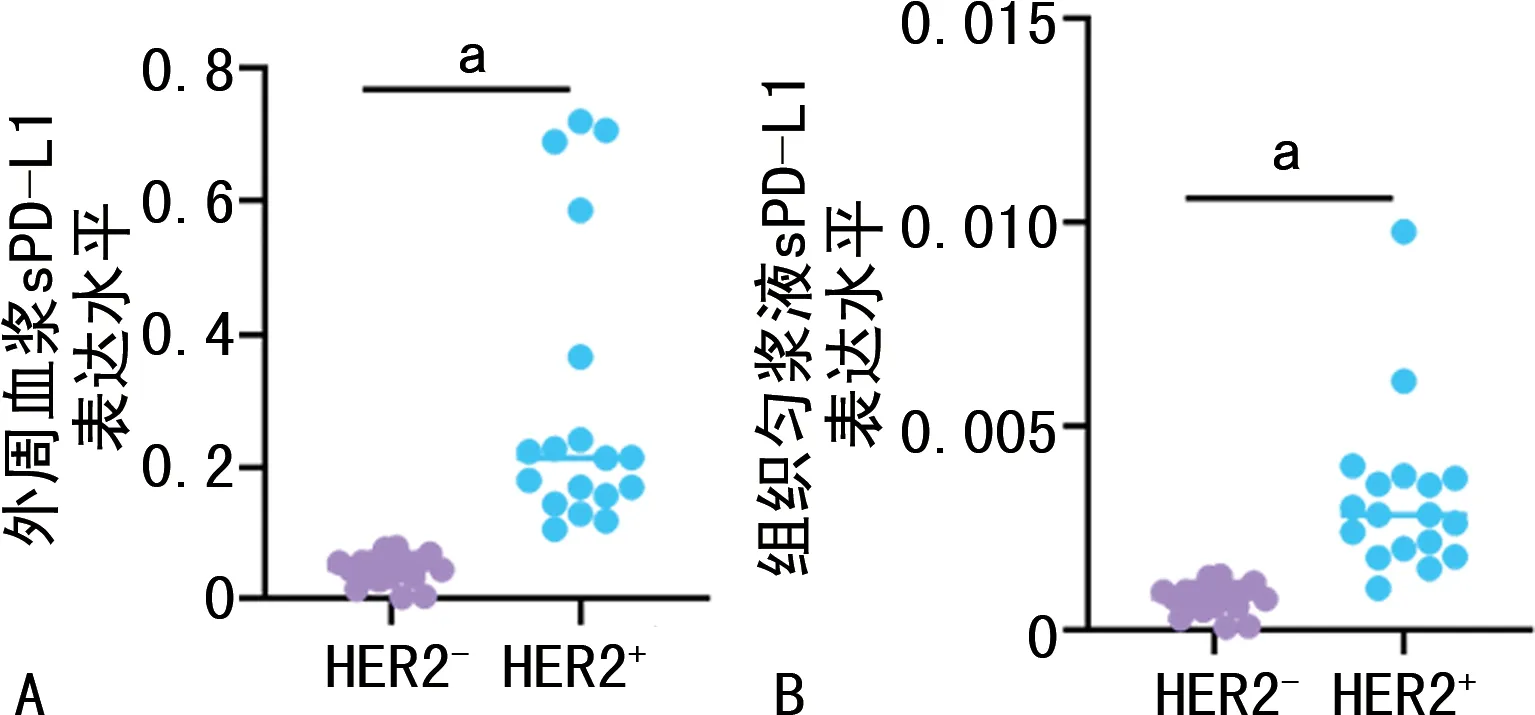
A:HER2-和HER2+患者的外周血浆中sPD-L1表达水平;B:HER2-和HER2+患者的组织匀浆液中sPD-L1表达水平;a:P<0.001。
2.2 HER2-和HER2+患者组织局部M1和M2巨噬细胞的比例
HER2+患者组织中M1型巨噬细胞比例(CD86+CD206-CD68+/CD68+)明显低于HER2-患者(图2A、B),M2型巨噬细胞比例(CD86-CD206+CD68+/CD68+)明显高于HER2-患者(图2A、C)。
2.3 HER2-和HER2+腺癌细胞HER2表达和sPD-L1水平
相比于HER2-腺癌细胞系(BT-474和SK-BR-3),HER2+腺癌细胞系(MDA-MB-453和MDA-MB-468)高表达HER2,见图3A、B。HER2-腺癌细胞系(SK-BR-3)和HER2+腺癌细胞系(MDA-MB-453)BCM中的sPD-L1水平随培养时间增加而上升,见图3C、D。
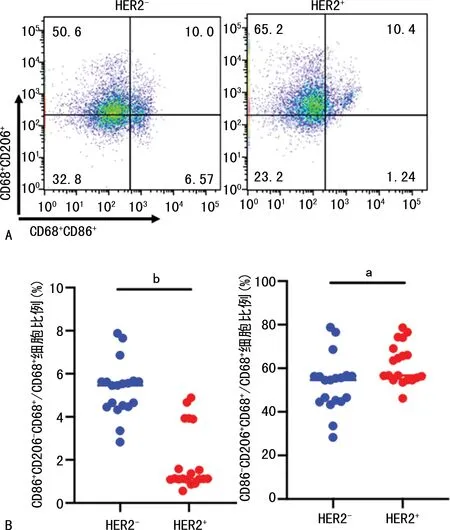
A:HER2-和HER2+患者组织M1(CD86+CD206-CD68+/ CD68+)和M2型(CD86-CD206+CD68+/ CD68+)巨噬细胞极化流式细胞图;B:HER2-和HER2+患者组织M1型巨噬细胞比例统计图;C:HER2-和HER2+患者组织M2型巨噬细胞比例统计图;a:P<0.05,b:P<0.001。
2.4 HER2-和HER2+腺癌细胞系培养上清液对PBMC源巨噬细胞表型极化的影响
相比于HER2-腺癌细胞系(BT-474和SK-BR-3),HER2+腺癌细胞系(MDA-MB-453和MDA-MB-468)BCM中的sPD-L1明显上升,见图4A。HER2+腺癌细胞系(MDA-MB-453)BCM处理的M1型(CD86+CD206-CD68+/CD68+)和M2型(CD86-CD206+CD68+/CD68+)巨噬细胞比例明显高于HER2-腺癌细胞系(SK-BR-3),见图4B、C、D。HER2+腺癌细胞系(MDA-MB-453)培养上清液处理组M1/M2比值明显高于HER2-腺癌细胞系(SK-BR-3)处理组,见图4E。
2.5 HER2-和HER2+腺癌细胞系BCM对PBMC源巨噬细胞功能极化的影响
为了进一步明确HER2-和HER2+腺癌细胞系对PBMC源巨噬细胞的功能极化,检测M1型和M2型巨噬细胞功能相关基因mRNA水平。M1型巨噬细胞相关基因IFN-γ、IL-1β和INOS mRNA水平明显降低,M2型巨噬细胞相关基因IL-10、TGF-β和ARG1 mRNA水平明显上升,见图5。
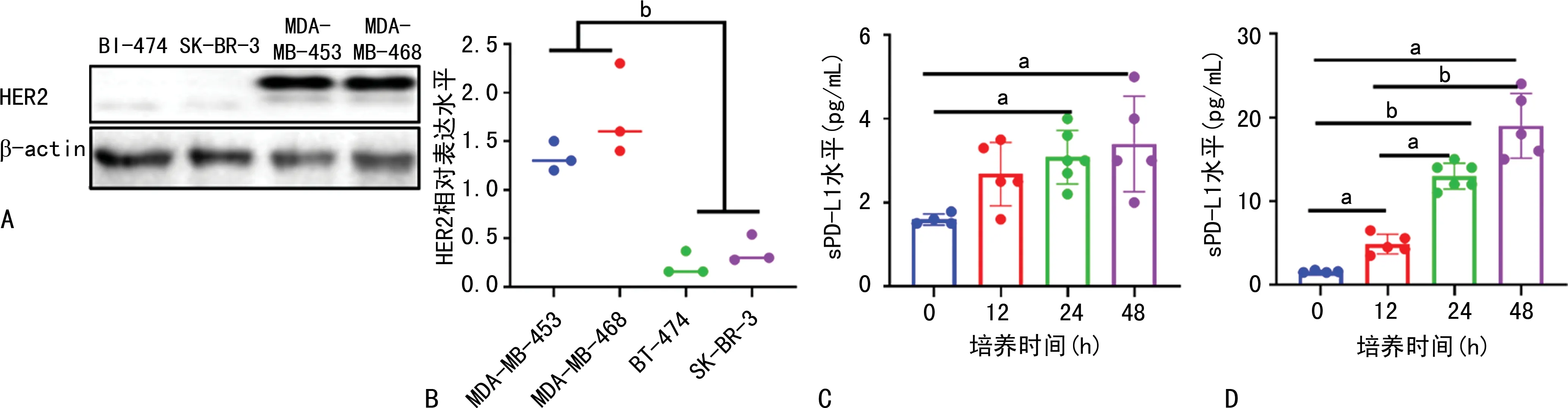
A:HER2-腺癌细胞系(BT-474和SK-BR-3)和HER2+腺癌细胞系(MDA-MB-453和MDA-MB-468)HER2表达Western blot图;B:腺癌细胞系HER2相对表达水平统计图;C:HER2-腺癌细胞系(SK-BR-3)BCM中sPD-L1水平统计图;D:HER2+腺癌细胞系(MDA-MB-453)BCM中sPD-L1水平统计图;a:P<0.05,b:P<0.01。
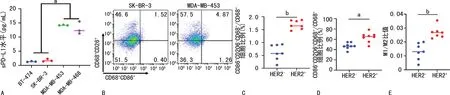
A:HER2-腺癌细胞系(BT-474和SK-BR-3)和HER2+腺癌细胞系(MDA-MB-453和MDA-MB-468)培养上清液sPD-L1水平检测;B:M1型(CD86+CD206-CD68+/CD68+)和M2型(CD86-CD206+CD68+/CD68+)巨噬细胞极化流式细胞图;C:M1型(CD86+CD206-CD68+/CD68+)巨噬细胞比例统计图;D:M2(CD86-CD206+CD68+/CD68+)巨噬细胞比例统计图;E:M1/M2型巨噬细胞比值统计图;a:P<0.05,b:P<0.001。
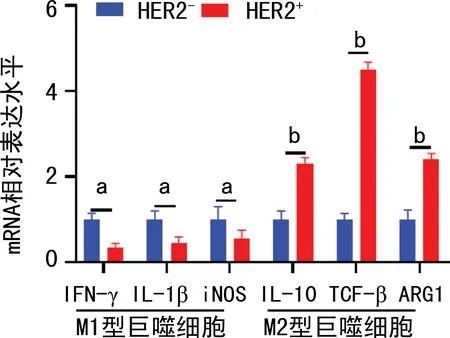
a:P<0.05,b:P<0.001。
3 讨 论
巨噬细胞是关键的免疫细胞和炎症过程的重要调节剂[6]。驻留的巨噬细胞可以充当组织损伤的传感器,并且可以维持组织稳态[6]。尽管已经使用分子标记(如HER2)对乳腺癌疾病进行分类,以预测预后并确定治疗方式[3]。但目前的诊断和治疗方式仍存在不足,许多患者因疾病复发而死亡。因而,进一步发掘和明确HER2乳腺癌的特征有助于其诊断和治疗。本研究对HER2表达在乳腺癌免疫微环境巨噬细胞极化中的作用进行探讨,结果显示:(1)HER2+乳腺癌患者外周血和癌组织中sPD-L1水平明显升高,并伴随癌组织局部M2型巨噬细胞极化,提示HER2+患者免疫力降低可能与外周血浆和组织微环境中升高的sPD-L1有关。(2)HER2-腺癌细胞系(BT-474和SK-BR-3)和HER2+腺癌细胞系(MDA-MB-453和MDA-MB-468)均可分泌sPD-L1,且HER2+腺癌细胞系分泌更多的sPD-L1,提示HER2+患者组织微环境中升高的sPD-L1可能来自HER2+腺癌细胞,并可能参与组织M1和M2巨噬细胞极化。(3)HER2+腺癌细胞系(MDA-MB-453)促进M1型和M2型巨噬细胞比例增加,同时促进M1/M2平衡向M2型巨噬细胞功能极化偏移,提示HER2+腺癌细胞系(MDA-MB-453)来源的sPD-L1可能促进M1和M2型巨噬细胞极化平衡向M1。
HER2在大多数原位乳腺癌中表达,但仅在20%~30%的浸润性乳腺癌中得到维持[9]。在乳腺癌的发生过程中,观察到HER2表达从良性到导管癌逐渐减少,在浸润性乳腺癌中HER2几乎不表达[10]。然而,HER2在乳腺癌中的作用尚未完全明确。本研究结果表明,在HER2+乳腺癌患者中,高表达sPD-L1可能促进癌组织局部M2型巨噬细胞激活。因而,可能促进肿瘤生长和侵袭,导致免疫力降低和肿瘤血管新生[11-12]。
研究表明,肝细胞肝癌和滋养细胞来源的sPD-L1具有调控巨噬细胞极化介导免疫耐受的作用[13-14]。且血清高水平sPD-L1与转移性晚期胃癌患者一线化疗的总体生存期较差有关[12]。巨噬细胞极化是癌组织免疫微环境紊乱和肿瘤免疫治疗低效的重要因素[15-16]。本研究体外实验证实,HER2+腺癌细胞来源的sPD-L1具有调节巨噬细胞极化的作用。这可能促进乳腺癌组织血管新生、肿瘤生长及组织炎性反应,导致抗肿瘤免疫炎症治疗低效[11]。
综上所述,sPD-L1高表达于HER2+乳腺癌患者癌组织和外周血中,且HER2+乳腺癌患者癌组织局部巨噬细胞呈现M2极化偏移。HER2+腺癌细胞来源的sPD-L1促进M1型和M2型巨噬细胞极化,且M1/M2平衡偏向M1型并伴随M2型功能增强。但是,尚需进一步的直接证据说明sPD-L1如何调控巨噬细胞及其分子机制。同时,下调sPD-L1是否在体影响HER2+乳腺癌患者癌组织巨噬细胞功能极化和抑制肿瘤生长尚需进一步阐明。因此,sPD-L1作为HER2+乳腺癌的治疗靶点仍有待研究。

