四川省兔出血症病毒2 型流行病学调查及遗传变异分析
李 丽,陈弟诗,陈 斌,张 毅,邓 飞,邵 靓,周莉媛,任永军
(1.四川省动物疫病预防控制中心,四川成都 610041;2.四川省畜牧科学研究院,四川成都 610041)
兔病毒性出血症(rabbit hemorrhagic disease,RHD)俗称兔瘟,是兔的一种急性、高度致死性传染病。RHD 因潜伏期短、发病急、病程短、传播快、死亡率高(可达100%),被我国列为二类动物疫病。该病典型病变特征是呼吸系统出血,实质器官淤血、肿大、出血,肝脏坏死,由嵌杯病毒科(Caliciviridae)兔病毒属(Lagovirus)兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)感染引起[1]。根据感染的RHDV 基因型不同(RHDV GI.1~4),RHD 可分为RHD1 型(经典型)和RHD2 型两种[2]。其中,RHD1 型曾在世界很多国家发生和流行[1,3],但随着免疫接种等防控措施的实施,RHD1 的流行得到基本控制[4-5]。RHD2 型由RHDV GI.2 基因型毒株(以下称RHDV2)感染引起,2010 年由法国首次报道[6]。2020 年以前,RHD2 主要在欧洲一些国家发生,之后出现在非洲国家以及美洲的美国和墨西哥,呈现蔓延趋势[2]。2020 年4 月我国四川省金堂县首次发生RHD2 疫情,平均死亡率为42.85%,共扑杀销毁家兔3 500余只,给养殖户带来较大经济损失[8]。国内目前没有预防RHD2 的疫苗,也无有效的治疗药物可用,因而该病严重威胁着养兔业健康发展。
为了解四川省RHDV2 的流行情况、分子流行病学特征和遗传变异规律,本研究于2020—2021年对四川省兔场进行了流行病学调查,采用荧光RT-PCR 方法,对发病兔场的360 份样品(117 份病死兔肝脏组织样品、243 份兔场环境拭子样品)和705 个受监测兔场的7 165 份样品(3 340 份全血样品及3 825 份环境拭子样品)进行了RHDV2核酸检测,筛选出12 份来自不同地区发病兔场的病原核酸阳性样品;设计合成2 对RHDV2VP60基因特异性引物,通过常规分子生物学技术,对12 份RHDV2 核酸阳性样品进行了VP60基因扩增测序和遗传变异分析,以期为有效控制RHD2 型疫情在四川省的蔓延及其控制对策制定提供参考。
1 材料与方法
1.1 毒株、菌种及试剂
2×TaqPCR Master mix、琼脂粉和TIANgel Midi Purification Kit(DP209)等,购自成都安雅生物试剂有限公司;DL 2 000 DNA Marker,购自成都大连宝生物科技有限公司;病毒DNA/RNA提取试剂盒(4.0),购自西安天隆科技有限公司;RHD2 型荧光RT-PCR 检测试剂盒,购自四川博策检测技术有限公司;EVO M-MLV 反转录试剂预混液试剂盒,购自湖南艾科瑞生物工程有限公司。
1.2 样品来源
受检样品共计7 525 份。其中:360 份来自发病兔场,包括117 份病死兔肝脏组织样品和243 份发病兔场环境拭子样品,采自12 个地市18 个县区25 个发病兔场(表1);7 165 份血液及环境拭子样品,采自受监测的705 个规模兔场,包括2020年在全省所有地市432 个集中监测规模兔场采集的全血样品2 080 份、兔场环境样品2 345 份,2021年在全省12 个地市273 个集中监测规模兔场采集的全血样品1 260 份、兔场环境样品1 480 份。
1.3 样品采集
肝脏组织样品:对病死兔解剖,无菌采集肝脏组织,-20 ℃冻存备用;环境棉拭子:采集兔养殖场地面、圈舍、食槽、排泄物等环境样品,置于PBS 缓冲液中,-20 ℃冻存备用。受监测兔场采样原则:存栏500 只及以上的规模兔场,每个兔场至少采集10 份全血样品和10 份环境样品;500 只以下的兔场,采集5 份全血样品和5 份环境样品。以上样品均由四川省动物疫病预防控制中心收集保存。
1.4 发病兔场流行病学调查
统计发病兔场发病时间、地点、家兔品系、存栏量、死亡率等基本信息,分析RHD2 的发生与季节、品系等的相关性,统计不同生长阶段兔只的死亡率。
1.5 荧光RT-PCR 检测
将肝脏组织样品研磨匀浆,离心取上清,将环境拭子样品离心取上清,将全血样品直接取样,按常规方法进行总RNA 提取,使用RHD2 型荧光RT-PCR 检测试剂盒进行检测。
1.6 VP60 基因扩增及测序
根据GenBank(http://www.ncbi.nlm.nih.gov)中的RHDV2 基因组序列,通过DNAstar 和Premier 5.0 软件分析后,针对VP60基因片段设计2 对特异性引物(表1)。引物由成都擎科生物有限公司合成,按照合成说明书将其稀释至10 μmol/L,-20 ℃冻存备用。

表1 RHDV2 VP60 基因RT-PCR 扩增引物
将经荧光RT-PCR 检测筛选出的12 份来自不同地区发病兔场的RHDV2 核酸阳性肝组织样品,提取总RNA,根据EVO M-MLV 反转录试剂预混液试剂盒说明书进行反转录操作,以反转录产物(cDNA)为模板,分别以P1/P2、P3/P4 为引物,进行RHDV2VP60两段基因的PCR 扩增,反应结束后取5 μL 产物进行1.0%琼脂糖凝胶电泳分析。纯化回收PCR 产物,由成都擎科生物有限公司进行序列测定,用DNAstar 软件拼接后进行测序结果的Blast 分析。
1.7 VP60 基因序列分析
使用DNAstar 等软件分析扩增测序的RHDV2VP60基因序列的结构组成特征,收集GenBank 中的国内外14 条不同基因型的RHDVVP60基因序列和10 条RHDV2VP60序列进行RHDV2VP60基因的核苷酸及其编码氨基酸的同源性分析,同时绘制VP60基因序列系统进化树进行遗传变异分析。
2 结果与分析
2.1 发病兔场流行病学调查
经过对发病兔场的流行病学调查可知:RHD2流行无明显季节性;伊拉配套系、新西兰兔、伊普吕配套系、伊高乐配套系等多个品系家兔均有发病;哺乳仔兔死亡率为25%~60%,部分呈现整窝死亡,幼兔死亡率为18%~45%,怀孕哺乳母兔死亡率为9%~30%。具体情况见表2。
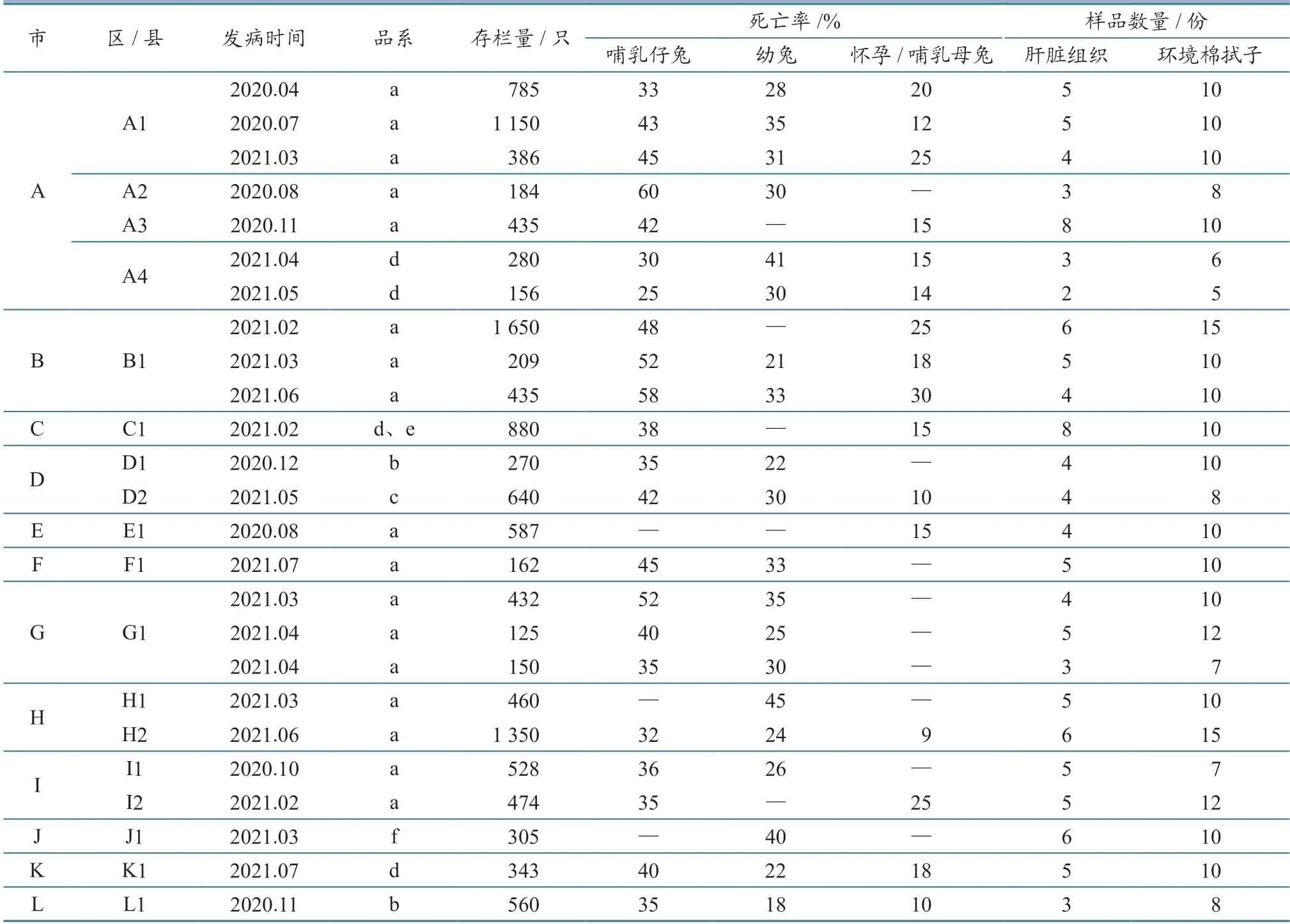
表2 2020—2021 年发病兔场流行病学基本情况及样品采集信息统计
2.2 荧光PCR 检测
2.2.1 发病兔场 2020—2021 年,累计检测发病兔场117 份肝脏组织样品及243 份环境样品,检出肝脏组织阳性样品104 份,阳性检出率为88.89%,检出兔场环境阳性样品112 份,阳性检出率为46.09%。部分RHDV2 荧光RT-PCR 检测结果见图1。
2.2.2 受监测兔场 2020 年共检测全血样品2 080 份,阳性检出率为14.18%,检测环境样品2 345 份,阳性检出率为10.28%;涉及规模场432 个,场点阳性检出率为8.56%,2021 年共检测全血样品1 260 份,阳性检出率为45.48%,检测环境样品1 480 份,阳性检出率25.81%;涉及规模场273 个,场点阳性检出率为39.93%。全血样品总体阳性检出率为25.99%(868/3 340),环境样品总阳性检出率为16.29%(623/3 825)。具体统计结果见表3。
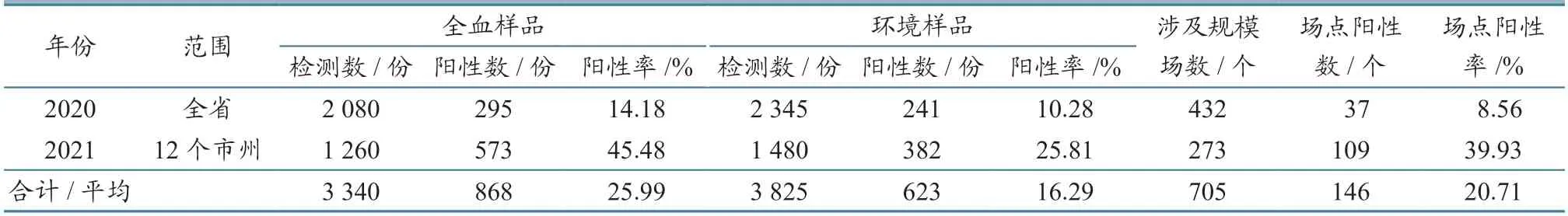
表3 受监测兔场检测结果
2.3 VP60 基因RT-PCR 检测
分别以P1/P2、P3/P4 为引物,对抽提的12份RHDV2 阳性病料中的VP60基因不同片段进行RT-PCR 扩增,结果如图2-A 和图2-B 所示。每份RHDV2 都扩增出约1 095 bp 和1 117 bp 预期大小的两条特异性DNA条带(即VP60a和VP60b片段),阴性对照样品无扩增。
2.4 VP60 基因测序鉴定
分别对12 份RHDV2 阳性样品的VP60基因不同片段进行纯化回收及序列测定,将测序结果拼接后进行Blast 分析。结果显示,12 条扩增序列与GenBank 中RHDV2 毒株的同源性均在97%以上,表明成功扩增出了12 份阳性样品的RHDV2VP60基因序列。通过DNAstar 软件进行VP60编码框(ORF)序列整理,分别编号为SCh202001—SCh202012。
2.5 VP60 基因序列特征
采用DNAstar 生物学信息软件MegAlign 程序进行12 份阳性样品的RHDV2VP60基因序列特征分析,结果受检的12 份阳性样品的RHDV2VP60基因序列长均为1 740 bp,编码579 个氨基酸。12 份阳性样品的RHDV2VP60基因序列在第18、24、99、105、114、132、213、252、321、330、363、378、399、568、612、705、723、741、765、804、828、882、885、930、1 026、1 056、1 089、1 095、1 155、1 156、1 165、1 227、1 231、1 242、1 284、1 317、1 551、1 576、1 608、1 618 和1 622 bp 共41 处核苷酸存在突变,核苷酸序列同源性为98.4%~100%,其中114、1 156、1 165、1 231、1 576、1 618 和1 622 bp 等7 处为错义突变,其他34 处均为同义突 变,且SCh202004 和SCh202005、SCh202007和SCh202009 同源性为100%,表明12 份阳性样品的RHDV2VP60基因遗传相对稳定。
2.6 VP60 基因同源性分析
通过DNAstar 软件与GenBank 中 的10 条RHDV2 毒株VP60 参考序列(表2)进行同源性分析,发现22 条VP60基因序列核苷酸同源性为93.7%~100%,其 中Sch202010 与2020 年 新加坡RHDV2 分离株GI.2/SG-NParks 2020/M54-9(MW194928)同源性最低(93.7%);推导的对应氨基酸序列同源性为95.7%~99.8%,其中SCh202002、SCh202003、SCh202004、SCh202005和SCh202006 与2010 年法国RHDV2 分离株10-32(HE800532)同源性最低(95.7%),而Sch202010 与2020 年新加坡RHDV2 分离株GI.2/SG-NParks 2020/M54-9(MW194928)推导氨基酸同源性最低(97.2%)。结果表明,12 份阳性样品的RHDV2VP60基因与国外早期和最近毒株相比出现了一定程度变异,但仍相对稳定。
2.7 VP60 基因遗传演化分析
通过DNAstar 软件对12 份阳性样品的RHDV2VP60基因序列与国内外14 条不同基因型的RHDVVP60序列和10 条RHDV2VP60序列进行核苷酸比较,绘制系统发生进化树(图3)。经典型RHD 毒株(GI.1 毒株)和RHDV2 毒株形成两个大分支:参考的经典型RHD 毒株又分为2个分支,国内的经典型RHD 株分别处在不同分支;RHDV2 毒株也可分为2 个分支,12 份阳性样品的RHDV2VP60序列和我国2020 年RHDV2 SC2020-04 株(MT383749)单独成簇,与Sweden 2018 年分离株2381(MH341513)在一个分支,与新加坡RHDV2 分离株GI.2/SG-NParks 2020/M54-9(MW194928)处于不同分支。结果表明,RHDV2 毒株VP60基因序列遗传演化可能会呈现复杂化趋势,目前仍相对稳定。
3 讨论
2010 年法国报道出现RHD2 后,意大利、西班牙、德国、葡萄牙、英国、挪威等多数西欧国家和亚速尔群岛,以及北非和南非一些国家陆续报道了该病的发生[9-11],2019—2020 年美国、墨西哥、日本、中国和菲律宾报道发生该亚型疫情[2,12-13],RHD2 疫情流行速度快,暴发范围广,呈现出替代经典型RHD(RHD1)趋势。
本研究通过流行病学调查发现,RHD2 流行无明显季节性,常见的品系家兔均有发病,其中伊拉配套系发病死亡率较高,乳兔和幼兔死亡率高于成兔,这与国外相关报道一致[7]。样品检测结果显示,发病兔场和受监测兔场的环境样品阳性率在16.29%以上,提示RHDV2 传播潜力强大,加强饲养管理和做好消毒等的日常预防具有重要意义。
据报道[17],我国首次发生RHD2 疫情的两个兔场的RHDV2VP60基因片段核苷酸同源性为99.1%,与RHDV2 参考毒株的同源性为94.1%~98.3%,属于同一分支上,与经典型RHD毒株的同源性为79.0%~80.0%,亲缘关系较远。为进一步了解其分子流行特点,本研究对12 份阳性样品的RHDV2VP60基因全序列进行了克隆分析。作为RHDV 的主要结构蛋白,VP60 蛋白的氨基酸序列可分为A(1~21)、B(22~300)、C(301~328)、D(329~343)、E(344~434)和F(435~580)6个区,通过折叠成内壳(S-shell 区)和外壳(P2 区)两个主要的紧凑区域构成衣壳,其中N 端的A 和B 区组成内壳区,C 端的C、D、E、F 区组成外壳区,分别位于N 端第3l~250 位和C 端第477~579 位氨基酸之间的主要抗原区域[14-15]。本研究表明,受试的12 份RHDV2VP60基因核苷酸序列有41 处突变,含34 处同义突变和7 处错义突变,即VP60蛋白的B(22~300)1 处、E(344~434)2 处和F(435~580)3 处错义突变。这一点与金明兰等[16]研究RHDVYL 毒株VP60基因遗传演变分析时得出的VP60 蛋白A、B、D、F 区变异相对较低、C、E 区变异较高的结论存在一定差异,这需要在更多RHDV2VP60序列的变异分析上进一步验证,当然这也可能是RHDV2 毒株遗传变异的特点。虽然目前12 份RHDV2VP60基因的遗传演变相对稳定,但仍需要警惕较大变异幅度的毒株出现。
通过DNAstar 软件对12 份阳性样品的RHDV2VP60基因序列与国内外14 条不同基因型的RHDVVP60序列和10 条RHDV2VP60序列绘制系统发生进化树,发现12 份RHDV2VP60序列和我国2020 年RHDV2 SC2020-04 株(MT383749)单独成簇,与Sweden 2018 年分离株2381(MH341513)参考序列同源性较高;RHDV2 毒株VP60序列同源性分析发现,RHDV2VP60基因序列核苷酸同源性为93.7%~100%,其中Sch202010 与国外毒株GI.2/SG-NParks 2020/M54-9(MW194928)同源性最低(93.7%),但是12 份阳性样品的RHDV2VP60核苷酸序列同源性为98.4%~100%,这都表明12 份阳性样品的RHDV2VP60基因与国外早期和最近毒株相比出现了一定程度变异,但遗传相对稳定,同时也提示目前我国RHDV2 毒株VP60基因比较保守且可能存在区域性特点。需要注意的是,本研究克隆分析用的RHDV2 毒株均为同一时期的毒株,通过系统发生进化树发现,国内RHDV 毒株流行时期不同,分支也不同,提示RHDV2 毒株在我国很可能随着时间和地区的改变出现新的变异现象。
本研究对四川全省1 年多时间的RHDV2 流行情况进行调查和统计分析,对RHDV2 基因序列信息进行收集比对,对12 份RHDV2VP60基因进行了克隆测序和遗传变异分析,发现RHDV2 已经在四川省多个地市存在,其VP60基因序列出现了一定程度的变异,但遗传演化相对稳定,RHDV2 毒株单独成簇。本研究补充了国内RHDV2 的分子流行病学信息,也为RHD2 相关防控研究和控制对策制定提供了参考。

