大豆异黄酮协同索拉非尼对宫颈癌Hela细胞增殖、迁移的影响及机制
姬国杰,丰慧根
(1.新乡医学院,河南 新乡 453003;2.新乡医学院三全学院生物与基础医学实验教学中心,河南 新乡 453000)
宫颈癌在女性癌症中排第2位,是20~39岁女性癌症死亡的第二大原因[1]。随着医学治疗手段的不断进展,大部分早期宫颈癌可通过手术治疗获得治愈[2],而对于就诊时已处于进展期或发生耐药的宫颈癌患者,总体预后仍不乐观[3]。目前,临床应用的化学治疗方案存在不良反应大、药物利用度低、治疗效果不理想等局限。随着分子靶向治疗研究的不断深入,生物治疗这一全新的肿瘤治疗模式越来越受到人们的关注,如中西药联合应用能够降低现阶段治疗宫颈癌的不良反应、增高药物的利用度或有治疗协同作用,将会改善宫颈癌患者的预后。索拉非尼是一种新型的多靶点生物靶向治疗药物[4],研究表明,索拉非尼能够诱导Hela细胞的凋亡,抑制其增殖且呈浓度依赖性[5]。大豆异黄酮是一种天然的雌激素,是大豆生长过程中的次级代谢产物,具有抗癌治癌、预防心血管疾病、预防骨质疏松、抗真菌、抗氧化和改善妇女更年期综合征等多种生理功能,是一类具有开发利用价值的天然活性物质[6-10]。本课题组前期研究表明,大豆苷元能下调宫颈癌细胞血管内皮生长因子-C(vascular endothelial growth factor C,VEGF-C) mRNA的表达,且此效果呈剂量依赖性[11]。基于此,本研究采用大豆异黄酮与不同浓度索拉非尼联合干预宫颈癌Hela细胞,观察索拉非尼联合大豆异黄酮干预对宫颈癌Hela细胞的增殖、迁移以及VEGF-C表达的影响,以期为宫颈癌的临床治疗提供参考。
1 材料与方法
1.1 细胞株、主要试剂和仪器宫颈癌Hela细胞株由本实验室保存。RPMI 1640培养基、质量浓度5 g·L-1噻唑蓝(methyl thiazolyl tetrazolium,MTT)溶液、胰蛋白酶-乙二胺四乙酸、体积分数30%丙烯酰胺均购自北京索莱宝公司,大豆异黄酮、索拉非尼均购自美国Sigma公司;SYBR PreMix购自大连TaKaRa公司,蛋白酶抑制剂、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、增强型化学发光(enhanced chemiluminescence,ECL)检测试剂盒、IP细胞裂解液及Western一抗、二抗去除液均购自上海碧云天生物技术有限公司,TRIzol裂解液购自美国Invitrogen公司,兔抗人VEGF-C单克隆抗体、羊抗兔IgG-HRP购自英国Abcam 公司;凝胶成像仪、CO2恒温培养箱、倒置显微镜、落地冷冻高速离心机、实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪购自美国Thermo Scientific公司,荧光倒置显微镜购自日本Olympms公司。
1.2 实验方法
1.2.1 细胞培养将Hela细胞接种于含体积分数10%胎牛血清的1640培养基,调整细胞密度为1×109L-1,置于 37 ℃、体积分数5%CO2细胞培养箱中培养,培养至细胞融合80%~90%时取对数生长期细胞用于后续实验。
1.2.2 MTT法检测细胞增殖抑制率取对数期的Hela细胞,调整细胞密度约为3×107L-1,按每孔100 μL接种于96孔培养板上,置于37 ℃、体积分数5% CO2培养箱中培养至细胞铺满每孔底部后弃上清,然后随机分为对照组、大豆异黄酮组、1 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼组、6 mmol·L-1索拉非尼组、1 mmol·L-1索拉非尼+大豆异黄酮组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼+大豆异黄酮组、6 mmol·L-1索拉非尼+大豆异黄酮组;对照组用空白培养基培养,大豆异黄酮组滴加100 μL终浓度为0.04 mmol·L-1的大豆异黄酮,1 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼组、6 mmol·L-1索拉非尼组分别滴加100 μL终浓度为1、2、4、6 mmol·L-1的索拉非尼培养,1 mmol·L-1索拉非尼+大豆异黄酮组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼+大豆异黄酮组、6 mmol·L-1索拉非尼+大豆异黄酮组分别滴加100 μL终浓度为1、2、4、6 mmol·L-1的索拉非尼和0.04 mmol·L-1大豆异黄酮,并设置空白对照组(仅加入完全培养基),设4个复孔;然后,置于37 ℃、体积分数5% CO2培养箱中培养48 h;加入10 μL MTT溶液,继续培养4 h,吸去孔内培养液。每孔加入150 μL 二甲基亚砜,在摇床上低速振荡10 min,使结晶物充分溶解,于波长490 nm处测量各孔的吸光值,计算细胞增殖抑制率,细胞增殖抑制率=[1-(加药组细胞吸光度-空白孔吸光度)/(对照组细胞吸光度-空白孔吸光度)]×100%。
1.2.3 细胞划痕实验检测细胞迁移能力取对数生长期的Hela细胞,调整密度约为3×107L-1,按每孔1 000 μL接种于6孔板,置于37 ℃、体积分数5% CO2培养箱中培养至细胞铺满每孔底部后弃上清,用10 μL的枪头划线,用生理盐水清洗1~2次,立即拍照;然后,随机分为对照组、大豆异黄酮组、2 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼+索拉非尼组、4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组,对照组用空白培养基培养,大豆异黄酮组滴加100 μL终浓度为0.04 mmol·L-1的大豆异黄酮,2 mmol·L-1索拉非尼组和4 mmol·L-1索拉非尼组分别滴加100 μL终浓度为2、4 mmol·L-1的索拉非尼培养,2 mmol·L-1索拉非尼+索拉非尼组和4 mmol·L-1索拉非尼+大豆异黄酮组分别滴加100 μL终浓度为2、4 mmol·L-1的索拉非尼和0.04 mmol·L-1大豆异黄酮,继续培养48 h 后,再次拍照记录;使用Imang J软件对细胞划痕面积进行分析,计算细胞迁移抑制率,细胞迁移抑制率=[1-(0 h划痕宽度-培养后划痕宽度)/0 h划痕宽度]×100%,用细胞迁移抑制率表示细胞迁移能力,细胞迁移抑制率越高表示迁移能力越弱。
1.2.4 实时荧光定量PCR检测Hela细胞中VEGF-C mRNA表达取对数生长期的Hela细胞,调整密度约为3×107L-1,按每孔1 000 μL接种于六孔板,随机分为对照组、大豆异黄酮组、4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组,对照组用空白培养基培养,大豆异黄酮组滴加100 μL终浓度为0.04 mmol·L-1的大豆异黄酮,4 mmol·L-1索拉非尼组滴加100 μL终浓度为4 mmol·L-1的索拉非尼培养,4 mmol·L-1索拉非尼+大豆异黄酮组滴加100 μL终浓度为4 mmol·L-1的索拉非尼和0.04 mmol·L-1大豆异黄酮,置于37 ℃、含体积分数5% CO2培养箱中培养48 h;4 ℃条件下,用TRIzol法提取各组细胞总RNA,按试剂盒说明书将RNA反转录为cDNA。应用实时荧光定量PCR法检测VEGF-C mRNA。引物序列:β-actin上游引物序列为5′-CTGGAACGGTGAAGGTGACA-3′,下游引物序列为5′-AAGGGACTTCCTGTAACAACGCA-3′,产物长度140 bp;VEGF-C上游引物序列为5′-CAGTTACGGTCTGTGTCCAGT-3′,下游引物序列为5′-GGACACACATGGAGGTTTAAAGAAG-3′,产物长度为300 bp。反应体系:SYBR PreMix 10.0 μL,上、下游引物各0.8 μL,ROX 0.4 μL,ddH2O 6.0 μL,cDNA 2.0 μL。反应条件为:95 ℃预变性 3 min,95 ℃变性30 s,60 ℃延伸30 s,共40个循环。采用2-ΔΔCt法计算VEGF-C mRNA相对表达量。实验重复3次,取均值。
1.2.5 Western blot法检测Hela细胞中VEGF-C蛋白的表达按“1.2.4”项方法进行细胞分组与培养,待细胞长至80%~90%融合时收集细胞,然后滴加IP细胞裂解液+蛋白酶抑制剂(体积比991)于冰上裂解30 min,4 ℃条件下12 000 r·min-1离心5 min,取上清。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳蛋白上样缓冲液与蛋白样品14混合后涡旋震荡混匀,沸水浴3 min,冷却至室温后电泳,取蛋白条带,半干转印至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)(100 mA,45 min),在含吐温-20的Tris缓冲盐溶液(Tris buffered saline and Tween-20,TBST)中洗膜3次,每次10 min,丽春红染色液染膜,置于摇床上5 min,蒸馏水漂洗2~3次,TBST清洗2~3次,体积分数5%脱脂牛奶室温下封闭2 h,将PVDF 膜用TBST清洗3遍,浸入稀释后(稀释度1800) 的兔抗人VEGF-C单克隆抗体孵育液中,4 ℃孵育过夜;然后再用HRP 标记的山羊抗兔二抗(稀释度15 000)孵育1.5 h;ECL发光液染色2 min,加入适量的Western一抗、二抗去除液,TBST漂洗3次,每次 5 min。以β-actin为内参蛋白,用于蛋白测定。应用凝胶成像仪进行图形采集,Imang J 软件分析灰度值,以目的蛋白灰度值与内参蛋白灰度值的比值表示目的蛋白相对表达量。实验重复3次,取均值。

2 结果
2.1 10组细胞增殖抑制率比较对照组、大豆异黄酮组、1 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼组、6 mmol·L-1索拉非尼组、1 mmol·L-1索拉非尼+大豆异黄酮组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼+大豆异黄酮组、6 mmol·L-1索拉非尼+大豆异黄酮组细胞增殖抑制率分别为 (0.00±0.00)% 、(1.34±0.16)%、(8.13±1.35)%、(44.09±1.57)%、(65.45±0.24)%、(73.78±2.09)%、(19.68±0.75)%、(57.08±0.57)%、(70.71±0.56)%、(83.31±0.77)%。1 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼组、6 mmol·L-1索拉非尼组、1 mmol·L-1索拉非尼+大豆异黄酮组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼+大豆异黄酮组、6 mmol·L-1索拉非尼+大豆异黄酮组细胞增殖抑制率均高于对照组和大豆异黄酮组,差异有统计学意义(P<0.05);大豆异黄酮组与对照组细胞增殖抑制率比较差异无统计学意义 (P>0.05 )。1 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼组、6 mmol·L-1索拉非尼组细胞增殖抑制率随索拉非尼浓度的增加显著升高(P<0.05);1 mmol·L-1索拉非尼+大豆异黄酮组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼+大豆异黄酮组、6 mmol·L-1索拉非尼+大豆异黄酮组细胞增殖抑制率随索拉非尼浓度的增加显著升高(P<0.05);1 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼组、6 mmol·L-1索拉非尼组细胞增殖抑制率分别高于对应的1 mmol·L-1索拉非尼+大豆异黄酮组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼+大豆异黄酮组、6 mmol·L-1索拉非尼+大豆异黄酮组,差异有统计学意义(P<0.05 ) 。
2.2 对照组、大豆异黄酮组、2 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组细胞迁移抑制率比较结果见图1。对照组、大豆异黄酮组、2 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组细胞迁移抑制率分别为(0.00±0.00)%、(16.81±0.35)% 、(36.70±0.81)%、(58.80±0.49)%、(44.93±1.01)%、(95.26±2.19)%。2 mmol·L-1索拉非尼组、2 mmol·L-1索拉非尼+大豆异黄酮组、4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组细胞迁移抑制率均高于对照组和大豆异黄酮组,差异有统计学意义(P<0.05 );对照组与大豆异黄酮组细胞迁移率比较差异无统计学意义(P>0.05);4 mmol·L-1索拉非尼组细胞迁移率显著高于2 mmol·L-1索拉非尼组,4 mmol·L-1索拉非尼+大豆异黄酮组细胞迁移率显著高于2 mmol·L-1索拉非尼+大豆异黄酮组,差异有统计学意义(P<0.05);2 mmol·L-1索拉非尼+大豆异黄酮组细胞迁移率显著高于2 mmol·L-1索拉非尼组,4 mmol·L-1索拉非尼+大豆异黄酮组细胞迁移率显著高于4 mmol·L-1索拉非尼组,差异有统计学意义(P<0.05)。
2.3 对照组、大豆异黄酮组、4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组细胞中VEGF-C mRNA和蛋白相对表达量比较结果见图2和表1。4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组细胞VEGF-C mRNA和蛋白相对表达量均低于对照组和大豆异黄酮单药组,差异有统计学意义(P<0.05);对照组与大豆异黄酮组细胞中VEGF-C mRNA和蛋白相对表达量比较差异无统计学意义(P>0.05);4 mmol·L-1索拉非尼+大豆异黄酮组细胞VEGF-C mRNA和蛋白相对表达量低于4 mmol·L-1索拉非尼组,差异有统计学意义(P<0.05)。
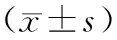
表1 对照组、大豆异黄酮组、4 mmol·L-1索拉非尼组、4 mmol·L-1索拉非尼+大豆异黄酮组细胞中VEGF-C mRNA和蛋白相对表达量比较
3 讨论
据报道,我国每年约有11万例新发病的宫颈癌患者,宫颈癌已成为全球女性致命的妇科恶性肿瘤之一[12-13]。肿瘤的存在、生长及转移依赖于肿瘤细胞的增殖和肿瘤血管生成,抑制肿瘤细胞增殖和肿瘤血管生成这2个环节可以达到治疗肿瘤的目的[14]。目前,宫颈癌的治疗方法主要有手术治疗和放化疗,晚期复发性宫颈癌的治疗多使用化学治疗配合手术和放射治疗;而靶向治疗、免疫治疗及其联合治疗可用于复发或转移宫颈癌的全身系统性治疗。索拉非尼靶向作用于肿瘤细胞,可有力抑制原癌基因丝氨酸/苏氨酸-蛋白激酶,且有较强的激酶选择特性[5]。在新生血管形成及肿瘤进展中,索拉非尼对多种酪氨酸激酶受体有明显抑制作用,包括血管内皮细胞生长因子受体2和3、血小板衍生生长因子受体、受体酪氨酸激酶等[15-16]。此外,索拉非尼可抑制细胞周期蛋白及细胞周期相关蛋白,如G1/S-特异性周期蛋白-D、细胞周期蛋白依赖性激酶 1[17],使增殖期细胞不能通过“G1-S”调节点,阻滞在G1期从而阻断细胞周期进展,进而影响细胞生长,促进凋亡[18]。研究报道,索拉非尼可以延长肿瘤患者的生存期,但其诱发的不良反应及耐药限制了索拉非尼在临床中的使用[19-20]。随着现代药理研究的推进和中药提取技术的更新以及中药有效成分对抗肿瘤作用机制研究的进一步加深,中药因其毒副作用小、廉价等优势在宫颈癌药物治疗方面展现出较大优势,这为临床宫颈癌抗癌药物的研制和应用开拓了新方向[21]。研究表明,大豆异黄酮对乳腺癌[22]、前列腺癌[23]、皮肤癌[24]等均有较好的预防和治疗作用。因此,推测大豆异黄酮和索拉非尼联合治疗宫颈癌有较好的效果。
本研究结果显示,不同剂量索拉非尼组、不同剂量索拉非尼+大豆异黄酮尼联合组细胞增殖抑制率均显著高于对照组和大豆异黄酮组,细胞迁移抑制率显著高于对照组和大豆异黄酮组;索拉菲尼组和索拉非尼+大豆异黄酮组随着索拉菲尼浓度增高,细胞增殖抑制率显著升高,细胞迁移抑制率显著升高,迁移能力降低;且与对照剂量的索拉菲尼组相比,大豆异黄酮+索拉非尼联合组细胞增殖抑制率均显著升高,细胞迁移抑制率显著升高,迁移能力显著降低;说明大豆异黄酮可以协同索拉菲尼抑制Hela细胞的增殖和迁移,且与索拉菲尼呈剂量依赖性。
VEGF-C是近几年新发现的肿瘤抑制因子,是一种经典的 Wnt 信号通路拮抗因子,作为一种抑癌基因参与宫颈癌的发生和发展过程。本研究结果显示,索拉非尼组、大豆异黄酮+索拉非尼联合组细胞中VEGF-C mRNA和蛋白相对表达量均显著低于对照组和大豆异黄酮组;且在同一索拉非尼终浓度下,大豆异黄酮+索拉非尼联合组细胞中VEGF-C mRNA和蛋白相对表达量均显著低于索拉非尼组;说明索拉菲尼联合大豆异黄酮可能是通过降低VEGF-C在Hela细胞中的表达,从而抑制Hela细胞的增殖和迁移。
综上所述,大豆异黄酮联合索拉菲尼对宫颈癌Hela细胞的增殖和迁移能力的抑制效果显著优于单独应用索拉菲尼,其机制可能是大豆异黄酮协同索拉非尼下调宫颈癌Hela细胞中VEGF-C mRNA和蛋白的表达。但是,本研究仅在体外细胞进行,今后需进一步进行小鼠体内实验研究,进而为生物治疗宫颈癌提供新思路和理论依据。

