肝硬化门静脉血栓的危险因素分析及风险预测模型建立*
任小丹,郭 蒙,刘英豪,沈娜思,谯 敏
(重庆医科大学附属第一医院消化内科 400016)
门静脉血栓(portal vein thrombosis,PVT)是指门静脉主干和(或)其分支形成的血栓,甚至血栓形成的范围可以蔓延至肠系膜静脉和脾静脉[1]。失代偿期肝硬化患者发生PVT的患病率为0.7%~20.0%[2-4]。常在体格检查或筛查肝癌过程中偶然被发现,需要与恶性肿瘤导致的癌栓鉴别。研究发现失代偿期肝硬化患者出现PVT会增加消化道出血及再出血率,增加肝移植术后并发症发生率及病死率[5-6]。目前PVT的主要治疗方案为抗凝治疗,而失代偿期肝硬化患者由于凝血功能异常,抗凝治疗可能会增加其发生内脏出血的概率,抗凝治疗难以标准化,治疗效果也不够理想[1,5,7]。因此早期识别可能导致PVT形成的危险因素,并给予预防性措施,防止PVT形成,对患者预后改善起着重要作用。失代偿期肝硬化患者出现PVT通常无特异性临床表现,容易漏诊。目前还缺少精准预测肝硬化患者出现PVT风险的模型[1]。本研究通过回顾性分析2018年1月至2021年1月就诊于本院的268例失代偿期肝硬化患者的临床资料,以期能找到PVT形成的独立危险因素,进一步为PVT的早发现、早诊断、早预防及早治疗提供依据,减少肝硬化患者并发症的发生率,延缓生存期,改善预后,提高患者生存质量。
1 资料与方法
1.1 一般资料
收集2018年1月至2021年1月就诊于本院的268例肝硬化患者的临床资料,将肝硬化合并PVT的134例患者作为试验组,即PVT组,将同一时期肝硬化无PVT的134例患者作为对照组,即非PVT组。本研究经过本院伦理委员会批准,符合医学伦理学规定(审查批号:2021-569)。纳入标准:(1)年龄大于18周岁;(2)根据2019年《肝硬化诊治指南》[8]诊断标准确诊为肝硬化失代偿期;(3)不合并恶性肿瘤、布加氏综合征,无肝移植;(4)临床资料完善;(5)PVT组患者经多普勒超声、增强计算机X射线体层照相术(computerized tomography,CT)或磁共振成像中至少1项诊断为PVT形成,而非PVT组患者经影像学检查皆未发现PVT形成。排除标准:(1)年龄大于80周岁;(2)合并有严重基础病;(3)合并血友病、紫癜及除自身免疫性肝病外的其他自身免疫性疾病;(4)妊娠状态或哺乳期妇女;(5)严重肢体活动障碍;(6)6个月内出现过脑卒中;(7)3个月内动过需气管插管下全身麻醉的大手术。
1.2 检测指标
收集包括患者性别、年龄、基础疾病、输血史、症状、体征、并发症、入院时的实验室检查、影像学检查、Child-Pugh评分及弥散性血管内凝血(disseminated intravascular coagulation,DIC)评分。
1.3 统计学处理
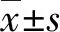
2 结 果
2.1 一般资料的比较
收集2组的一般资料,2组性别、年龄、民族、病因构成、BMI、吸烟史及行经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)史比较,差异无统计学意义 (P>0.05)。而住院时间、输血史、脾切除术史、非选择性β受体阻滞剂(non-selective beta-blockers,NSBBs)使用史及内镜下治疗史差异有统计学意义(P<0.05),见表1。

表1 2组患者的一般资料比较(n=134)
2.2 血清学及影像学检查的比较
PVT组和非PVT组的白细胞(white blood cells,WBC)、血红蛋白(Hemoglobin,Hb)、血小板(blood platelets,PLT)、血清清蛋白(albumin,ALB)、总胆红素(total bilirubin,TB)、肌酐、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、血清钾离子、血清钠离子、国际标准化比值(international normalized ratio,INR)、凝血酶原活动度(Prothrombin time activity,PTA)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)比较差异无统计学意义(P>0.05),而天门冬氨酸氨基转移酶(aspartate transaminase,AST)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、纤维蛋白降解产物(fibrinogen degradation products,FDP)、D-二聚体、甲胎蛋白(alpha fetoprotein,AFP)及门静脉主干内径(diameter of main portal vein,DPV)比较差异有统计学意义(P<0.05),见表2。

表2 2组患者的血清学和影像学指标[M(P25,P75),n=134]

续表2 2组患者的血清学和影像学指标[M(P25,P75),n=134]
2.3 症状及并发症的比较
PVT组和非PVT组仅在腹痛史上的差异有统计学意义(P<0.05),而在腹水史、低钾血症、低钠血症、肝性脑病、上消化道出血病史、腹膜炎病史、肝肾综合征及住院期间死亡率上的差异无统计学意义(P>0.05),见表3。

表3 2组患者的症状及并发症的比较[n(%),n=134]
2.4 肝脏储备功能的比较
PVT组和非PVT组Child-Pugh分级、MLED评分差异无统计学意义(P>0.05),但非PVT组中患者肝功能为Child-Pugh C级的比例较PVT组更高,为30.6%;而PVT组和非PVT组在入院24 h内DIC评分上差异有统计学意义(P<0.05)。见表4。

表4 2组患者的肝脏储备功能比较(n=134)
2.5 失代偿期肝硬化合并PVT的危险因素方面多因素分析
将上述差异有统计学意义(P<0.05)的资料作为单因素纳入多因素logistic回归模型中分析,提示FIB升高、有脾切除史、DPV增加及DIC评分升高是PVT形成的独立危险因素,而服用NSBBs是PVT形成的保护因素,见表5。

表5 多因素logistic回归分析结果

将上述5个独立的相关因素纳入预测模型后建立失代偿期肝硬化PVT形成风险的个体化列线图预测模型(图1)。列线图的应用如下:根据该图,可以查到每个预测指标相对应的分数值并记录为总分,图中最后一行与总分相对应的预测概率是失代偿期肝硬化患者发生PVT的风险(范围0~1)。

图1 失代偿期肝硬化后PVT形成风险的个体化列线图预测模型
2.6 失代偿期肝硬化后PVT形成风险预测模型的评价检验
2.6.1区分度
上述建模所得的受试者工作特征(receiver operating characteristic curve,ROC)曲线下面积(AUC)为0.832 [95%CI( 0.784,0.880),P<0.001],该值大于0.5,Cutoff值为 53.7%(相应截断点对应的敏感度为76.1%,特异度为77.6%,阳性似然比为3.397,阴性似然比为0.308),表明上述预测模型预测患者是否出现PVT的价值较高。见图2。

图2 失代偿期肝硬化后PVT形成风险预测模型ROC曲线
2.6.2校准度
对上述预测模型建立校准曲线,横坐标是预测模型对失代偿期肝硬化患者PVT形成的可能性预测值,纵坐标是失代偿期肝硬化患者实际形成PVT的发生率,对角线是拟合线;可以看到预测模型校正前后的校准曲线与拟合线基本一致,表明模型拟合度好,见图3;同时对预测模型进行Hosmer-Lemeshow拟合优度检验(简称“H-L检验”):χ2=11.128,P=0.195,再次证明建立的预测模型的拟合度较好。

图3 失代偿期肝硬化后PVT形成风险预测模型的校准曲线
2.6.3临床有效性
画出预测模型的DCA曲线(图4),当阈概率在5%~88%范围内,患者净获益都比图中的2条极端曲线高,说明该范围内具有临床有效性。经上图ROC分析得到的截断值(53.7%) 也在该预测模型临床决策曲线阈概率范围内,因此可见该预测模型具有临床有效性。进一步分析可知,若经预测模型计算出PVT形成风险大于53.7%时即采取相应的干预措施,在建模人群中可有26%的净获益率。
2.6.4预测模型的具体应用
以某失代偿期肝硬化患者为例:测得该患者DPV为15 mm,血清FIB 3.5 g/L,DIC评分2分,有脾切除史及服用NSBBs史,根据所建立的列线图预测模型预测该患者PVT形成风险为82%(>53.7%),此时根据DCA曲线,应当采取干预措施,进行预防性抗凝治疗,降低患者形成PVT的风险。

图4 失代偿期肝硬化后PVT形成风险预测模型DCA曲线
3 讨 论
大量临床资料表明[9-11],脾切除术与肝硬化患者PVT形成的风险密切相关。脾切除术后肝硬化患者PVT发生率约为22%[9-10],本研究结果与此类似。脾切除术后PVT形成的风险增加,主要原因来源于两个方面[9-11],一方面是血流动力学方面的因素,脾切除后,脾静脉残端成为一个没有血流的盲端,容易形成血栓,如同河流中水不流动,水中的固体渣质会沉积下来形成淤泥。另一方面是脾切除术后PLT升高及质量异常,血管中PLT积聚形成血栓。脾全切与脾部分切除术后PVT形成的概率是不一样的。值得关注的是,脾全切除术后脾静脉残端形成血栓的概率非常高,但门静脉主干及分支、肠系膜上静脉等部位血栓形成概率会低很多。脾部分切除术后由于留下了部分脾脏及其血管的流入及流出道,有血流动力的血管不容易形成血栓,因此,脾部分切除患者在血流动力学方面能够大大减少血栓的形成。同时,剩余部分脾脏使得术后患者PLT水平能够基本维持在正常水平,也减少了PLT的聚集,减少血管内血栓形成。因此在肝硬化伴明显脾功能亢进的患者中行脾切除术需要关注术后如何预防PVT形成。
肝硬化时由于肝小叶失去正常生理结构及肝内纤维组织增生,导致肝血窦破坏、血管迂曲闭塞及门静脉高压,引起门脉增宽,最终降低门静脉流速[4]。多项文献研究通过多普勒超声发现当肝硬化患者的门静脉血流速度<15 cm/s时发生PVT的风险将增加10倍以上[12-14]。而NSBBs是肝硬化失代偿期治疗门静脉高压症的常用药物,国内有文献报道它可降低门静脉流速导致PVT发生率增高[4,15],但本研究得出的结论是,服用NSBBs可减少失代偿期肝硬化患者发生PVT的概率。这可能是由于本研究在使用NSBBs的时长及剂量上不够详尽,且本次收集的资料为回顾性资料,存在一定的回忆偏倚,今后仍需更多的前瞻性研究来验证结论。
1项meta分析显示,D-二聚体是肝硬化诊断PVT形成的一个重要标志物,其浓度高低和血栓病情的严重程度相关,但特异性较低[16]。本研究发现DIC评分对预测失代偿期肝硬化患者发生PVT有重要价值,该评分系统通过将PLT、D-二聚体、PT和FIB这4个参数值对应的分值相加获得[17]。值得一提的是该评分系统中的PT、FIB及D-二聚体在单因素统计学上的差异有统计学意义,但纳入回归模型中分析中仅提示FIB是PVT形成相关的独立影响因素,它作为血液中含量最高的凝血因子,主要由肝脏合成。FIB在凝血和纤溶2个系统中既是凝血酶作用的底物又是高浓度纤溶酶的靶物质,可在凝血酶的作用下转变为纤维蛋白,使血液凝固。FIB还能与PLT表面的膜蛋白结合,使PLT激活,促进PLT聚集,使机体处于高凝状态,有利于PVT形成。同时,FIB升高导致机体继发纤溶亢进,引起D-二聚体水平升高[4,11,17]。综上,血清中FIB水平会对PT、APTT、D-二聚体都会有影响,故凝血指标中FIB的影响作用较其他指标更大。由于DIC评分已经包括常规的凝血参数,本研究探讨了DIC评分作为预测失代偿期肝硬化患者PVT发生的价值,与其他凝血相关的单项预测因素比较,DIC评分预测PVT的诊断价值良好,值得一步研究分析。
根据《肝硬化门静脉血栓管理专家共识(2020年)》[1],目前对于可能发生失代偿期肝硬化后PVT形成的高危患者(包括准备行肝移植手术的患者、有症状的急性闭塞性PVT患者、PVT影像学进展的患者及有肠系膜缺血风险的患者),若无明显禁忌应尽早启动抗凝治疗,有助于延长生存率。但是,对于肝硬化患者来说抗凝治疗在预防血栓形成的同时又面临着较健康人群更高的出血风险。如何精准地判断哪些肝硬化患者需要早期的临床干预值得深思。同时,目前尚缺乏肝硬化后PVT形成风险预测模型的相关研究。本研究通过建立失代偿期肝硬化患者PVT形成的列线图预测模型,根据患者既往史、实验室及影像学检查、入院DIC评分预测其发生PVT的概率,对失代偿期肝硬化人群建立个体化、精准化治疗。在本研究中将 ROC曲线的截断值53.7%作为 DCA 曲线的阈概率值时,患者的临床净获益率高于不采取或全部采取干预的2种极端方式,这也提示当模型预测出患者PVT风险高于53.7%后,若立即采取干预措施,会使患者从临床中获益,低于53.7%时可通过定期体检动态观察是否形成PVT。
模型的不足之处:列线图中有一半以上的独立危险因素为连续型变量,缺少简洁性,为方便模型的临床应用后期可考虑将其转换为分类变量;另外,住院期间患者指标是动态性变化的,是否需要在出院时进行再一次评估还有待验证。若还能纳入多个中心的前瞻性的研究,增大样本量,同时反复内外部交叉验证,能够进一步强化并完善风险预测模型。此外,在未来更多的研究中还应更大程度地优化成本效益。总之,失代偿期肝硬化合并PVT的发病机制复杂,目前仍未完全阐明,今后还需要收集更多相关病例进一步研究。
PVT是肝硬化患者出现的严重并发症之一,会延长患者的住院时间,增加住院费用和加重医疗负担。本研究通过多因素logistic回归分析得出,血清FIB升高、DPV增加、既往有脾切除术史、入院后DIC评分高会增加失代偿期肝硬化患者PVT形成的风险,而使用NSBBs药物可减少失代偿期肝硬化患者罹患PVT的概率。通过建模得到预测肝硬化患者是否出现PVT的危险得分方程:Logit(P)=0.528×FIB(g/L)+2.166×n1(脾切除术史,有n1=1,无n1=0)+0.267×DPV(mm)-0.980×n2(NSBBs使用,有史n2=1,无n2=0)+0.527×DIC评分-6.632(常量)。此预测模型ROC AUC为0.832[95%CI:(0.784,0.880),P<0.001],预测模型校正后的校准曲线拟合度好(H-L检验:χ2=11.128,P=0.195),表明上述多因素预测失代偿期肝硬化患者是否出现PVT的价值较高,而该预测模型的DCA曲线表明当阈概率值设为53.7%时,建模人群中有26%的净获益率。故此预测模型在临床工作中可能有一定的应用价值。

