阿奇霉素干混悬剂微生物限度检查方法选择原则
闵 红 张秉华 闫 博 刘 宇 戴 涌▲
1.陕西省食品药品检验研究院,陕西西安 710065;2.陕西省绥德县市场监管综合执法大队,陕西绥德 718099
阿奇霉素干混悬液为大环内酯类抗生素,主要通过干扰、破坏微生物蛋白质的合成达到杀菌、消炎的目的。抗生素类药物一般具有较强抑菌性[1-2],可共存的微生物往往处于受损状态。若采用常规法进行微生物检验,受损微生物在抑菌剂的影响下无法正常繁殖,会造成“假阴性”结果。但该药进入人体后,受损微生物从有抑菌性转入无抑菌性的环境,会逐渐复苏并正常繁殖,从而对人类健康造成危害[3]。
《中华人民共和国药典》中方法均经过验证,每种药物在引入检验之前,应先进行微生物方法适用性研究[4]。微生物适用性研究的本质是去除药物的抑菌性,具体方法包括稀释法、中和法、薄膜过滤法,即稀释液/培养基体积的增加、适宜的中和剂筛选、薄膜冲洗量的提高等[5-7]。
本研究考察常规法、稀释法、中和法、稀释结合中和法、薄膜过滤结合中和法等13种方法去除阿奇霉素干混悬剂抑菌性的能力,比较稀释结合中和法和稀释、薄膜过滤结合中和法的优、劣势,以期为企业提出相应的指导意见。
1 仪器与材料
1.1 仪器、耗材
试验用仪器、耗材:法国梅里埃有限公司生产的VITEK2全自动微生物鉴定系统;上海力申科学仪器有限公司生产的HFsafe-1200 LC型生物安全柜;上海一恒科学仪器有限公司生产的LRH-250B型生化培养箱;浙江泰林生物技术股份有限公司生产的FC752型薄膜过滤器、HTY-ASL0i型集菌仪;德国赛多利斯公司生产的BS2202S型电子分析天平。
1.2 供试品
阿奇霉素干混悬剂(西安利君制药有限公司,批号:2006291)。
1.3 菌种
具体菌种信息见表1。
表1 菌种信息
1.4 试剂及培养基
以下试剂、培养基均由北京陆桥技术有限公司生产。稀释液为pH 7.0无菌氯化钠蛋白胨缓冲液;选用pH 7.0无菌氯化钠蛋白胨缓冲液(聚山梨酯80含量为10%)作为含中和剂的稀释液;0.1%蛋白胨溶液(聚山梨酯80含量为0.1%)作为冲洗液;培养基种类主要有胰酪大豆胨液体(soybeancasein digest broth,TSB)培养基、胰酪大豆胨琼脂(soybean-casein digest agar,TSA)培养基、沙氏葡萄糖液体(sabouraud dextrose broth,SDB)培养基、沙氏葡萄糖琼脂(sabouraud dextrose agar,SDA)培养基。
2 方法
2.1 菌液制备
菌液制备条件见表2。
表2 菌液制备条件
2.2 微生物限度方法适用性试验
2.2.1 常规法(1∶10供试液) 1∶10供试液制备:称取10 g阿奇霉素干混悬剂,加入pH 7.0的无菌氯化钠蛋白胨缓冲液中,定容至100 ml。
试验组:量取10.0 ml的1∶10供试液装于无菌试管中,加入5种代表性的试验菌液0.1 ml,其含菌量不超过104cfu/ml,革兰阳性菌、革兰阴性菌、芽孢菌群、霉菌、酵母菌的代表分别为金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、黑曲霉、白色念珠菌[3]。取1 ml制备好的试验组,置于直径90 mm的培养皿中,注入TSA培养基(在35℃下培养3 d)或SDA培养基(在25℃下培养5 d),培养完成后计数。
菌液对照组:将供试液用pH 7.0的无菌氯化钠蛋白胨缓冲液替代,详细操作同试验组[5-7]。
供试品对照组:将菌液用pH 7.0的无菌氯化钠蛋白胨缓冲液替代,详细操作同试验组[5-7]。
供试品回收值R1为:试验组N与供试品对照组的菌落数N0之差,比菌液对照组菌落数N1,即R1=(N-N0)/N1。
若供试品的需氧菌总数的回收值(5种试验菌)、霉菌和酵母菌总数的回收值(2种试验菌)均在0.5~2.0,则其方法适用性试验通过[5-7]。每种试验菌均需进行3次重复试验。
2.2.2 中和法 供试液制备:称取10 g阿奇霉素干混悬剂,采用pH 7.0的无菌氯化钠蛋白胨缓冲液(聚山梨酯80含量为10%)定容至100 ml,配制成1∶10的供试液。
除需设置试验组、菌液对照组、供试品对照组外,还需增加中和剂对照组,即将供试品用相应量中和剂的稀释液替代,具体操作同试验组[5-7]。其余操作同“2.2.1常规法”。
根据公式R1=(N-N0)/N1计算供试品回收值,根据公式R2=N2/N1计算供试品回收值。其中R2、N1、N2分别为中和剂回收值、菌液对照组菌落数、中和剂对照组菌落数。
2.2.3 稀释结合中和法 供试液制备:取阿奇霉素干混悬剂10 g,以pH 7.0无菌氯化钠蛋白胨缓冲液(聚山梨酯80含量为10%)为稀释液,分别制成1∶20、1∶50、1∶100、1∶200和1∶500供试液。
试验组:分别取上述制备好的5种供试液30 ml装于无菌试管中,试验平行3次,再分别加入0.3 ml含菌量≤104cfu/ml的试验菌液,3种试验菌分别是金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌。
取制备好的试验组1 ml,分别置于5个培养皿(直径为90 mm和150 mm)中,平均每皿0.2 ml,注入TSA(35℃培养3 d)或SDA(25℃培养5 d),计数。菌液对照组、供试品对照组、中和剂对照组分别采用pH 7.0无菌氯化钠蛋白胨缓冲液(聚山梨酯80含量为10%)代替供试液、菌液、供试品,具体操作与试验组相同。回收值的计算同“2.2.2中和法”。
2.2.4 薄膜过滤结合中和法 供试液、试验组、菌液对照组、供试品对照组和中和剂对照组制备同“2.2.2中和法”。
过滤培养:分别取上述制备好5种样品1 ml,加入50 ml的pH 7.0无菌氯化钠蛋白胨缓冲液,在薄膜过滤器中过滤,再用100 ml的0.1%蛋白胨溶液(聚山梨酯80含量为0.1%)冲洗,重复冲洗5次,将滤膜正面朝上贴于TSA上,然后进行培养、计数。回收值计算同“2.2.2中和法”。
2.2.5 稀释、薄膜过滤结合中和法 供试液制备:取阿奇霉素干混悬剂10 g,以pH 7.0无菌氯化钠蛋白胨缓冲液(聚山梨酯80含量为10%)为稀释液,分别制成1∶20和1∶100供试液。其余过程均同“2.2.4薄膜过滤法结合中和法”。
3 结果
3.1 采用常规法、中和法开展需氧菌总数方法适用性研究
对阿奇霉素干混悬剂采用常规法、中和法开展需氧菌总数方法适用性研究(表3),发现黑曲霉和白色念珠菌的回收值均在0.5~2.0范围,枯草芽孢杆菌、金黄色葡萄球菌和铜绿假单胞菌的回收值均为0。

表3 采用常规法、中和法开展方法研究的回收值
对阿奇霉素干混悬剂采用常规法开展霉菌和酵母菌总数方法适用性研究(表4),发现白色念珠菌和黑曲霉的回收值均在0.5~2.0范围,可取1∶10供试液(以pH 7.0无菌氯化钠蛋白胨缓冲液)1 ml倾注平皿(直径90 mm)进行该供试品的霉菌和酵母菌总数计数。

表4 采用常规法开展霉菌和酵母菌总数方法研究的回收值
若使用中和剂就应确认该中和剂对微生物无毒性,即中和剂回收值在0.5~2.0范围内,才可用于该供试品的方法适用性试验[5-7]。10%聚山梨酯80对微生物无抑制作用,可用于阿奇霉素干混悬剂微生物方法适用性试验。
3.2 采用稀释结合中和法开展需氧菌总数方法适用性研究
对阿奇霉素干混悬剂采用稀释结合中和法进行需氧菌总数方法适用性研究(表5),当取1∶500供试液1 ml倾注至直径150 mm的无菌平皿,枯草芽孢杆菌、金黄色葡萄球菌和铜绿假单胞菌的回收值在0.5~2.0范围内,其余方法回收值均不能达到要求。因此,可取1∶500供试液(以聚山梨酯80含量为10%的pH 7.0无菌氯化钠蛋白胨缓冲液为稀释液)1 ml平均倾注5个无菌平皿中进行该供试品的需氧菌总数计数。
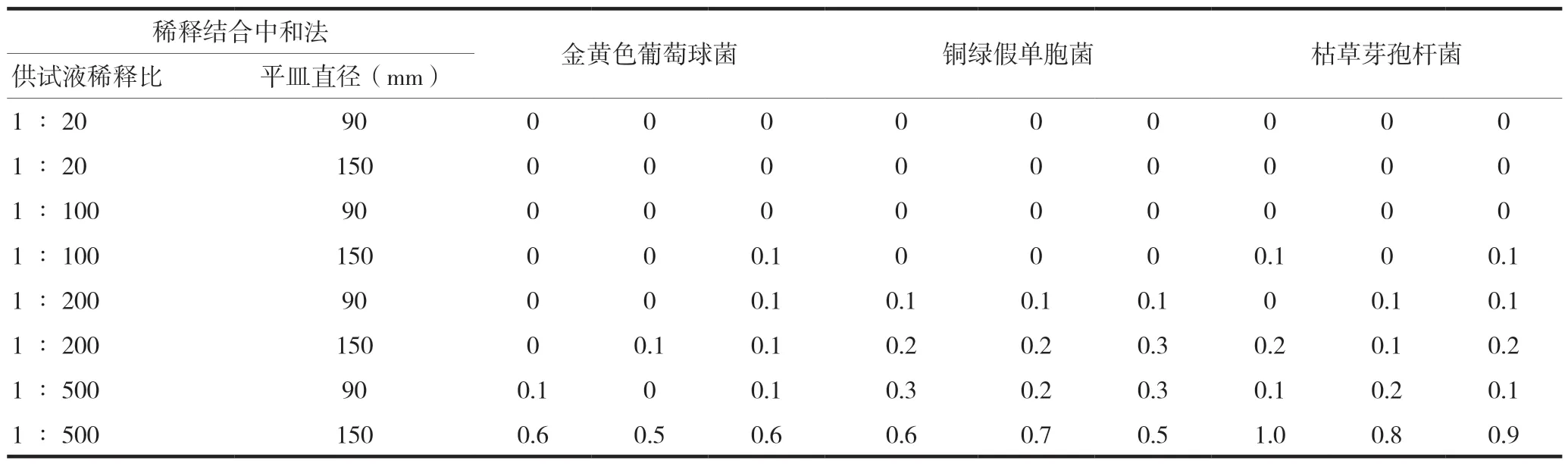
表5 采用稀释结合中和法开展方法研究的回收值
3.3 采用稀释、薄膜过滤结合中和法开展需氧菌总数方法适用性研究
对阿奇霉素干混悬剂采用稀释、薄膜过滤结合中和法,开展需氧菌总数方法适用性研究(表6),当取1 ml的1∶100供试液进行薄膜过滤时,金黄色葡萄球菌、枯草芽孢杆菌和铜绿假单胞菌的回收值均在0.5~2.0范围内。因此,可取供试品10 g,以pH 7.0无菌氯化钠蛋白胨缓冲液(聚山梨酯80含量为10%)为稀释液,制成1∶100供试液。用无菌注射器取该供试液1 ml加入薄膜过滤器中(50 ml的 pH 7.0无菌氯化钠蛋白胨缓冲液),用0.1%蛋白胨溶液(聚山梨酯80含量为0.1%)冲洗,分5次冲洗,每次冲洗100 ml,然后进行该供试品的需氧菌总数计数。
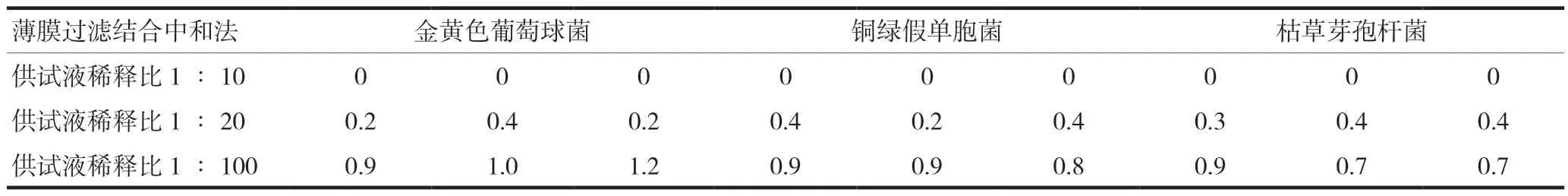
表6 采用稀释、薄膜过滤结合中和法开展方法研究的回收值
4 讨论
微生物方法学研究需综合考虑药物的剂型、处方、标准限度等,为药物探索出污染风险低、灵敏度高、操作性强、成本低廉的微生物检查法,满足企业常态化的检验[8]。
4.1 中和法消除药物制剂抑菌活性
在药品微生物检测过程中,添加中和剂到稀释剂、冲洗液或培养基中,可显著钝化、中和其药物的抑菌活性[9]。聚山梨酯80是一种非离子型表面活性剂,在供试品制备过程中主要起乳化和增溶作用[9-11],是《中华人民共和国药典》规定的常用中和剂。有研究在pH 7.0无菌氯化钠蛋白胨缓冲液(常规稀释液)中添加了10%聚山梨酯80,发现枯草芽孢杆菌、金黄色葡萄球菌和铜绿假单胞菌的回收值均为0,表明单独使用聚山梨酯80作为中和剂,无法消除阿奇霉素干混悬剂的抑菌性,与稀释法或薄膜过滤法结合使用能更好地发挥作用[10]。
4.2 稀释结合中和法消除药物制剂抑菌活性
稀释法通过对抑菌成分的稀释减弱药品的抑菌活性[12]。本研究首先增加了稀释液体积,分别采用1∶20、1∶100、1∶200、1∶500供试液1 ml倾注直径为90 mm的无菌平皿,其次将直径150 mm取代90 mm的培养皿,并将1 ml供试液平均分为5皿进行倾注,将培养基总量增加到400 ml。如果回收值仍无法达到《中华人民共和国药典》要求,可将1 ml供试液平均分配到更多平皿进行倾注,达到增加培养基量的目的。
4.3 稀释、薄膜过滤结合中和法消除药物制剂抑菌活性
薄膜过滤法是将供试品通过孔径≤0.45 μm的滤膜,药品成分被过滤,微生物被截留于滤膜,常被用于强抑菌性药品的检测[5,12]。本研究首先采用薄膜过滤结合中和法,发现枯草芽孢杆菌、金黄色葡萄球菌和铜绿假单胞菌的回收值均为0。然后采用了1∶100稀释结合薄膜过滤和中和法,5种试验菌的回收值达到0.5~2.0范围。目前,市场中薄膜过滤器的质量参差不齐,并且无法精准对每个试验用薄膜过滤器进行质控,因此,中、美、欧药典均规定总冲洗量不超过500 ml[5-7]。由于薄膜过滤法对冲洗量的限制,将稀释法、中和法结合薄膜过滤法,能有效去除抗生素类药物的抑菌性[13]。
4.4 根据需求选择更准确可靠的微生物检验方法
微生物限度检查直接影响药品使用的安全性[14]。平皿法操作方便,不易污染,成本低;薄膜过滤法操作繁琐,易受污染,对人员技术性要求高,需要配制集菌仪和薄膜过滤器[11],试验成本较高。从成本、操作、污染风险方面,对阿奇霉素干混悬剂检验应首选稀释法结合中和法;从检验灵敏度方面应首选稀释结合薄膜过滤结合中和法。
无论平皿法还是薄膜过滤法都存在检验耗时长、不能使产品快速放行、增加储存成本问题,快速微生物检测技术可提高检测效率和自动化程度,并为药品微生物检验的数据可靠性提供新思路[15]。

