同种接合型酵母菌株Y2HGold的原生质体融合研究
常登龙,洪 玉,杨永军,张贺翠,薛丽琰,杨 昆,朱利泉,王小佳(西南大学农学与生物科技学院,重庆400715)
同种接合型酵母菌株Y2HGold的原生质体融合研究
常登龙,洪 玉,杨永军,张贺翠,薛丽琰,杨 昆,朱利泉*,王小佳
(西南大学农学与生物科技学院,重庆400715)
为避开有性融合的局限性,挖掘同种接合型酵母菌株无性融合的潜在应用价值,利用质粒构建了酵母双杂交工程菌株Y2HGold的亮氨酸缺陷型和色氨酸缺陷型菌株;接着采用酶解法进行四因素三水平正交实验获得原生质体制备方案:酶解温度30℃、处理时间80min、预处理剂含0.1%(w/v)巯基乙醇和0.1%(w/v)EDTA-2Na,酶解液为1.5%(w/v)蜗牛酶和1.5%(w/v)纤维素酶混合,使得原生质体的制备及再生率分别达82%和37%;最后采用PEG诱导融合的方法,经过同样正交实验得到Y2HGold无性融合条件为:PEG浓度35%、温度25℃、时间40min、pH5.8。筛选得到的无性融合子在遗传上稳定。
酵母,原生质体,无性融合,无性融合菌株
酵母为单细胞型真菌,在通常情况下,繁殖体为二倍体,但是在特定条件的诱导下,可以使其产生单倍体孢子并萌发为单倍体繁殖体。根据酵母第三号染色体上特殊等位基因MATa和MATɑ的差异,把单倍体酵母划分为a和α两种交配型。两种交配型细胞经细胞壁上特定的性凝集素诱导而交配,恢复为二倍体;如酿酒酵母的a和α两种类型的性凝集素为细胞的交配提供有利条件(图1)。a性凝集素包括AGA1p和AGA2p两个亚基,分别由两个不相连的AGA1和AGA2基因编码。a性凝集素靠AGA1p亚基来锚定。其中两种交配型细胞都编码这种亚基,AGA2p亚基只在a型细胞中表达,与a凝集互补的α-凝集素则是被单基因SAG1编码的。同一交配型细胞之间,因细胞壁上存在相同凝集因子不能进行交配。杂交育种利用了酵母单双倍生活周期的特点,将不同基因型和相对的交配型的单倍体细胞经诱导杂交而形成二倍体或多倍体细胞,而对于同种接合型的酵母只能通过诱导融合形成二倍体或多倍体。目前应用原生质体融合形成二倍体或多倍体的报道很多[3-5],大都是将具有不同性状的两种或多种酵母菌进行融合,未见同种性别单倍体菌无性融合的相关报道,但在对酵母菌的研究中仅从有性融合或普通融合出发具有一定的局限性。本文初步探讨了同种接合型单倍体酵母菌株Y2HGold无性融合的条件及与有性融合的对比,这为发掘同种接合型酵母菌株无性融合的潜在价值提供依据。
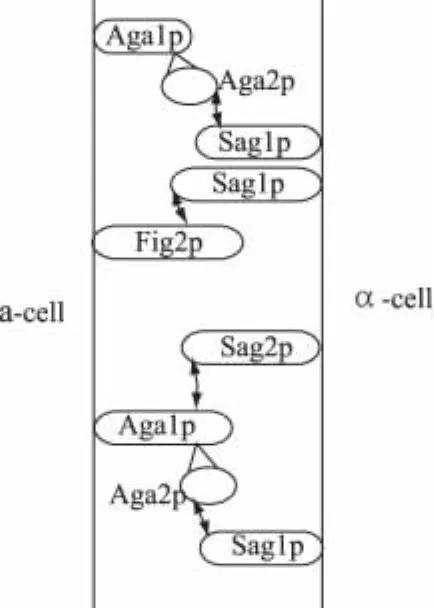
图1 酿酒酵母黏附素的表达和配合[1-2]Fig.1 Expression and interactions of sexual adhesins in S.cerevisiae[1-2]
1 材料与方法
1.1 材料与仪器
酵母双杂交系统菌株 Y2HGold(a型)、Y187 (α型)、大肠杆菌感受态DH5α 北京全式金生物技术有限公司;质粒提取试剂盒 TransGen公司;酵母双杂交系统(MatchmakerTMGold Yeast Two-Hybrid System) Clontech公司;SD、SD/-Leu、SD/-Trp、SD/-Leu-Trp 配方见 Clontech公司的 Gold yeast two-hybrid system系统的说明书;高渗完全培养基(YPDS) YPDA+8mol/L甘露醇;LB培养基、液体完全培养基(YEPD)、YPDA培养基(YPD添加0.03g/L腺嘌呤硫酸盐) 以上培养基均为121kPa,15m in灭菌;蜗牛酶(Snailase)、纤维素酶(Cellulase R-10) 用渗透压稳定剂配制,0.22μm微孔滤膜过滤除菌,酶液均为现配现用;0.2mol/L磷酸缓冲液(PB),0.8mol/L甘露醇溶液,17%(w/v)的蔗糖溶液,0.8mol/L的山梨醇溶液,EDTA-2Na,巯基乙醇,PEG溶液4000,0.01mol/L CaCl2,KCl 0.7mol/L。
Mikro 120(小型微量离心机M ikro120) 德国赫提驰(海蒂诗)Hettich;MiniSpin(Eppendorf高速离心机) 德国艾本德股份司(Eppendorf);GXZ型智能光照培养箱 宁波东南仪器有限公司;ZD-85型恒温振荡器 常州国华电器有限公司;SW-CJ-1Cμ型双人单面净化工作台 苏州净化电器有限公司; ES-315型高压蒸汽灭菌锅 日本 Tomy Digital Biology公司;美的 PJ21C-AN微波炉 广东美的微波炉制造有限公司;BX51系统显微镜 奥林巴斯(日本 OLYMPUS);PCR仪(070-851 Tprofessional Standard Gradient 96) 德国Biometra;JA2003A电子天平 上海精天电子仪器有限公司。
1.2 实验方法
1.2.1 菌株的构建 制备酵母感受态细胞:参考Clontech公司的酵母双杂交系统使用说明书(MatchmakerTMGold Yeast Two-Hybrid System User Manual)标准的操作方法。根据酵母双杂交工程菌株Y2HGold基因特点构建菌株,将酵母双杂交体系质粒 AD(Activation domain)、BD(DNA-binding domain)运用组合转化法转入Y2HGold菌株感受态细胞,采用SD/-Leu或SD/-Trp(SD/1)平板进行缺陷型筛选及传代培养,观察菌株稳定性。
1.2.2 亲本原生质体最适制备与再生条件的单因素实验 设置处理温度为20、25、32、35、40℃,在预处理剂为0.15%(w/v)、混合酶1.5%(w/v)、酶处理时间60m in条件下,进行原生质体制备及再生,初步筛选最适处理温度。然后,按此处理温度进行最适预处理剂浓度初步筛选实验,分别设置预处理剂为0.05%、0.1%、0.15%、0.2%、0.25%(w/v),其他条件同上。以此类推,按初步筛选的最适处理温度和预处理剂浓度进行最适混合酶初步筛选,设置混合酶浓度分别为0.5%、1.0%、1.5%、2.0%、2.5%(w/v)。同理设置酶处理时间分别为30、40、60、80、90m in,初步确定最适酶处理时间。
1.2.3 亲本原生质体制备及再生优化 据单因素实验结果,选取原生质体制备的四个关键因素:酶解温度、预处理剂EDTA-2Na+巯基乙醇(w/v)浓度,混合酶蜗牛酶+纤维素酶(w/v)浓度以及酶处理时间及进行四因素三水平正交[6]实验(见表1)。
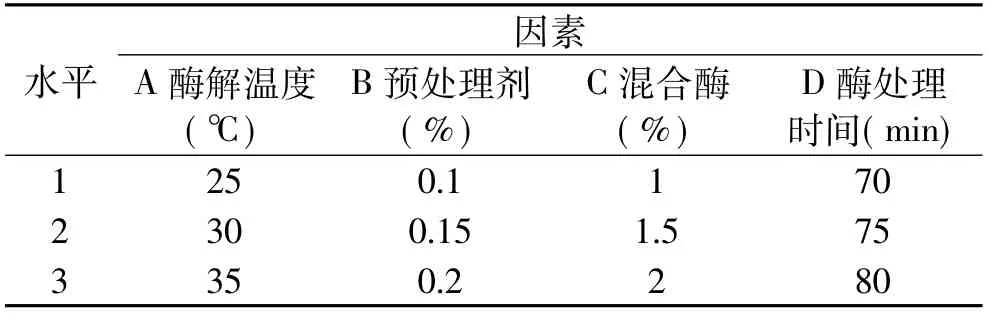
表1 酵母细胞原生质体制备与再生正交实验因素水平表Table 1 The orthogonal test of the asexualwall-broken condition of protoplasts
取对数期菌液活化(细胞数达107~108个/m L)→离心收集菌体→预处理剂悬浮→离心清洗菌体→震荡酶解→缓冲液洗原生质体→涨破处理→涂完全培养基,酶解后菌液经稀释后涂高渗培养基→分别培养计数,菌体数计算采用涂板计数和血球计数两种方法,加之OD值校对。计数原生质体的形成率[7]:原生质体的形成率L(%)=(A-B)/A×100,式中,A:酶前菌体数;B:酶后菌体数。
原生质体的再生采用双层平板培养法,底层铺一层含2.5%琼脂的高渗YPDA培养基,烘箱干燥几小时使表面脱水,倒入10m L预先保温在40℃的含有0.5%(w/v)琼脂并混合了 1m L原生质体悬液的YPDA高渗培养基。原生质体再生率 L(%)= (C-B)/(A-B)×100,式中,A:酶前菌体数;B:酶后菌体数;C:高渗板菌体数。
1.2.4 原生质体融合及融合子筛选 采用PEG浓度,融合时间,温度及pH四个关键因素,设计4因素3水平正交实验优化原生质体的无性融合条件(表2),根据表2将两亲本新制备的原生质体各4m L (5×107~10×107个/m L)等量混合,离心,加等体积不同浓度的PEG4000(含0.01mol/L CaCl2)4m L助融,悬浮原生质体并置于不同温度的水浴锅上,期间轻轻震荡,促使融合。融合完成后,1000 r/m in离心10m in,弃上清即获得融合沉淀物。用0.7mol/L KCl悬浮融合物沉淀并分别稀释至原样液体积的(4m L)的10-3、10-2、10-1倍,各取150μL,涂于高渗 SD/-Leu-Trp(SD/2)板上。

表2 原生质体无性融合正交实验因素水平表Table 2 The orthogonal test results of the asexual fusion condition of protoplasts
先将融合菌体稀释后全部涂布于高渗YPDA平板上,培养2d待长出菌落后将所有融合子稀释洗涤后转接到高渗二缺板(高渗SD/2)选择性培养基上面,培养得到无性融合子。
融合率(%)=(高渗SD/2二缺培养基上生长菌落数/高渗YPDA上生长菌落数)×100,数据统一采用SPSS13.0软件分析。
2 结果与分析
2.1 菌株的构建
采用表3转化法将酵母双杂交质粒AD和BD分别转入酵母双杂交工程菌株Y2HGold构建缺陷型菌株,并将AD和BD质粒同时转入Y2HGold观察两个质粒的共存情况,在单缺板SD/1(SD/-Leu或SD/-Trp)和二缺板SD/2(SD/-Leu-Trp)上分别经过10代以上传代培养证实可以稳定遗传,得到Y2HGold亮氨酸和色氨酸缺陷型标记菌株。
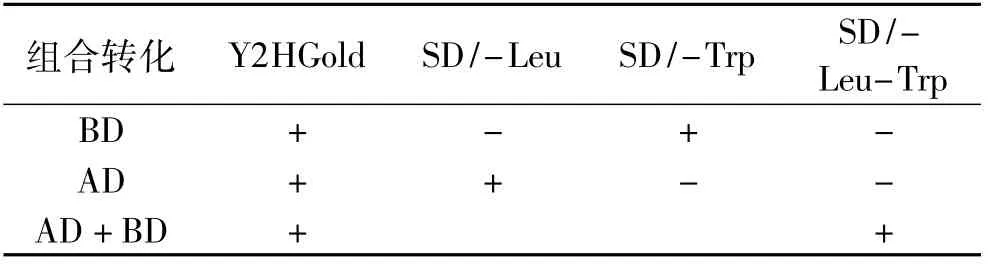
表3 缺陷型菌株的组合转化生长有无情况Table 3 The construction of the yeast defective strains
图2 转化质粒后涂平板结果Fig.2 The growth of strains on the plate after plasmid transferred
酵母双杂交工程菌Y2HGold中有由3个不同的Gal4操纵基因调节的4个完整的报告基因AUR1-C、HIS3、ADE2和MEL1,而BD质粒含有TRP1缺陷筛选基因,AD质粒含有LEU2缺陷筛选基因,只有BD和AD质粒同时转入的酵母菌才能在SD/-Trp/-Leu选择培养基上生长;将AD转入Y2HGold获得能在SD/-Leu培养基上生长的菌株,BD转入Y2HGold获得能在SD/-Trp培养基上生长的菌株,两菌株的原生质体融合子因含有两个质粒而能在SD/-Leu-Trp培养基上生长,由此完成了菌株缺陷性标记。
2.2 单因素实验结果
2.2.1 菌龄对原生质体制备及再生的影响 菌体的不同生理状态,直接影响到菌体的细胞壁结构、代谢水平及活力等[8]。本实验选用对数生长期的菌体,此时的细胞代谢旺盛、生长率高,菌体细胞的化学组成、形态及生理特征比较一致[9],Y2HGold的亮氨酸缺陷型和色氨酸缺陷型菌株对数生长期均在16~20h之间,具体生长周期还跟单克隆活性、转接代数及接种量有关系。2.2.2 处理温度对原生质体制备及再生的影响 由图3可知,处理温度为20~25℃,低于Y2HGold最适培养温度时,混合破壁酶的酶活性低,原生质体形成率低,再生率接近于零,当处理温度为25~32℃时,混合破壁酶活性逐渐增高,原生质体形成率和再生率也大幅增加;当处理温度为32℃时,混合破壁酶活性最高,原生质体形成率高达82%,再生率达37%,处理温度35~40℃时,原生质体形成率减少、再生率亦有下降趋势。由此得出,原生质体的最适酶解温度稍高于受体菌的最适生长温度。当低于最适酶解温度时,随着温度的升高,原生质体形成率、再生率呈上升趋势;当高于最适酶解温度,原生质体的形成率、再生率呈下降趋势。
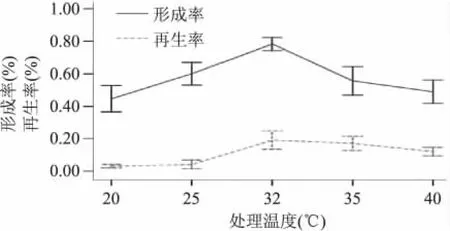
图3 温度对原生质体制备及再生的影响Fig.3 The effect of the temperature on the formation rate and regeneration rate of the Y2HGold protoplast
2.2.3 预处理剂对原生质体制备及再生的影响 单倍体亲株Y2HGold的两种缺陷型菌株分别经YPDA液体培养基摇瓶培养至对数期时进行破壁前预处理,研究其对原生质体形成与再生的影响,结果见图4。由图 4可知,预处理剂浓度在 0.05%~0.25% (w/v)原生质体形成率呈上升趋势,原生质体形成率则先上升后下降,出现峰值,低浓度0.05%(w/v)预处理剂处理原生质体再生率较高但形成率低,而高浓度0.25%(w/v)预处理剂使得原生质体形成率高但再生率下降,说明低浓度预处理剂不能提高破壁率而高浓度预处理剂提高原生质体形成率的同时降低了原生质体的活性,由图4可知0.1%EDTA-2Na和0.1% (v/v)巯基乙醇混合预处理液处理效果最好。
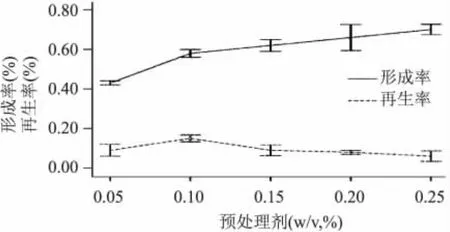
图4 预处理剂对原生质体制备及再生的影响Fig.4 The effect of the pretreatment on the formation rate and regeneration rate of the Y2HGold protoplast
2.2.4 酶量对原生质体制备及再生的影响 根据酵母细胞壁的主要构成成分,考虑纤维素酶、蜗牛酶单独处理效果不及混合酶处理效果好[10-12],故本实验采用不同浓度的两种酶混合进行梯度处理,由图5可知最佳酶系统为1.5%纤维素酶+1.5%蜗牛酶。低浓度混合酶破壁率低;高浓度混合酶破壁率高,但再生率下降。其他因素不变时酶量越大,原生质体形成率越高但再生率下降[13],这是因为一方面,酶中往往含有对原生质体有害的酶类,酶量增加,杂酶的浓度也会随之增加,当达到一定浓度时,会影响原生质体的活性;另一方面,酶浓度过大易使菌体凝集而难于原生质体化,而且细胞脱壁过于彻底导致原生质体的再生率降低。
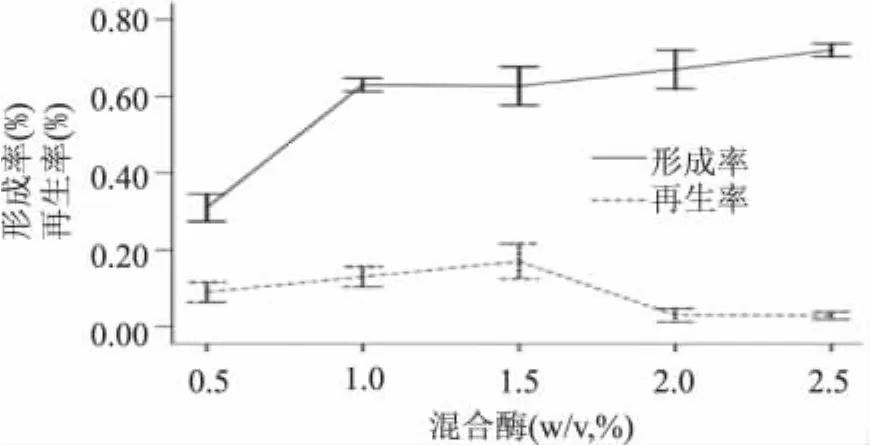
图5 混合酶对原生质体制备及再生的影响Fig.5 The effect of themixed enzyme on the formation rate and regeneration rate of the Y2HGold protoplast
2.2.5 酶解时间对原生质体制备及再生的影响 由图6可知,处理时间越长,酶解效果越好,可能是因为随着时间的增加,酶对细胞壁的分解更充分,使原生质体形成率增加,但再生率相应降低,可能是酶解太久,细胞过分解壁,造成细胞膜破损,不利于原生质体的融合和再生,本实验得出的最佳酶解时间为80min。
由实验知,四种关键因素对原生质体制备与再生都会造成不同程度的影响,采用优化的方案才能达到较好的效果,另外还有其他因素对原生质体的制备及再生有影响,如出发菌株单克隆的活性、转接代数及摇菌的接种量、pH、渗透压稳定剂、培养基组成、菌体分散程度和遗传性等。
2.2.6 亲本原生质体制备再生正交实验结果 据单因素实验结果,选取原生质体制备的四个关键因素:酶解温度、预处理剂浓度,混合酶浓度以及酶处理时间正交实验结果见表4。
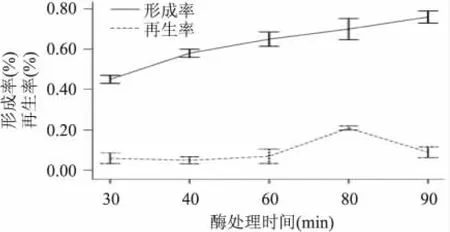
图6 酶解时间对原生质体制备及再生的影响Fig.6 The effect of the enzyme treating time on the formation rate and regeneration rate of the Y2HGold protoplast
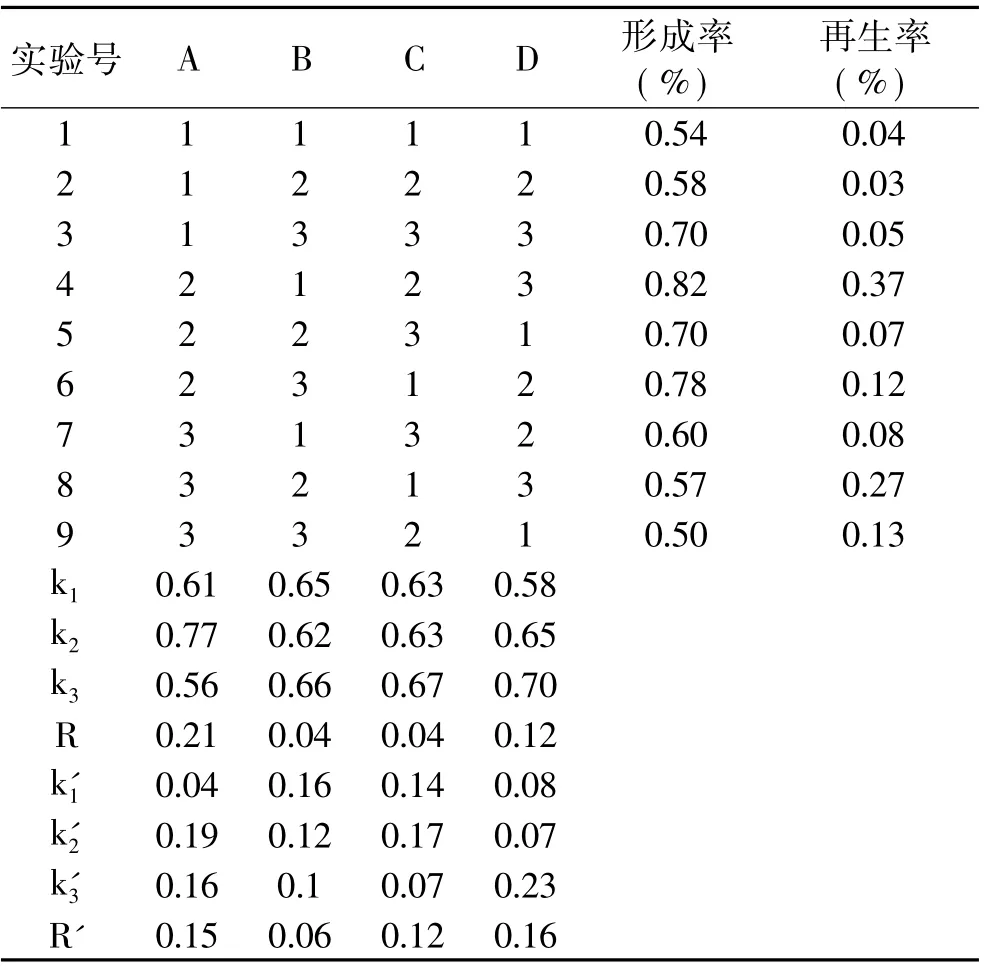
表4 酵母细胞原生质体制备与再生正交实验结果Table 4 The orthogonal test results of the yeastwall-broken condition of protoplasts
由表4对结果的分析可以看出,各因素影响原生质体再生率的主次顺序为D>A>C>B,最佳配比为A2B1C2D3。正交实验中优选的最佳条件也为A2B1C2D3。综合来看,酶解时间和处理温度对原生质体的制备和再生影响较大,混合酶和预处理剂次之,综合考虑选取A2B1C2D3为最佳实验条件,即最适酶解温度30℃、最适处理时间80m in、最适预处理剂含0.1%(w/v)巯基乙醇和0.1%(w/v)EDTA-2Na,最适酶解液为1.5%(w/v)蜗牛酶和1.5%(w/v)纤维素酶混合,使得原生质体的制备及再生率分别达82%和37%。由表5选取原生质体再生率进行方差分析结果显示:四个因素间 F值分布于 1.550~11.591,p值由0.000~0.239,说明酶解温度和酶处理时间对再生率的影响差异有极显著性意义,混合酶对原生质体再生率的影响差异有显著性意义而预处理剂对原生质体再生率的影响差异不显著。
2.3 原生质体无性融合条件的优化
按照表2中四个关键因素PEG浓度、融合时间、温度及pH设计4因素3水平正交实验优化原生质体的无性融合条件,结果见表6。
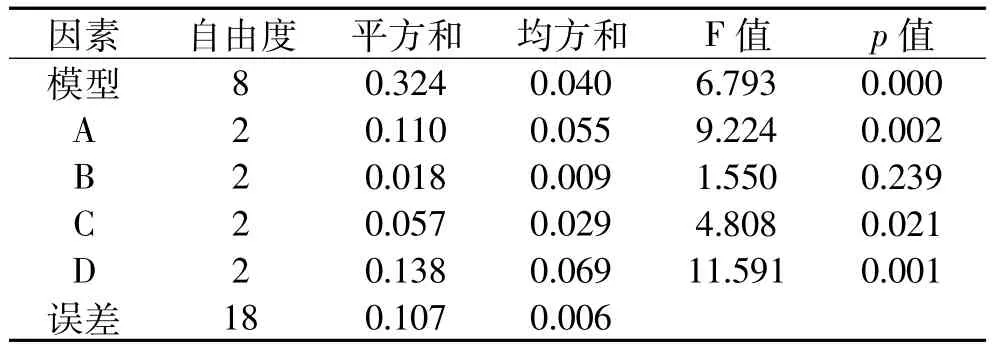
表5 表4再生率正交结果方差分析表Table 5 The Table 4’s variance analysis
由表6得出PEG浓度对原生质体融合的显著性影响最大(R=4.8),而处理时间(R=3.6)和处理温度(R=3.9)对原生质体融合影响作用相当,pH对原生质体融合影响相对较小(R=1.4)。表7方差分析结果显示:四个因素间F值分布于32.507~315.711,p值=0.000,说明四个关键因素对融合率的影响差异有极显著性意义,每个处理的三个重复之间(p= 0.0262)不显著,重复可用。最后得出因素的主次顺序为A>B>C>D,正交实验确定的最佳融合条件是A2B2C3D2,即PEG35%,pH 5.8,25℃处理40m in的融合条件效果最好,融合率达12.6×10-6。关键因素PEG是原生质体融合诱导剂,PEG浓度与原生质体的存活率和融合率有一定关系,因为PEG对原生质体有一定的毒性作用。PEG浓度在30%~35%过程融合率呈上升趋势,PEG浓度35%~40%的过程融合率呈下降趋势,当PEG浓度为35%,融合率达到峰值。
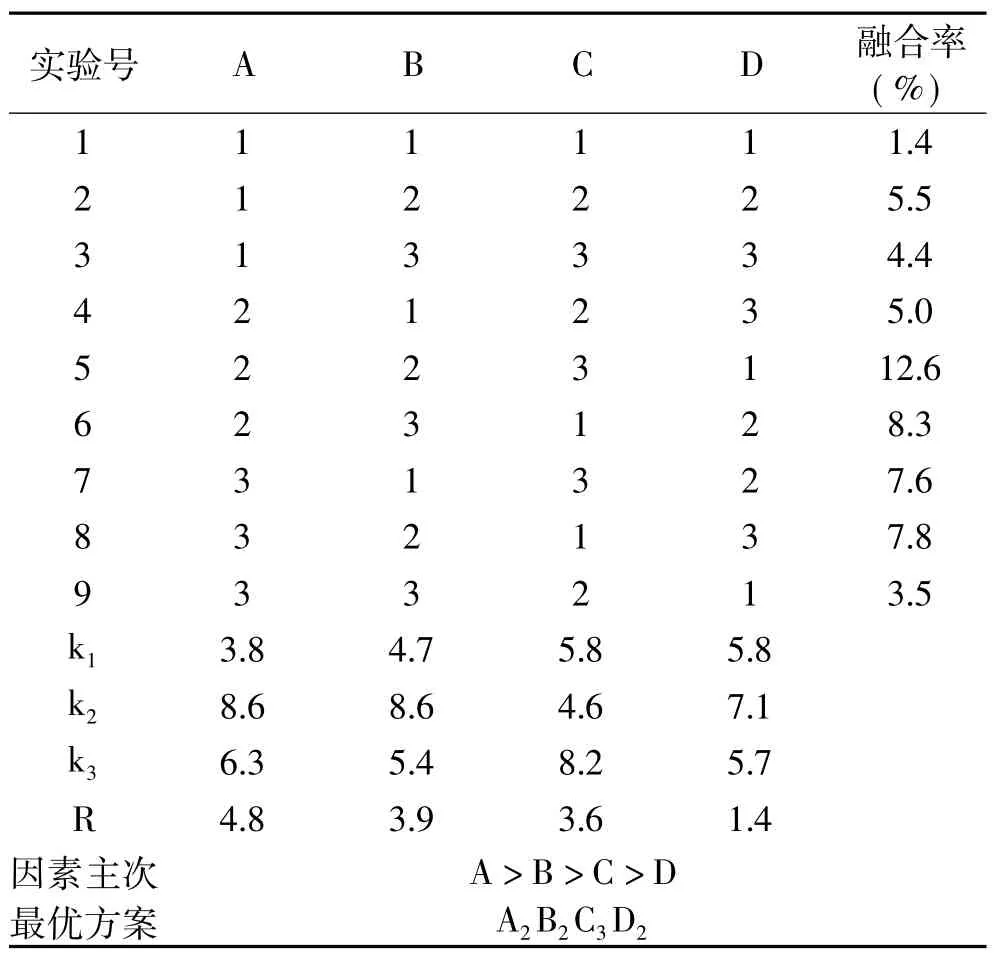
表6 原生质体无性融合条件正交实验Table 6 The orthogonal test results of the asexual fusion condition of protoplasts
2.4 无性融合子的鉴定及其遗传稳定性的初步考察
2.4.1 营养缺陷型鉴定 将诱导融合菌液稀释涂布SD/2二缺培养基,转入酵母菌Y2HGold的BD质粒含有TRP1缺陷筛选基因,AD质粒含有LEU2缺陷筛选基因,因此只有两种缺陷型的菌株完全融合,融合菌株同时含有BD和AD质粒时才能在SD/-Trp/-Leu选择性培养基上生长,菌落生长见图7。
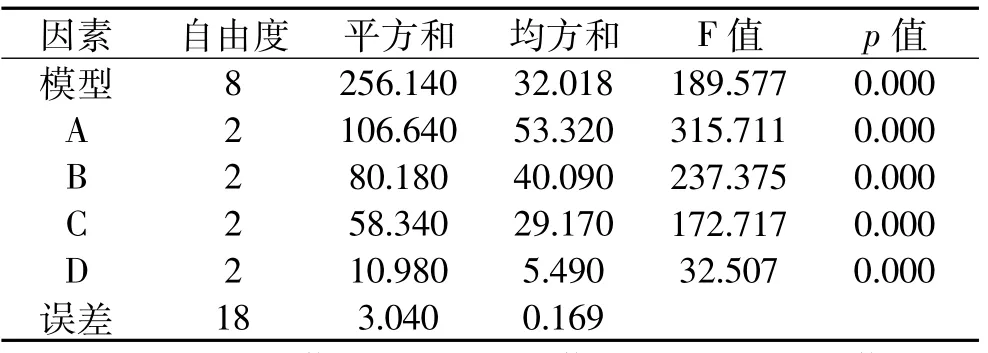
表7 表6正交结果方差分析表Table 7 The Table 6’s variance analysis

图7 融合子菌落图Fig.7 Colony picture of the fusant
2.4.2 形态学鉴定 从二缺平板(SD/2)上挑取菌落体积大小介于亲本菌落与亲本二倍体体积大小之间的菌落单克隆隔天传代培养,经过传代培养10次以上,淘汰掉异核融合等各种假融合子,能够稳定生长的为二倍体或多倍体融合子,用显微镜观察,视野里出现较多的哑铃型细胞结构,在视野中以三维立体“三叶草”结构旋转,由此再次判定相同接合型的菌株原生质体发生了融合,结果见图8。其中两个细胞的融合结构占绝大多数,三个细胞的融合结构较少,还有极少数三个细胞以上的融合结构。由图8可知大部分细胞融合比较彻底,两个亲本细胞变小成为芽体而子细胞居中且较大。
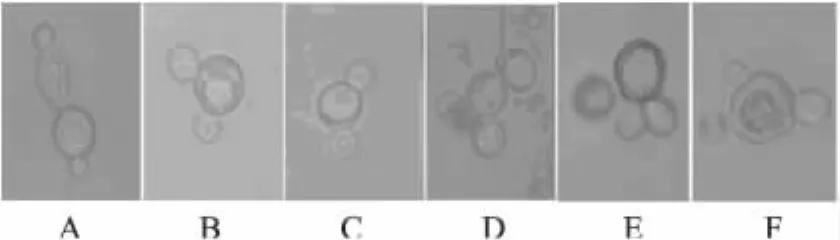
图8 融合子镜检图(×100)Fig.8 Microscopic examination graph of the protoplast after fusion
3 结论与讨论
3.1 遗传标记
本实验根据酵母双杂交工程菌Y2HGold基因结构特点,成功构建了亮氨基酸、色氨酸缺陷型菌株,避免了运用其他标记方法带来的不便与缺陷,解决了筛选缺陷型菌株工作量大、效率低等问题。
3.2 原生质体的制备和融合方案
Y2HGold原生质体最佳制备方案:酶解温度30℃,处理时间80m in、预处理剂含0.1%(w/v)巯基乙醇和 0.1%(w/v)EDTA-2Na,酶解液为 1.5% (w/v)蜗牛酶和1.5%(w/v)纤维素酶;Y2HGold无性融合最佳条件为:PEG浓度35%、温度25℃、时间40m in、pH5.8。
3.3 无性融合与有性融合区别
挑取SD/2筛选培养基上培养的同种接合型的融合菌株与有性条件得到的二倍体菌株(见图9)进行比较,从融合菌株的显微结构上看得到无性融合子“三叶草”结构图中的子细胞较有性融合子的子细胞普遍偏大、母细胞偏小,而有性融合子的子细胞与母细胞大小相当,这说明在融合子形态上表现为无性融合比有性融合可能更为彻底;在时间上无性融合可以在短短的40min内融合,有性融合则需要20~24h,但在培养过程中无性融合子在SD/2培养基上生长缓慢、周期偏长,这说明aa和αα跟aα相比具有生长劣势。

图9 酵母双杂交工程菌Y187与Y2HGold的有性融合子(×100)Fig.9 Microscopic examination graph of the MatchmakerTM Gold Yeast Two-Hybrid System strain Y187 and Y2HGold sexual fusant
综上,本实验初步说明了同种接合型酵母菌株无性融合的可能性及融合条件,为探索酵母无性融合的潜在应用价值、解决接合型的限制及有性融合时因不同菌株生长周期不同而带来不便等问题提供了一定的理论及实践依据。
[1]Zhang M,Bennett D,Erdman SE.Maintenance ofmating cell integrity requires the adhesin Fig2p[J].Eukaryot Cell,2002(1): 811-822.
[2]Dranginis AM,Rauceo JR,Coronado JE,et al.A biochemical guide to yeast adhesins:glycoproteins for social and antisocial occasions[J].Microbiol Mol Biol Rev,2007,71:282-294.
[3]黎永学,张德纯,李代昆.双歧杆菌和酿酒酵母原生质体融合子[J].食品科学,2006,27(2):84-86.
[4]李灿明,黄时海,张云开,等.灭活原生质体融合技术提高豆鼓纤溶酶菌产酶量[J].食品工业科技,2009,30(8): 140-142.
[5]王燕,张文学,郭宏成.酒精发酵酵母与产黄酮类色素酵母原生质体融合研究[J].中国酿造,2010,214(1):68-70.
[6]李英军,马晓燕,赵红梅,等.马克斯克鲁维酵母原生质体制备和再生条件的研究[J].酿酒科技,2006,145(7):51-54.
[7]范秀容,沈萍.微生物学实验[M].第二版.北京:高等教育出版社,1991:64-65,257.
[8]彭帮柱,岳田利,袁亚宏,等.酵母菌原生质体融合技术[J].西北农业学报,2004,13(1):101-103.
[9]孙传宝,朱春宝,许文思.产黄青霉原生质体制备和再生影响因子分析[J].中国抗生素杂志,2001,26(4):241-244.
[10]Ruiz-Herrera J,Ortiz-Castellanos L.Analysis of the phylogenetic relationships and evolution of the cell walls from yeast and fungi[J].FEMSYeast Res,2009(10):225-243.
[11]Sharifmoghadam MR, Valdivieso MH. The Schizosaccharomyces pombe Map4 adhesin is a glycoprotein that can be extracted from the cell wall with alkali but not withβglucanases and requires the C-terminal DIPSY domain for function[J].Mol Microbiol,2008,69:1476-1490.
[12]庞小燕,王吉瑛,赵凤生,等.构建直接发酵淀粉产生酒精的酵母融合菌株的研究[J].生物工程学报,2001,17(2): 166-167.
[13]Gune,N,A Ta waru.Genetic analysis of products of protoplast fusion in Saccharomyces cerevisiae[J].Jpn J Genet,1978,53:41-49.
Protoplast fusion between the same mating type strains of Y2HGold
CHANG Deng-long,HONG Yu,YANG Yong-jun,ZHANG He-cui,XUE Li-yan,YANG Kun,ZHU Li-quan*,WANG Xiao-jia
(College of Agronomy and Biotechnology Southwestern University,Chongqing 400715,China)
In order to avoid the lim itations of sexual fusion and find out the potential value of asexual fusion between yeast strains of same m ating type,the MatchmakerTMGold Yeast Two-Hyb rid System strain Y2HGold were chosen as the material,using the p lasm id,the leucine-deficient and tryp tophan-deficient strains of Y2HGold were successfully constructed;using orthogonal test w ith four factors and three levels by enzymolysis method,the p reparation p rotocolof deficient-bacteria p rotop lasts was conc luded as:enzymolysis tem perature of 30℃,80m in p rocessing tim e,p re-treatment agent containing 0.1%(w/v)mercap toethanol and 0.1%(w/v)EDTA-2Na,hyd rolyzate a m ixture of 1.5%(w/v)and 1.5%snail enzyme(w/v)cellulase,rendering the p rotop last p reparation and regeneration rate 82%and 37%respec tively.Finally,using PEG-induced fusion m ethod and the same orthogonal test,we ob tained the requirem ents about asexual fusion of Y2HGold:35% PEG concentration,temperature as 25℃ and 40m in and pH5.8.Sub-c lones we selected were genetically stab le.
yeast;p rotop last;asexual fusion;asexual fusion strains
TS201.3
A
1002-0306(2012)12-0233-06
2011-09-09 *通讯联系人
常登龙(1985-),男,硕士研究生,研究方向:生物化学与分子生物学。
重庆市自然基金重点项目(cstc2012jjB80010);国家自然科学基金项目(30971849);国家大学生创新计划项目(091063509)。

