PPARγ激动剂对急性坏死性胰腺炎大鼠p38MAPK活化的影响
李清华 徐萍 王静 姜景平 陈令全
PPARγ激动剂对急性坏死性胰腺炎大鼠p38MAPK活化的影响
李清华 徐萍 王静 姜景平 陈令全
p38丝裂原活化蛋白激酶(p38MAPK)在炎症反应中通过调节炎症因子表达起重要作用[1]。我们前期研究发现,过氧化酶体增殖物激活受体γ(peroxisome proliferator-activated receptorsγ,PPARγ)激动剂吡格列酮对急性坏死性胰腺炎(ANP)大鼠血清促炎细胞因子有抑制作用。本研究探讨p38 MAPK在ANP发生、发展中的作用及吡格列酮对p38 MAPK的影响,进一步了解PPARγ激动剂的抗炎机制。
一、材料与方法
1.实验动物及分组:54只雄性SD大鼠,清洁级,体重160~200 g,购自南昌大学医学院动物实验中心。按数字表法随机分成对照组、ANP组及吡格列酮干预组(干预组),每组18只。采用胰管逆行注射50 g/L牛磺胆酸钠(Sigma公司)1 μl/g体重的方法制备ANP模型。对照组开腹后只翻动胰腺并以钝器轻划胰腺3次后关腹。干预组在术后立即腹腔内注射10% DMSO-吡格列酮溶液50 mg/kg体重。术后3、6、12 h分批经腹主动脉放血处死大鼠, 观察胰腺大体病理改变,并取胰头部组织,部分用40 g/L中性甲醛固定,部分置液氮保存。
2.胰腺病理检查:胰腺大体病理观察采用Hughes等[2]标准,从水肿、出血、脂肪坏死3个方面进行评分。福尔马林固定标本常规石蜡包埋、切片、HE染色,光镜下每张切片随机选择5个高倍视野观察胰腺组织病理学变化,并依据Schmidt等[3]标准从水肿、感染、出血和坏死4个方面评分。
3.磷酸化p38MAPK(p-p38MAPK)检测:取冻存标本100 mg,常规提取总蛋白,BCA蛋白浓度分析试剂盒测定蛋白浓度,应用蛋白质印迹法检测p-p38MAPK。p-p38MAPK单克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgM购自Santa cruz公司。用Bandscan图像分析系统扫描目的条带积分灰度值表示其相对表达量。
4.生存率实验:16只雄性SD大鼠随机分成ANP组和干预组,造模方法同上。干预组大鼠术后每12 h重复给予吡格列酮 50 mg/kg体重,ANP组给予10% DMSO,观察两组大鼠制模后60 h的生存率。
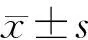
二、结果
1.胰腺病理改变:对照组大鼠胰腺眼观呈淡粉红色,薄片状,颜色均匀一致,光泽度好;ANP组在注射后沿胰胆管周围组织立即充血、水肿,并逐渐扩展;干预组大鼠大体改变与ANP组相似,但病变程度较同时点ANP组轻。胰腺大体病理评分见表1。干预组6、12 h时的胰腺损伤较同时点ANP组显著减轻(P值为0.02483、0.04126)。镜下见对照组胰腺无明显病理改变;ANP组胰腺明显水肿,小叶间隔增大,间质内充斥大量淡红色水肿液,部分腺泡呈孤岛状,并可见大片出血坏死,腺泡小叶结构被破坏,松散、紊乱,胰腺实质及间质内见大量嗜中性粒细胞及单核细胞等炎症细胞浸润;干预组镜下表现与ANP组大体相似,但病变程度较轻(图1)。胰腺病理组织学评分见表1。ANP组和干预组的胰腺病理评分均显著高于对照组;但干预组12、24 h时的病理评分较同时点ANP组显著降低(P=0.00328)。

表1 3组大鼠胰腺大体及组织学评分
注:与对照组比较,aP<0.05;与ANP组比较,bP<0.05

图1对照组(a)、ANP组(b)、干预组(c)大鼠6 h时的胰腺病理组织学变化(×200)
2.胰腺组织p-p38MAPK水平:对照组胰腺低表达p-p38MAPK;ANP组p-p38MAPK表达在造模后3 h即上升到峰值,12 h时的表达水平明显下降,但仍然显著高于对照组(P=0.02386);干预组p-p38MAPK表达均显著高于对照组,但6 h时的表达显著低于ANP组(P=0.04126,表2,图2)。

表2 3组大鼠胰腺组织p-p38MAPK的表达
注:与对照组比较,aP<0.05;与ANP组比较,bP<0.05

图2 对照组、ANP组、干预组大鼠胰腺组织p-p38MAPK的表达
3.大鼠生存率:ANP组大鼠造模后12 h死亡3只,24、36、48 h各死亡1只,60 h的生存率为12.5%;干预组造模后24 h死亡1只,36、48 h各死亡2只,60 h生存率为37.5%,两组差异无统计学意义(P=0.248)。
讨论各种炎症因子(TNF-α、IL-1β、IL-6)和损伤刺激都可造成p38MAPK信号系统的激活,从而调控下游基因包括TNF-α、IL-6等的表达,并促进中性粒细胞的呼吸爆发[4]。p38MAPK信号转导通路参与维持细胞的基础生理状态,因此,正常胰腺腺泡细胞有其低表达[5]。Blinman等[6]研究显示,p38MAPK在调节胰腺腺泡细胞的细胞因子和趋化因子产生的信号通路中占主导地位,在重症急性胰腺炎发病早期及疾病进展中起重要推动作用。Ren等[7]报道,牛磺胆酸钠诱导的ANP大鼠在造模后3 h p38MAPK活性迅速达到峰值,24 h时仍明显高于基础活性。本结果显示,造模后3 h,磷酸化的p38MAPK表达即达到峰值,并维持在较高水平,12 h时仍高于对照组水平,提示在ANP发病早期p38MAPK即参与炎症反应。与Ren等的研究结果一致。
p38MAPK和NF-κB是调节胰腺腺泡细胞产生细胞因子和趋化因子的两条重要信号通路。Jiang等[8]及Ricote等[9]报道,PPARγ激动剂能通过抑制NF-κB而调节炎症反应。我们的前期研究也证实了PPARγ激动剂吡格咧酮可通过抑制NF-κB活化及抑制促炎细胞因子的表达而减轻胰腺炎症[10]。本结果显示,给予吡格咧酮可明显抑制p38MAPK的活化,减轻ANP大鼠的胰腺病理损伤,明显提高ANP大鼠生存率,提示PPARγ激动剂干预处理可能是早期控制SAP病情的有效手段。
[1] Dong C, Davis RJ, Flavell RA. MAP kinases in the immune response. Annu Rev Immunol, 2002, 20:55-72.
[2] Hughes CB, Grewal HP, Gaber LW, et al. Anti-TNF-alpha therapy improves survival and ameliorates the pathophysiologic saquelae in acute pancreatitis in the rat.Am J Surg, 1996, 171:274-280.
[3] Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg, 1992,215:44-56.
[4] Schieven GL. The biology of p38 kinase: a central role in inflammation. Curr Top Med Chem, 2005, 5:921-928.
[5] Wilson PG, Manji M, Neoptolemons JP. Acute pancreatitis as a model of sepsis. J Antimicrob Chemother, 1998,41:51-63.
[6] Blinman TA, Gukovsky I, Mouria M, et al.Activation of pancreatic acinar cells on isolation from tissue cytokine up regulation via p38 MAP kinase. Am J Physiol Cell Physiol,2000,279:1993-2003.
[7] Ren HB, Li ZS, Xu GM, et al. Dynamic changes of mitogen-activated protein kinase signal transduction in rats with severe acute pancreatitis.Chin J Dig Dis,2004,5:123-125.
[8] Jiang C, Ting AT, Seed B. PPAR-gamma agonists inhibit production of monocyte inflammatory cytokines. Nature, 1998,391:82-86.
[9] Ricote M, Li AC, Willson TM, et al. The peroxisome proliferator-activated receptor-gamma is a negative regulator of macrophage activation. Nature, 1998, 391:79-82.
[10] Xu P, Zhou XJ, Chen LQ, et al. Pioglitazone attenuates the severity of sodium taurocholate-induced severe acute pancreatitis. World J Gastroenterol, 2007,13:1983-1988.
10.3760/cma.j.issn.1674-1935.2012.03.022
201600 上海,上海交通大学附属第一人民医院松江分院消化内科
徐萍,Email:yfyxp@yahoo.com.cn
2011-10-12)
(本文编辑:屠振兴)

