一种预染色凝胶电泳法的研究
钟睿博 刘雨双 张 萍 刘竟然 赵国芬 张 峰
一种预染色凝胶电泳法的研究
钟睿博 刘雨双 张 萍 刘竟然 赵国芬 张 峰
(内蒙古农业大学生命科学学院 呼和浩特 010018)
凝胶电泳是常用的生化分离鉴定技术。生物分子大多在可见光区完全透明,因此在凝胶电泳之后,需要对凝胶进行染色处理才能观察到结果,而且常规的染色方法一般步骤比较繁琐耗时。本文开发了一种新型的预染色凝胶电泳方法(Pre-Staining Gel Electrophoresis, PSGE),可以直观地显示电泳结果,并简化凝胶电泳操作。利用PSGE成功分析了蛋白质与两性高分子聚合物的共价偶联和物理吸附的效率,展示了PSGE的巨大应用开发潜力。
琼脂糖凝胶电泳,预染色,共价偶联,物理吸附,蛋白质,两性高分子聚合物
凝胶电泳(Gel Electrophoresis)是一类生化实验室通用的分离分析技术。按照电泳所用的介质,有琼脂糖凝胶电泳(Agarose Gel Electrophoresis, AGE)和聚丙烯酰胺凝胶电泳(Polyacrylamide Gel Electrophoresis, PAGE)。在实验中,除了要求被分离的物质带电之外,选择这两种电泳的一般原则是根据被分离物质的分子量或者粒径大小而决定的。一般琼脂糖形成的凝胶胶孔(依赖于凝胶浓度50-200 nm)[1-2]要大于聚丙烯酰胺形成的凝胶的孔径范围[3-4]。像量尺的最小刻度必须小于被测量的物体才能进行测量的道理一样,当被分离/分析分子的粒径与凝胶的孔径大小基本在同一尺度范围时,才能获得最佳的分辨率。所以,通常分子量较大的核酸样品选用琼脂糖凝胶,而分子量较小的蛋白质样品则选用聚丙烯酰胺凝胶。在制备这两种凝胶的过程中,琼脂糖凝胶相对简单,只需要加热后冷却即可,不像聚丙烯酰胺凝胶需要复杂的聚合单体与聚合引发剂等的准确配比,以及由于胶体太软需要另外一种浓缩胶制作加样孔等的复杂制备程序。所以如果能利用琼脂糖替代聚丙烯酰胺的话,可以大大简化实验操作过程。
由于大多数生物分子只在紫外光区域有吸收,而在可见光区域则完全透明,所以用这两种凝胶分离/分析的结果都需要通过选择合适的染料分子(与被分析的分子结合力强过与凝胶本身的结合力)进行染色-脱色的程序[5]。这进一步繁琐了凝胶电泳的操作过程。如果在进行电泳之前将染料分子牢固地结合到被分析的分子上,就可以将此步骤简化,从而提高电泳的效率。本文针对这个问题提出了一个创新的技术——预染色凝胶电泳(Pre-Staining Gel Electrophoresis, PSGE):以考马斯亮蓝(Coomassie Brilliant Blue, CBB)预染牛血清蛋白(Bovine Serum Albumin, BSA)和以胶体金纳米颗粒(Gold Nanoparticles, AuNPs)预染/标记两性高分子聚合物(Amphiphilic Polymer, AP)为例,证实了PSGE法可以直观地分析出BSA与AP的共价偶联效率,并可以实时地观察到其二者的强烈物理吸附作用。
1 材料仪器与方法
1.1 实验方法
1.1.1 AP合成
AP合成的方法参照文献[6-7],简单描述如下:称取2.7 g十二胺溶于100 mL四氢呋喃(THF)。称取3.084 g聚异丁烯马来酸酐放入圆底烧瓶中,将十二胺溶液倒入其中与聚异丁烯马来酸酐混合,超声处理使溶液变澄清,然后置于55-60 °C水浴搅拌1h,将THF蒸发使溶液浓缩到30-40 mL,此步是为了增强马来酸酐环与十二胺氨基间的酰胺键生成效率。浓缩后的溶液在室温下搅拌过夜,次日通过抽真空将溶液完全蒸干,加入40 mL氯仿搅拌,使瓶底附着的AP完全溶解。最终所得AP(图1(b))结构单元的浓度Cmonomer为0.5 mol·L-1。由于之后的应用都在水溶液中,因此取100 μL AP将氯仿抽干,加入5 mL硼酸钠缓冲液(pH=12),剧烈搅拌,使AP完全溶解至一个透明澄清的溶液,所得AP单元结构的浓度Cmonomer=0.01 mol·L-1。一条AP分子约有40个结构单元,因此AP的浓度Cpolymer= 250μmol·L-1。
1.1.2 AuNP标记AP
标记的方法参照文献[6-8]。简要叙述如下:AuNP为实验室自制的分散在有机溶剂中的疏水纳米金颗粒。AuNP利用疏水作用标记AP。AuNP的有效表面积为:

式中,deff为AuNP的有效直径,约5 nm。
按AuNP有效表面积每平方纳米加200个AP单体单元的比例将AuNP与AP混合,抽真空使有机溶剂氯仿挥发直到混合物完全干燥。加入硼酸钠缓冲液(50 mmol·L-1,pH=12)剧烈搅拌使溶液变澄清。这样AuNP就标记了AP。用2%琼脂糖凝胶,40 V·cm-1电压跑胶1 h,通过切胶回收去掉多余的未被AuNP标记的AP。
1.1.3 BSA与AP的共价偶联反应
取PCR管编号1-12,首先在每个PCR管中加入10 μL超纯水,取10 μL EDC储存液加到12号PCR管中混匀。从12号PCR管中取出10 μL加入11号PCR管中混匀,再从11号PCR管中取出10 μL加入到10号管中混匀。以此类推,重复操作直到最后从1号PCR管中取出10 μL弃掉。12-1号管中EDC浓度依次被稀释了一倍。再分别加入10 μL AP (AP:BSA=1:500)或10 μL AuNP标记的AP与BSA混匀(AuNP:AP:BSA=1:25:500),加入超纯水将最终反应体系固定为30μL。室温下反应3 h。AP与BSA利用1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-ethyl-3-(3-dimethyl aminopropyl) carbodiimide hydrochloride, EDC)共价偶联反应的分子数配比见表1。
1.1.4 BSA与AP的物理吸附反应
取PCR管编号1-12,首先在每个PCR管中加入10 μL超纯水,取10 μL BSA储存液加到12号PCR管中混匀。从12号PCR管中取出10 μL加入11号PCR管中混匀,再从11号PCR管中取出10 μL加入到10号管中混匀。以此类推,重复操作直到最后从1号PCR管中取出10 μL弃掉。12-1号管中BSA的分子数依次被减少了一倍。再分别加入10μL AP(AP=1)或AuNP标记的AP (AuNP:AP= 1:25)与BSA混匀,加入超纯水将最终反应体系固定为30 μL。室温下反应30min。AP与BSA直接物理吸附反应的分子数配比见表2。
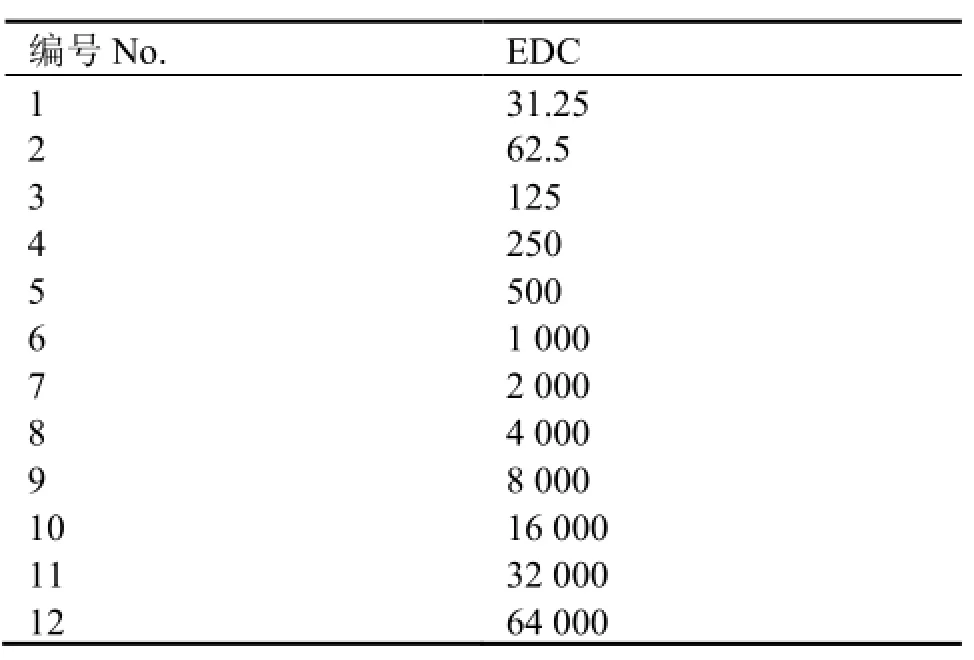
表1 AP与BSA利用EDC共价偶联反应的分子数配比Table 1 Molar ratio of AP to BSA in EDC reaction.
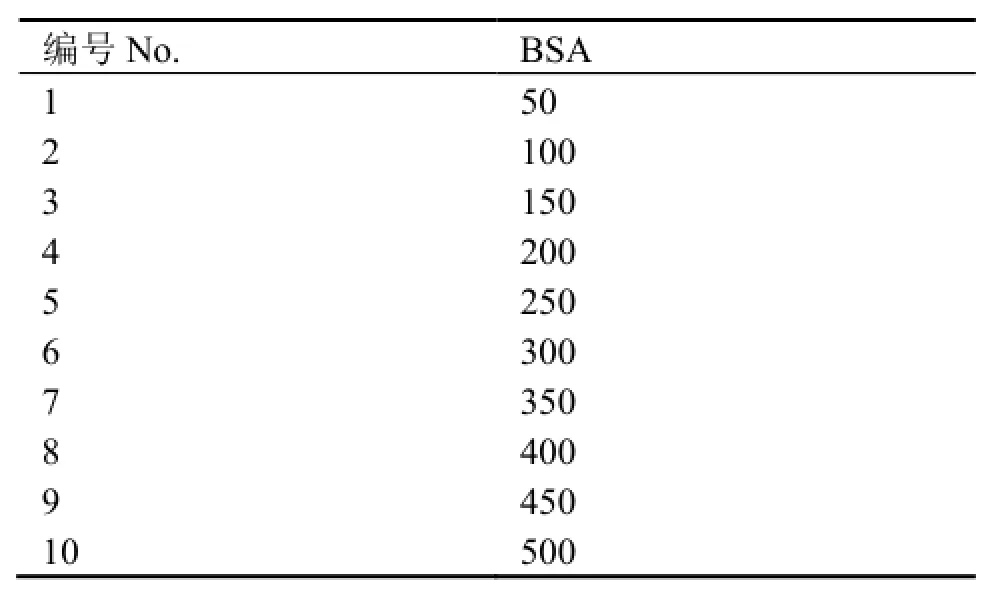
表2 AP与BSA直接物理吸附反应的分子数配比Table 2 Molar ratio of AP to BSA in the physical absorption experiments.
1.1.5 琼脂糖凝胶水平电泳
所有样品在电泳上样前,加入10 μL CBB上样缓冲液,混匀静置30 min,让CBB与BSA充分结合。之后用2%的琼脂糖凝胶,0.5倍Tris-硼酸电泳(Tris/Borate/EDTA, TBE)缓冲液,40 V·cm-1电压下跑胶1h。
2 材料仪器
CBB G-250 (≥80%,国药);琼脂糖(Molecular Biology Grade, Invitrogen);BSA (≥98%,Amresco);本实验中其它药品均从Sigma-Aldrich公司购买。实验中所用水一律为超纯水(电导率≥18.2 mΩ,Millipore, Bedford, MA)。CBB储存液配制:0.01 g CBB溶于5 mL超纯水中,再加入5 mL甘油混匀,调节浓度到1.2 mmol·L-1。BSA储存液配制:0.2 g BSA溶于5 mL超纯水中,调节浓度到600 μmol·L-1;共价偶联剂EDC储存液配制:由于EDC易水解,所以采用现用现配,10 mg EDC溶于68.9 mL超纯水中,调节浓度到768 mmol·L-1。实验中所使用的电泳仪是百晶公司的多用途水平电泳仪(BG-subMIDI,35cm×15 cm×10 cm)配备一个百晶公司提供的专用电泳电源(BG-Power 600k)。
3 结果与讨论
从分子结构上看,CBB(图1(a))与AP(图1(b))分子在碱性缓冲液中由于磺酸基(-SO3-)与羧基(-COO-)的充分解离而都带负电荷。CBB之所以能成为一种蛋白质通用的染料[9],是因为在生理缓冲液条件下,虽然大多数蛋白质显示出负电性(这也是蛋白质自身维持其溶液稳定性的保障),但是蛋白质表面的侧链带正电荷的氨基酸残基(如赖氨酸、精氨酸和组氨酸,图2),在局部区域仍然可以与带负电的CBB分子发生静电相互作用。另外,由于CBB分子结构中所含的6个苯环结构可以与蛋白质折叠过程中部分裸露的疏水区域发生疏水相互作用,并与芳香族氨基酸(如苯丙氨酸、酪氨酸和色氨酸)侧链的苯环发生π-π堆积相互作用;这三种弱相互作用一起构成了CBB与蛋白质强烈吸附的驱动力。这种强烈的吸附作用也是本文开发预染色凝胶技术的核心思想。

图1 CBB(a)与AP(b)分子结构示意图。由Chemoffice 2010软件制作,图1(b)只是AP分子的一段:4个单体单元(以马来酸酐环作为一个单体单元来算),一个AP分子平均含有40个单体单元。Fig.1 Molecular structures of CBB (a) and AP (b) produced by Chemoffice 2010. Fig.1(b) only represents a fragment of AP. There are four monomer units (with one anhydride ring as a monomer unit). An AP molecule has an average of 40 monomer units.

图2 BSA分子表面侧链带正电的氨基酸残基分布示意图。由Cn3D软件的Find Pattern功能产生。BSA分子的3D晶体结构来自Pubmed网站提供的Structure功能。亮色标记了带氨基的氨基酸残基:赖氨酸和精氨酸以及带咪唑基的组氨酸残基。(a) 正面,(b) 背面Fig.2 Distribution of positively charged amino acid residues on BSA surface produced by the Find Pattern function of Cn3D software. The 3D crystal structure of BSA obtained from the structure function of Pubmed website. The highlighted regions are amino acid residues with amino group: lysine and arginine, and histidine with imidazole group. (a) Front view, (b) Back view
AP近年来被广泛应用于疏水纳米颗粒以及不溶性生物分子、药物的包裹技术中[10]。通过AP的包裹,疏水的纳米结构、药物分子等可以稳定地溶解在生理缓冲体系中发挥作用,然而由于AP分子的强烈负电性和细胞内及血液中过分拥挤的分子环境[11-13],有时会使得预先设计的纳米结构表面吸附一层生物分子,从而遮盖了原本设计的作用位点。另一方面,有时在一些生物医学工程或者化学化工中需要将一些指定的生物分子链接到AP包裹的纳米结构表面,如基于酶联免疫吸附法的纳米技术通常需要将抗体分子共价或者物理吸附到具有超顺磁性或者高量子产率的AP包裹的纳米结构上[14],药房可以买到的“早孕试纸”便是将抗体吸附到纳米胶体金颗粒表面。基于这两方面的考虑,研究蛋白质分子与AP分子的吸附作用与共价偶联效率将会变得不仅有益,而且还具有普遍性。
为了检测CBB是否能够直接用于PSGE,本文在电泳上样缓冲液中混合了一定比例的CBB,并与即将进行电泳的样品混合30 min,以期CBB与蛋白质(选BSA为例)充分吸附。为使分离效果明显,选用2%的琼脂糖凝胶在40 V·cm-1的TBE缓冲液中跑胶1 h。由于预染色的效果,我们可以在白光下目睹、监视样品的跑胶全过程。同时,如果有问题的话,也可以及时停止或采取相应的措施。这是在以往“后染色”实验中无法体验到的乐趣与便捷。为了让PSGE更有实用价值,设计了一个较复杂的实验,如分别检测BSA与AP的共价偶联效率和直接物理吸附情况。
一般情况下,AP分子在水溶液中会像蛋白质一样将其疏水的部分折叠到内部,而将带电的基团暴露于其表面,从而保持其能量最低状态。然而由于AP分子的主链太短(图1(b),平均只有40个单体),这种情况下,会选择将多个AP分子结合到一起自组装成胶束(图3(a)),这与很多表面活性剂相似。图3(b)中从左到右各条泳道分别为:第1条泳道是纯BSA,从第2条到第13条分别是表1中1-12号PCR管中的样品。图3(c)中从左到右各条泳道分别为:第1条泳道是纯BSA,从第2条到第11条分别是表2中1-10号PCR管中样品;所有图3(b)和(c)中样品都与等量的CBB混合30 min后,加样到2%的琼脂糖凝胶孔中,在40 V·cm-1的电场中跑胶1 h。由图3(b)看出,随着共价偶联试剂EDC的增加,条带越来越滞后,说明BSA与AP的共价偶联与EDC的量成正相关。此块琼脂糖凝胶在电泳后保持非常好的“洁净度”,用来染色的CBB几乎没有非特异的扩散,条带很大程度上可以定性、甚至定量地说明BSA与AP分子的偶联效率,展示出了预染色法的应用开发潜力。
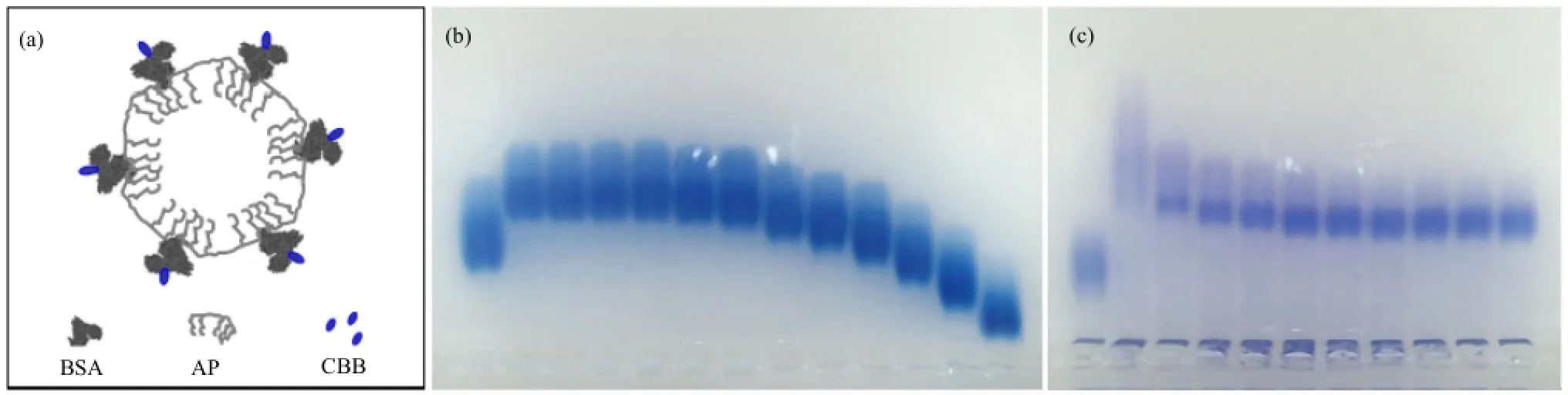
图3 CBB直接染色法检测BSA与AP胶束结合效率(a) BSA与AP胶束偶联后被CBB染色的示意图,(b) BSA与AP胶束利用交联剂EDC共价偶联的电泳结果,(c) BSA与AP胶束直接物理吸附的电泳结果Fig.3 Binding efficiency of BSA and AP detected by CBB pre-staining. (a) Schematic diagram of BSA coupled with AP micelles and pre-stained by CBB, (b) Gel electrophoresis result of BSA coupled with AP by EDC, (c) Gel electrophoresis result of BSA physically absorbing to AP micelles
因为利用CBB主要是针对蛋白质BSA的染色,所以当研究BSA与AP的偶联或者吸附的效率时,并不能同时准确地监控到AP的“行踪”,而同时了解BSA与AP的单体状态也是非常有研究意义的(如对于结合常数的计算是必须的)。为此,我们利用胶体金纳米颗粒(疏水颗粒,直径5 nm)巧妙地标记了AP分子形成的胶束(利用AP分子的包裹性能,如图4(a)所示,包裹了疏水胶体金纳米颗粒),从而可以做到同时定量监视两种反应物质的状态。图4(b)中从左到右各条泳道分别为:第1条泳道是纯CBB,第2条泳道是纯BSA,从第3条到第14条分别是表1中1-12号PCR管中的样品;图4(c)中从左到右各条泳道分别为:第1条泳道是纯CBB,第2条是纯BSA,从第3条到第14条分别是表2中1-10号PCR管中样品;所有图4(b)和(c)中样品都与等量的CBB混合30 min后,加样到2%的琼脂糖凝胶孔中,在40 V·cm-1电场中跑胶1 h。如图4(b)所示,如果光看第4-11条泳道的深色(CBB染色的BSA)形状,几乎与图3(b)中第2-13条泳道所显示的完全一样,一定程度上说明了AuNP对AP的物理法标记并没有改变AP与BSA的相互作用。然而,如果我们只看AuNP显示出的虚线框注的浅色,即可追踪到AP分子的状态:从图4(b)的第4-11条泳道可以看出,随着交联剂EDC分子数的增加,由开始的自由的AP胶束和自由的BSA,逐渐发展到AP胶束与BSA共价偶联到一起,由于复合物的粒径变大,电荷减少,所以最终表现出条带越来越滞后的现象。

图4 AuNP标记AP胶束检测CBB直接染色法的可行性(a) BSA与AuNP标记的AP偶联后被CBB染色的示意图,(b) BSA与AuNP标记的AP胶束利用交联剂EDC共价偶联的电泳结果,(c) BSA与AuNP标记的AP胶束直接物理吸附的电泳结果。虚线框内的浅色是AuNPs。Fig.4 Feasibility of CBB pre-staining checked by AuNP-labeled AP micelles. (a) Schematic diagram of binding BSA with AuNP-labeled AP and pre-stained by CBB, (b) Gel electrophoresis result of BSA coupled with AuNP-labeled AP micelles by EDC, (c) Gel electrophoresis result of BSA physically absorbing to AuNP-labeled AP micelles. The light color outlined by dotted line are AuNPs.
需要补充说明的是,图3(b)中每个条带都有一个上部的“拖尾”,这个拖尾几乎让条带展宽了一倍,我们知道这对于高分辨分析不利,所以有必要研究一下原因。首先想到的是CBB分子过饱和吸附导致部分CBB分子吸附作用太弱,在跑胶过程中脱离了BSA分子。对比图3(b)的第1泳道、图3(c)的第1泳道、图4(b)的第2泳道、图4(c)的第2泳道,不难发现这个理论可以解释以上现象,因为在这几块电泳中逐渐降低了CBB分子的浓度,使得其避免了过饱和效应导致的减弱结合力的效应,从而在图4(b)、(c)中几乎看不到拖尾现象。同时,另外一个可能就是AP分子的疏水性也会与CBB有相互吸附的可能性。即便如此,从图4(b)也可以得出,CBB与AuNP标记的AP胶束吸附作用远低于CBB与BSA的吸附作用,图4(c)更清楚地佐证了CBB与BSA的吸附作用远大于其与AP胶束的吸附作用。换句话说,当有BSA存在的情况下,CBB与AuNP标记的AP的吸附作用可以忽略不考虑,这点对于两种物质以上的反应体系的实时监测具有重要应用开发价值。
为了进一步证实预染色法的应用潜力,设计了利用此法监控BSA与AP胶束的物理吸附作用。如图3(c)所示,从第2-11条泳道可以看出,随着BSA分子数的增加,深色的CBB逐渐被滞后,这是由于越来越多的BSA分子吸附到了AP胶束表面导致整个复合物尺度变大而造成的。然而,如果没有图4(c)的对比辅助分析,也许还不了解自由的AP胶束的状态。通过对比图3(c)与图4(c),同样发现如果只看深色(不带虚线框)的标记所形成的形状,几乎完全相同;进一步说明了AuNP对自由AP胶束的标记只是一种物理标记,并不会影响其表面的化学吸附性能;而这种分别标记的方法却可以清晰地为我们展现出吸附反应的进行状态,也进一步显示出CBB与AuNP对BSA和AP的染色互相没有交叉污染的现象,这点更显示出这种前双染色法比前单染色法具有更高的应用开发价值。
4 结语
本文开发了一种预染色方法,并证实了此法不仅可以代替常规的后染色法,而且还通过展示其在分析蛋白质与两性高分子聚合物共价偶联与物理吸附反应中的可行性、便捷性及实时监控性等特点,充分说明了预染色法的巨大应用潜力及开发价值。需要强调的是,通过前双染色法与单染色法的对比,我们意识到这不仅是一种强大的研究手段,而且PSGE可以在不改变被分析/分离物的生化活性的前提下,实现通过物理作用介导的强结合力的染色效果。我们也期望本文所采用的AuNP标记AP胶束的技术能对相关领域的科学家有“逆向思维”的启发性。最后希望预染色技术在不久的将来可以扩展应用到其它检测、分析技术领域如层析技术。
1 Serwer P. Agarose gels: properties and use for electrophoresis[J]. Electrophoresis, 1983, 4(6): 375-382
2 Pernodet N, Maaloum M, Tinland B. Pore size of agarose gels by atomic force microscopy[J]. Electrophoresis, 1997, 18(1): 55-58
3 Holmes D L, Stellwagen N C. Estimation of polyacrylamide gel pore size from Ferguson plots of linear DNA fragments. II. comparison of gels with different crosslinker concentrations, added agarose and added linear polyacrylamide[J]. Electrophoresis, 1991, 12(9): 612-619
4 Zimm B H, Levene S D. Problems and prospects in the theory of gel electrophoresis of DNA[J]. Quarterly Reviews of Biophysics, 1992, 25(2): 171-204
5 Syrovy I, Hodny Z. Staining and quantification of proteins separated by polyacrylamide gel electrophoresis[J]. Journal of Chromatography, 1991, 569(1-2): 175-196
6 Zhang F, Lees E, Amin F, et al. Polymer-coated nanoparticles: a universal tool for biolabelling experiments[J]. Small, 2011, 7(22): 3113-3127
7 Lin C A J, Sperling R A, Li J K, et al. Design of an amphiphilic polymer for nanoparticle coating and functionalization[J]. Small, 2008, 4(3): 334-341
8 Yakovlev A V, Zhang F, Zulqurnain A, et al. Wrapping nanocrystals with an amphiphilic polymer preloaded with fixed amounts of fluorophore generates FRET-based nanoprobes with a controlled donor/acceptor ratio[J]. Langmuir, 2009, 25(5): 3232-3239
9 Georgiou C, Grintzalis K, Zervoudakis G, et al. Mechanism of coomassie brilliant blue G-250 binding to proteins: a hydrophobic assay for nanogram quantities of proteins[J]. Analytical and Bioanalytical Chemistry, 2008, 391(1): 391-403
10 Alexandridis P. Amphiphilic copolymers and their applications[J]. Current Opinion in Colloid & Interface Science, 1996, 1(4): 490-501
11 Okano T, Nishiyama S, Shinohara I, et al. Effect of hydrophilic and hydrophobic microdomains on mode of interaction between block polymer and blood platelets[J]. Journal of Biomedical Materials Research, 1981, 15(3): 393-402
12 Freij-Larsson C, Nylander T, Jannasch P, et al. Adsorption behaviour of amphiphilic polymers at hydrophobic surfaces: effects on protein adsorption[J]. Biomaterials, 1996, 17(22): 2199-2207
13 Baszkin A, Lyman D J. The interaction of plasma proteins with polymers. I. relationship between polymer surface energy and protein adsorption/desorption[J]. Journal of Biomedical Materials Research, 1980, 14(4): 393-403
14 Shim W B, Yang Z Y, Kim J Y, et al. Immunochromatography using colloidal gold-antibody probe for the detection of atrazine in water samples[J]. Journal of Agricultural and Food Chemistry, 2006, 54(26): 9728-9734
CLC TL271+.99
Research on pre-staining gel electrophoresis
ZHONG Ruibo LIU Yushuang ZHANG Ping LIU Jingran ZHAO Guofen ZHANG Feng
(College of Life Science, Inner Mongolia Agricultural University, Huhhot 010018, China)
Background: Gel electrophoresis is a powerful biochemical separation technique. Most biological molecules are completely transparent in the visible region of light, so it is necessary to use staining to show the results after gel electrophoresis, and the general steps of conventional staining methods are time-consuming. Purpose: We try to develop a novel approach to simplify the gel electrophoresis: Pre-Staining Gel Electrophoresis (PSGE), which can make the gel electrophoresis results monitored in real time. Methods: Pre-stain the protein samples with Coomassie Brilliant Blue (CBB) for 30 min before loading the sample into the gel well. Results and Conclusion: PSGE can be successfully used to analyze the binding efficiency of Bovine Serum Albumin (BSA) and amphiphilic polymer via chemical coupling and physical absorption, and the double PSGE also shows a great potential in bio-analytical chemistry.
Gel electrophoresis, Pre-staining, Covalent coupling, Physical absorption, Protein, Amphiphilic polymer
TL271+.99
10.11889/j.0253-3219.2014.hjs.37.070501
国家自然科学基金项目(No.21171086、No.81160213)、内蒙古自治区草原英才工程项目(No.108-108038)、内蒙古自治区自然科学基金项目
(No.2013MS1121、No.211-202060)资助
钟睿博,女,1987年出生,2009年毕业于内蒙古农业大学生命科学学院,现为硕士研究生
赵国芬,E-mail: guofenzhao@126.com;张峰,E-mail: fengzhanng1978@hotmail.com
2014-04-15,
2014-04-22

