三氧化二砷对人脑胶质瘤SHG44细胞增殖的抑制作用*
黄辉,蒋宏玲,刘芬菊,白雪,何卓凯,蔡锐,张荣君,赵博,刘美莲
(1.桂林医学院附属医院放疗科,桂林 541001;2.桂林医学院附属医院康复科,桂林 541001;3.苏州大学放射医学与公共卫生学院,苏州 215007)
·抗肿瘤药物专栏·
三氧化二砷对人脑胶质瘤SHG44细胞增殖的抑制作用*
黄辉1,蒋宏玲2,刘芬菊3,白雪1,何卓凯1,蔡锐1,张荣君1,赵博1,刘美莲1
(1.桂林医学院附属医院放疗科,桂林 541001;2.桂林医学院附属医院康复科,桂林 541001;3.苏州大学放射医学与公共卫生学院,苏州 215007)
目的 探讨三氧化二砷(As2O3)对人脑胶质瘤SHG44细胞增殖的抑制作用及其作用机制。方法采用噻唑蓝(MTT)法观察As2O3对SHG44细胞的增殖抑制率;激光共聚焦显微镜检测As2O3作用于SHG44细胞后细胞内活性氧自由基(ROS)水平变化。结果As2O3对SHG44细胞增殖具有明显抑制作用,随着As2O3浓度的升高和作用时间的延长,细胞的增殖抑制率升高,12μmol·L-1As2O3对SHG44细胞增殖的抑制率可达63.8%;As2O3可以明显提高SHG44细胞内ROS水平,其ROS水平随As2O3作用浓度的增高明显增高,具有浓度依赖关系。结论As2O3能明显抑制SHG44细胞的增殖,抑制作用呈现剂量依赖性和时间依赖性,其机制与升高细胞内活性氧水平有关。
三氧化二砷;胶质瘤;SHG44细胞;抑制作用
三氧化二砷(As2O3)是砒霜的有效成分,对急性早幼粒细胞白血病的疗效已得到肯定[1-2]。近年来临床医学研究发现中药砷剂具有广泛的抗癌谱,并且不良反应少,As2O3对实体瘤,如结肠癌、肝癌等也有诱导凋亡和抑制生长作用[3-4]。笔者在本研究中探讨了As2O3对人脑胶质瘤SHG44细胞体外增殖的影响,同时探讨其可能的作用机制,为其临床应用提供实验基础。
1 材料与方法
1.1 材料与仪器 激光共聚焦显微镜(TCS-SP2型, Leica Co,Germany);倒置显微镜(日本Olympus公司);5 mg·mL-1噻唑蓝(thiazolyl blue,MTT)液25 mg,加入磷酸盐缓冲液(phosphate buffered saling,PBS, 0.01 mol·L-1,pH7.4)5 m L搅拌充分溶解后,经孔径0.22μm滤膜过滤除菌,-20℃保存;RPMI 1640培养液(Gibcol):按说明用双蒸水配制,加青霉素、链霉素各100 U·m L-1,碳酸氢钠(NaHCO3)2 g,经孔径0.22μm滤过器除菌,小瓶分装,-20℃储存,临用前加灭活新生小牛血清配成含10%小牛血清的RPMI1640培养液;As2O3,亚砷酸氯化钠注射液(哈尔滨伊达药业有限公司)。10 mL亚砷酸氯化钠注射液含As2O310 mg与氯化钠90 mg。
1.2 细胞培养 SHG44细胞(苏州大学附属第一医院提供)为单层贴壁生长的细胞,培养在含10%新生小牛血清的RPMI 1640培养液、37℃、5%二氧化碳(CO2)饱和湿度孵箱中。
1.3 As2O3对SHG44细胞的增殖抑制作用 参照文献方法[5],取对数生长期细胞加入0.25%胰酶消化,用含10%小牛血清的RPMI 1640培养液,配成5×104个·mL-1细胞悬液,接种于96孔板的6×8孔中,每孔细胞悬液100μL。处理组每孔再加入含不同浓度As2O3完全培养液100μL,使As2O3终浓度分别为1,2,4,6,8, 10,12μmol·L-1,对照组加入等体积10%小牛血清的RPMI 1640培养液,各浓度设6个复孔,37℃、5%CO2孵箱中培养3 d(根据细胞生长曲线实验结果)。取4块96孔板,每板2×6孔加入细胞悬液,每孔细胞0.5×104个,其中每块板1×6孔加入As2O3,终浓度为4μmol·L-1,分别培养1,2,3,4 d后取出。各孔分别加入MTT 20μL,继续培养4 h后吸出培养液,加入二甲亚砜(dimethyl sulfoxide,DMSO)200μL振荡溶解10min,空白对照调零,酶联免疫检测仪上测波长570 nm处吸光度(A)值。计算细胞增殖抑制率,抑制率(%)=[(阴性对照组A值-处理组A值)]/阴性对照组A值]× 100%,绘制细胞增殖抑制曲线。实验重复3次。
1.4 激光共聚焦显微镜检测细胞凋亡 对数生长期SHG44细胞0.25%胰酶消化成单细胞悬液,50 mL培养瓶中传代培养24 h后换液,处理组每瓶加入含不同浓度As2O3和10%小牛血清的RPMI 1640培养液8 mL,使As2O3终浓度分别为2,4,6μmol·L-1,对照组加入等体积10%小牛血清的RPMI 1640培养液,继续培养72 h,每组设3个平行样品。培养终止,0.25%胰酶消化成单细胞悬液,1 000 r·min-1离心5 min,弃上层液,PBS 100μL混匀细胞沉淀,加吖啶橙(acridine orange,AO))/溴化乙啶(ethidium bromide,EB)染液,使终浓度为5μg·mL-1,37℃孵育5~10 min,激光共聚焦显微镜观察细胞染色及形态(AO激发波长488 nm,发射波长500~520 nm;EB激发波长543 nm,发射波长600~700 nm)。
1.5 激光共聚焦显微镜测定 活性氧(reactive oxygen species,ROS)释放:①样品的制备:实验分对照组,1,2,4,6μmol·L-1As2O3处理组,SHG44细胞经0.25%胰蛋白酶消化后制成单细胞悬液,培养于直径25 mm的培养皿中,贴壁2 d,各实验组均换成不含小牛血清的RPMI 1640培养液,其中处理组分别加入As2O3使终浓度为1,2,4,6μmol·L-1,继续培养2 h。②染色:各组分别2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorescin diacetate,DCFH-DA,终浓度为10μmol·L-1)标记细胞,37℃保温30 min。③激光共聚焦显微镜扫描:将培养皿置于激光共聚焦显微镜下观察。检测选用的激发光波长为488 nm,发射光波长为520 nm,用40倍物镜进行观察,利用含有图像处理系统和自动摄像装置选取不同视野拍摄图像,所有扫描图像存入计算机硬盘内以便分析备用。④激光共聚焦显微镜扫描数据处理:利用Leica自带的软件对存入计算机的图片进行荧光强度分析,使用ROI (Region of Interest)功能对细胞发射的荧光单独获得数值,扣除细胞周边的本底荧光数值,每个剂量点选取3个不同视野进行分析,将不同视野的值汇总以进行统计分析。
2 结果
2.1 As2O3对SHG44细胞的增殖抑制作用 各浓度组As2O3对SHG44细胞均有明显增殖抑制作用,抑制率随浓度升高而明显增加,呈现浓度依赖关系,并发现As2O3浓度为1μmol·L-1时,对SHG44细胞抑制作用已十分明显。统计学结果表明,细胞增殖抑制率(Y)与As2O3浓度(X)呈线性相关,回归方程为:Y= 0.056 57X-0.015 3。从回归方程求得本实验条件下, As2O3的半数抑制浓度为9μmol·L-1。见表1。
单因素方差分析:1和2μmol·L-1As2O3组A值比较,P<0.05,其余各组之间A值比较均差异有统计学意义(P<0.01)
应用SPSS13.0版统计软件包以As2O3浓度为自变量(X),增殖抑制率为因变量(Y),进行曲线估计,得出直线方程模型拟合的决定系数为0.989 3,输出的图形与实际数据的趋势吻合。随后进行线性回归分析,系统输出的模型方差分析结果显示模型的P<0. 01,说明回归方程有效,系统输出回归系数为0.056 57,P<0.01,说明方程中As2O3浓度变量差异有统计学意义。回归方程为:Y=5.657×10-2X-1.530×10-2。
从前面实验得出4μmol·L-1As2O3作用于SHG44细胞后,具有明显的增殖抑制作用(P<0.01),故选用此浓度观察As2O3对SHG44细胞的增殖抑制作用的时间依赖关系。结果4μmol·L-1As2O3第1~4天对SHG44细胞的增殖抑制率分别为(5±2)%,(13±2)%,(20± 3)%,(21±4)%。在第1~3天随作用时间的延长,细胞的抑制率逐渐升高,差异有统计学意义(P<0.01)。第4天和第3天抑制率差异无统计学意义,是因为本实验条件下,细胞培养于96孔板中,第3天细胞已贴满板底,生长处于停滞期。实验表明,As2O3对SHG44细胞的增殖抑制作用具有时间依赖关系。
表1 不同浓度As2O3作用后各组MTT吸光度(A)值和SHG44细胞增殖抑制率Tab.1 Absorbance values(A)of MTT and inhibition rate on SHG44 cell proliferation after treatment with different concentrations of As2O3 ±s
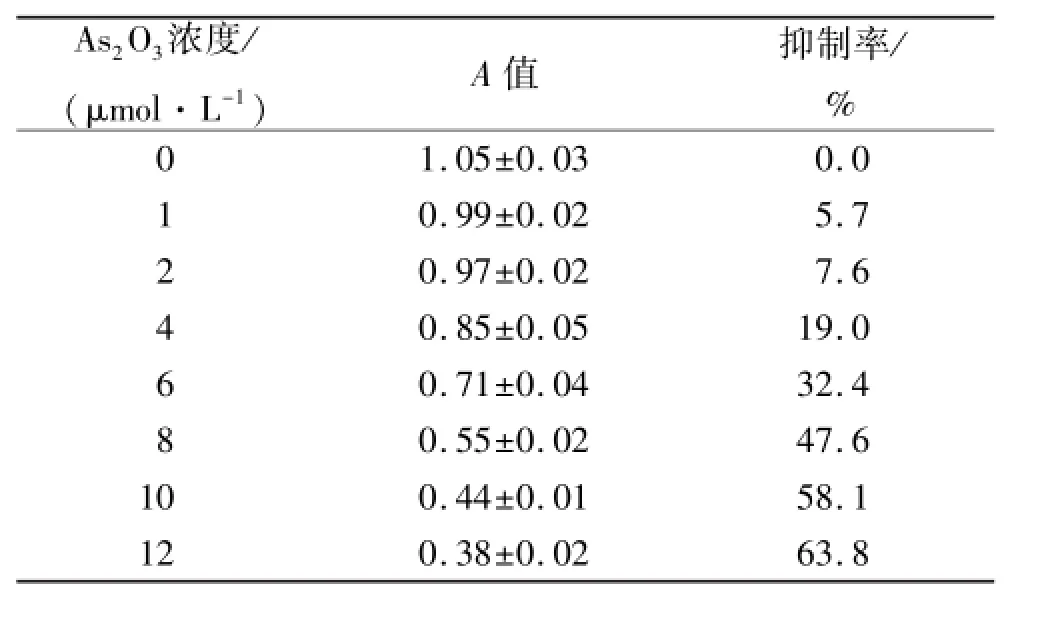
表1 不同浓度As2O3作用后各组MTT吸光度(A)值和SHG44细胞增殖抑制率Tab.1 Absorbance values(A)of MTT and inhibition rate on SHG44 cell proliferation after treatment with different concentrations of As2O3 ±s
As2O3浓度/ (μmol·L-1)A值抑制率/ % 0 1.05±0.03 0.0 1 0.99±0.02 5.7 2 0.97±0.02 7.6 4 0.85±0.05 19.0 6 0.71±0.04 32.4 8 0.55±0.02 47.6 10 0.44±0.01 58.1 12 0.38±0.02 63.8
2.2 激光共聚焦显微镜观察As2O3诱导的细胞凋亡 对照组,2,4,6μmol·L-1As2O3实验组细胞AO/EB染色后激光共聚焦显微镜观察,出现:①对照组大部分为活细胞,核染色质着绿色,核呈正常结构(图1-A);②早期凋亡细胞,核染色质着绿色,胞核呈固缩状或碎裂状(图1-B);③中期凋亡细胞,核染色质着黄绿色,胞核呈固缩状或碎裂状(图1-C);④晚期凋亡细胞,核染色质着橘红色,胞核呈固缩状或碎裂状(图1-D);⑤坏死细胞,核染色质着橘红色,胞核结构正常(图1-D)。
2.3 As2O3提高SHG44细胞内ROS水平 细胞内ROS测定参照方法[6]进行,DCFH-DA自由扩散进入细胞后被酯酶催化变成DCFH,在ROS存在下被氧化成DCF, DCF荧光强度与细胞内ROS水平呈正比。细胞经0,1, 2,4,6μmol·L-1As2O3处理后,SHG44细胞内荧光强度值分别为51.41±4.83,85.06±9.86,149.98±10.03, 188.33±10.65,244.47±6.46。细胞内荧光强度反映细胞内ROS水平。可以看出,细胞内的ROS水平与As2O3在0~6μmol·L-1的浓度内有明确的浓度依赖关系, ROS的含量随As2O3作用浓度的增高明显增高,对照组和各作用组及各作用组间比较,差异均具有统计学意义(图2:细胞内荧光强度随As2O3作用浓度的增高明显增强)。
3 讨论
As2O3是中药砒霜的主要成分,砷与蛋白质氨基酸中的巯基具有强效的亲和性,可直接影响细胞内许多蛋白质的功能。As2O3注射液已成功用于治疗急性早幼粒细胞白血病[7]。近年来,研究表明,As2O3对多种实体瘤也有抑制作用,其机制为诱导肿瘤细胞分化和凋亡[8]。国内外的流行病学调查和实验研究均表明,As2O3对胃癌、结肠癌、肝癌、肺癌、前列腺癌、膀胱癌、白血病等多种肿瘤也均有明显抑制作用[9-14]。也有研究表明As2O3对人宫颈癌Hela细胞、口腔鳞状细胞癌等有明显的放射增敏作用[15-17]。本实验研究As2O3对人脑胶质瘤SHG44细胞的增殖抑制作用,结果表明,As2O3能抑制SHG44细胞的生长,并呈剂量依赖性和时间依赖性,即随As2O3作用浓度的增加、As2O3作用时间的延长,其抑制作用越明显,其半数抑制浓度为9μmol·L-1。可以从As2O3对SHG44细胞的增殖抑制作用看出,当As2O3浓度为1μmol·L-1时,对SHG44细胞已有抑制增殖作用(P<0.01),在1~4μmol·L-1浓度时,抑制作用呈递增关系,这个浓度是临床治疗剂量的砷浓度。

图1 4组细胞激光共聚焦显微镜扫描凋亡图(×40)A.对照组;B.2μmol·L-1As2O3组;C.4μmol·L-1As2O3组;D.6μmol·L-1As2O3组Fig.1 Apoptosis images by laser scanning confocalm icroscope of 4 groups of cells(×40)A.control group;B.2μmol·L-1As2O3group;C.4μmol·L-1As2O3group;D.6μmol·L-1As2O3group
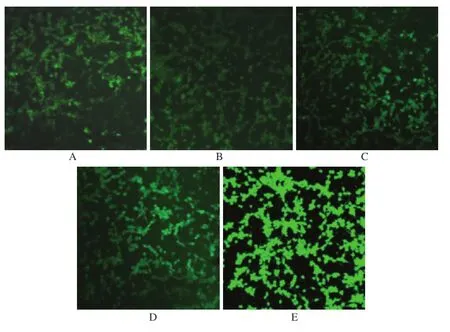
图2 5组细胞内荧光强度图(×40)A.对照组;B.1μmol·L-1As2O3组;C.2μmol·L-1As2O3组;D.4μmol·L-1As2O3组;E.6μmol·L-1As2O3组Fig.2 Intracellular fluorescence intensity images of five groups of cells(×40)A.control group;B.1μmol·L-1As2O3group;C.2μmol·L-1As2O3group;D.4μmol·L-1As2O3group;E.6μmol·L-1As2O3group
有关As2O3对细胞杀伤机制的基础研究报道甚多,笔者从ROS的氧化损伤角度来研究其细胞杀伤机制。As2O3在0~6μmol·L-1的浓度作用于SHG44细胞,激光共聚焦显微镜测定细胞内的荧光强度,荧光强度与细胞内ROS水平成正比,间接反映细胞内的ROS水平,当加入As2O3后,SHG44细胞内荧光强度值明显升高,ROS的含量随As2O3作用浓度的加大明显提高,具有一定的浓度依赖关系。As2O3是一种原浆毒物质,与巯基(-SH)有高度亲和力。可以与细胞内含巯基的抗氧化剂和抗氧化酶结合,细胞清除和拮抗氧化能力降低,打破细胞内抗氧化的动态平衡,致使细胞内ROS增多。过高的ROS对细胞生长不利,可以导致包括脂质过氧化、蛋白质氧化和DNA损伤等有害变化。DNA是生命信息的载体,是细胞中最重要的生物大分子之一。细胞DNA分子中的碱基、核糖和磷酸二酯键都可能遭受自由基的攻击,造成碱基与核糖氧化、链断裂与蛋白质交联等多种类型的损伤。
综上所述,As2O3在体外具有抗胶质瘤细胞增殖作用。这为临床应用As2O3治疗胶质瘤提供较可靠的实验依据。
[1]孙洪德,李元善,马玲,等.癌灵1号结合中医辩证治疗急性早幼粒细胞白血病32例[J].中国中西医结合杂志, 1992,12(3):170-174.
[2]张鹏,王树叶,胡龙虎,等.三氧化二砷注射液治疗72例急性早幼粒细胞白血病[J].中华血液学杂志,1996,17 (2):58-62.
[3]ENDOH T,TSUJIN,ASANUMA K,et al.Survivin enhances telomerase activity via up-regulation of specificity protein 1-and c-Myc-mediated human telomerase reverse trans-criptase gene transcription[J].Exp Cell Res,2005,305(5):300-311.
[4]聂林,余卫,何冬梅,等.三氧化二砷对肝癌细胞survivin基因和端粒酶活性的影响[J].肿瘤,2006,26(12):1064-1068.
[5]章静波.组织和细胞培养技术[M].北京:人民卫生出版社,2002:312-318.
[6]SHEN H M,SHIC Y,SHEN Y,et al.Detection of elevated reactive oxygen species level in cultured rat hepatocytes treated with aflatoxin B1[J].Free Radic Biol Med,1996,21 (2):139.
[7]张鹏,王树叶,胡龙虎,等.三氧化二砷治疗急性早幼粒细胞白血病七年总结——附242例分析[J].中华血液学杂志,2000,21(2):67-70.
[8]陈鑫.三氧化二砷在实体瘤中的研究现状[J].临床肿瘤学杂志,2003,8(3):229-231.
[9]成静,冯觉平,王亚萍,等.三氧化二砷对人肺腺癌A549/ R细胞多药耐药相关蛋白表达的影响[J].医药导报, 2007,26(5):457-460.
[10]王南瑶,刘琳,邱少敏,等.三氧化二砷对人结肠癌裸鼠移植瘤端粒酶活性及其催化亚单位表达的影响[J].东南大学学报:医学版,2005,24(3):168-170.
[11]李媛,李晶晶,胡本容,等.三氧化二砷和维生素C联合诱导肝癌细胞凋亡的作用研究[J].医药导报,2006,25(1): 3-5.
[12]ENDOH T,TSUJIN,ASANUMA K,et al.Survivin enhances telomerase activity via up-regulation of specificity protein 1-and c-Myc-mediated human telomerase reverse trans-criptase gene transcription[J].Exp Cell Res,2005,305(5):300-311.
[13]崔艳慧,梁海军,张清琴,等.三氧化二砷对人食管癌细胞株EC-1的放射增敏作用[J].肿瘤防治研究,2012,39 (6):667-670.
[14]王涛,马梁明,张华屏,等.三氧化二砷联合丁硫氨酸亚砜胺诱导人白血病K562/ADM细胞凋亡[J].中华肿瘤杂志,2008,30(3):188-190.
[15]郭红,吴荣,迟峰,等.三氧化二砷对人宫颈癌Hela细胞系的放射增敏作用[J].实用肿瘤学杂志,2007,21(1):21-22.
[16]KUMAR P,GAOQ,NING Y,etal.Arsenic trioxide enhances the therapeutic efficacy of radiation treatment of oral squamous carcinoma while protecting bone[J].Mole Can Therap,2008,7(7):2060-2069.
[17]宿颖,葛丽华,苗聪聪,等.三氧化二砷对口腔鳞癌细胞裸鼠移植瘤的抑制作用[J].北京口腔医学,2013,21(1):1-5.
DOI 10.3870/yydb.2014.01.010
Inhibition Effects of Arsenic Trioxide on SHG44 Human Glioma Cells
HUANG Hui1,JIANG Hong-ling2,LIU Fen-ju3,BAI Xue1,HE Zhuo-kai1,CAI Rui1,ZHANG Rong-jun1, ZHAO Bo1,LIU Mei-lian1
(1.Department of Radiation Oncology,Affiliated Hospital to Guilin Medical College, Guilin 541001,China;2.Department of Rehabilitation,Affiliated Hospital to Guilin Medical College,Guilin 541001,China;3.School of Radiation Medicine and Public Health,Suzhou University,Suzhou 215007, China)
Objective To investigate the anti-proliferation effects of arsenic trioxide(As2O3)on human glioma cells-44 (SHG44)in vitro and itsmechanism.MethodsThe inhibitory ratio of the cells by As2O3wasmeasured by MTT assay.The intracellular ROSwere determined by a probe(DCFH-DA)under a laser scanning confocalmicroscopy.ResultsAs2O3significantly inhibited SHG44 cells proliferation.The proliferation inhibition rate was dose-dependent and time-dependent.The proliferation inhibition by 12μmol·L-1As2O3on SHG44 cells was as high as 63.8%.After treatment with As2O3,the intracellular ROS was increased markedly in a concentration-dependent manner.ConclusionAs2O3can inhibit the proliferation of SHG44 cells in both dose-dependent and time-dependentmanners.The inhibition was associated with elevation of intracellular ROS.
Arsenic trioxide;Glioma;SHG44 cells;Inhibition effects
R979.1;R969
A
1004-0781(2014)01-0034-05
2013-04-01
2013-07-11
*广西卫生厅自筹经费科研课题基金资助项目(Z2011185)
黄辉(1974-),男,湖南安化人,副主任医师,硕士,研究方向:肿瘤放射治疗和综合治疗。电话:(0) 15878398556,E-mail:huanghui25002@163.com。
蒋宏玲(1978-),女,湖南衡阳人,主管护师,学士,从事肿瘤康复工作。电话:(0)13977312871,E-mail:1037039186@qq.com。

