αA晶体蛋白基因启动子与HSP70融合基因对大鼠半乳糖性白内障的抑制作用
张子萍,葛正龙
(遵义医学院 生物化学与分子生物学教研室,贵州 遵义 563099)
白内障是目前世界上主要的致盲性眼病。在老年人中的发病率较高,其主要表现为晶状体的混浊。到目前为止,还无延缓白内障发生的有效方法,只有成熟时采取手术治疗[1]。探索有效的方法抑制白内障发生非常有必要。
αA-晶体蛋白是晶体上皮细胞的特异表达蛋白,有分子伴侣活性,可与蛋白质结合,保护它们免受进一步的变性和降解,并能使聚集的蛋白质解聚,从而保证晶状体正常的透光度。晶状体中α-晶体蛋白量随着年龄增长会逐渐减少,使相应的分子伴侣功能下降,导致白内障形成。热休克蛋白(heat shock proteins,HSP)是目前公认的蛋白保护因子,有分子伴侣功能。热休克蛋白70(heat shock protein 70,HSP70)是其重要成员之一,对保护晶状体的透明性有着重要的作用[2]。因此,本实验研究αA晶体蛋白组织特异性启动子(αACP)驱动的HSP70基因对大鼠半乳糖性白内障形成的影响。
1 材料与方法
1.1 主要药品及试剂 pIRES2-EGFP、pIRES2-EGFP-HSP70、pαACP-HSP70 (本室已构建);多价阳离子脂质体(LipofectamineTM2000,美国Invotrogen公司);D-半乳糖(张家港市思普生化有限公司)配成50%注射液,常规灭菌后使用;复方托吡卡胺滴眼液(参天制药株式会社),供镜检前扩瞳用。
1.2 主要仪器 裂隙灯显微镜(苏州医疗器械厂),荧光显微镜(德国Leica公司)等。
1.3 实验动物 3周龄SD大鼠160只,平均体重(50±5) g,健康,无眼疾,雌雄不拘(第三军医大学实验动物中心提供)。
1.4 方法
1.4.1 分组及给药方法[3]将160只SD大鼠随机分成5组,每组32只。分别为:①NS组(阴性对照);②半乳糖+ Lipo-pαACP-HSP70组(简写为半乳糖+α-70组);③半乳糖+Lipo-pIRES2-EGFP-HSP70组(简写为半乳糖+ HSP70组);④半乳糖+ Lipo-pIRES2-EGFP组(简写为半乳糖+EGFP组);⑤半乳糖+NS组(阳性对照)。第1步:②③④⑤组颈背部皮下注射质量分数为50%的D-半乳糖(30mL·kg-1·d-1),连续30d。第2步:注射半乳糖4h后,分别为①②③④⑤组单侧眼球球后注射0.9%NS、Lipo-pαACP-HSP70混合液、Lipo-pIRES2-EGFP-HSP70混合液、Lipo-pIRES2-EGFP混合液、0.9%NS 0.1 m L/只,隔日1次,连续15次。各种药液注射后均需留针30s以防药液从针眼处渗漏(注:第1步与第2步同时进行)。
在第1次给药后7、14、21和30 d随机处死8只大鼠,摘除眼球,分离出晶状体。
1.4.2 LipofectamineTM2000/质粒复合液制备 按照LipofectamineTM2000脂质体说明书,将脂质体与质粒(pIRES2-EGFP、pIRES2-EGFP-HSP70、pαACP-HSP70)分别用0.9%NS稀释,脂质体与质粒比例为3μL:1μg,混匀静置,制备浓度为3μg/μL的脂质体/质粒复合物(Lipo-pIRES2-EGFP、Lipo-pIRES2-EGFP-HSP70、Lipo-pαACP-HSP70)。
1.4.3 晶状体混浊度观察 从第1次给药后第3d开始,每日在裂隙灯显微镜下观察各组大鼠的晶状体混浊情况。参照Kador等[4]的分级标准将晶状体混浊度分为5级,I级:晶状体透明,无混浊;II级:晶状体轻度浑浊,周边出现空泡或线状改变;Ⅲ级:晶状体周边空泡向中心扩展,出现雾状混浊为中度混浊;1V级:晶状体高度浑浊,空泡扩展到核区,中心核雾状浑浊加重;V级:核混浊,白内障成熟。记录结果并照相。
1.4.4 荧光显微镜下观察 制作冰冻切片,通过观察荧光强度了解pαACP-HSP70中EGFP基因在晶状体上皮细胞的表达情况,以平均荧光强度代表蛋白表达水平。
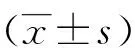
2 结果
2.1 晶状体混浊度检查(见表1~4) ①NS组:在整个实验过程未出现晶状体混浊(见表1,图1);②半乳糖+NS组:第7天见94%晶状体出现空泡Ⅱ级及以上改变(见表1);第14天时88%晶状体出现Ⅲ级及以上改变(见表2);第21天时94%大鼠晶状体出现Ⅳ级及以上改变(见表3);第30天时100%大鼠晶状体出现V级改变(见表4, 图1B,图2);③半乳糖+EGFP组白内障出现的时间、程度与同期的半乳糖组+NS相比较差异无统计学意义(P>0.05)(见表1~4,图1);④半乳糖+HSP70组:在第7天时84%晶状体出现Ⅱ级及以上改变(见表1);第14天时79%晶状体出现Ⅲ级以上改变(见表2);第21天时38%晶状体出现IV级及以上变化(见表3),第30天时25%晶状体出现V级改变(见表4),⑤半乳糖+α-70组在第7天时只有59%晶状体出现Ⅱ级及以上改变(见表1);第14天时46%晶状体出现Ⅲ级以上改变(见表2);第21天时19%晶状体出现IV级及以上改变(见表3),第30天时只有约13%晶状体出现V级改变 (见表4),该组白内障出现的程度与同期的半乳糖+NS组、半乳糖+EGFP组及半乳糖+HSP70组相比明显减轻(P<0.05),并且其所出现白内障的时间亦延迟。
表1实验第7天裂隙灯下各组大鼠晶状体混浊度
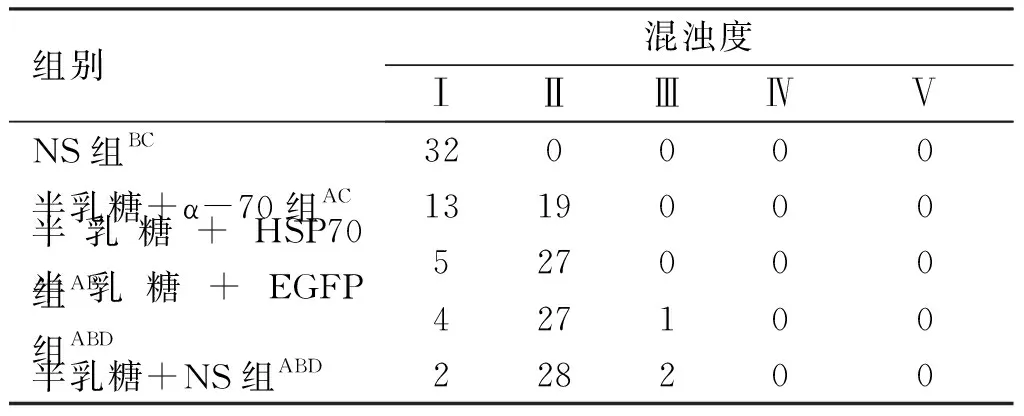
组别混浊度ⅠⅡⅢⅣⅤNS组BC320000半乳糖+α-70组AC1319000半乳糖+HSP70组AB527000半乳糖+EGFP组ABD427100半乳糖+NS组ABD228200
注:与NS组比较,AP<0.05;与半乳糖+ α-70组比较,BP<0.05;与半乳糖+HSP70组比较,CP<0.05,DP>0.05。
表2实验第14天裂隙灯下各组大鼠晶状体混浊度
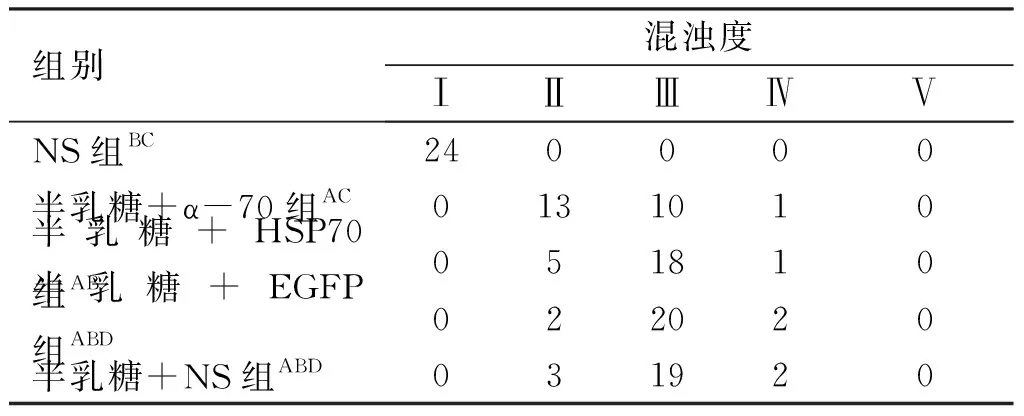
组别混浊度ⅠⅡⅢⅣⅤNS组 BC240000半乳糖+α-70组 AC0131010半乳糖+HSP70组AB051810半乳糖+EGFP组ABD022020半乳糖+NS组ABD031920
注:与NS组比较,AP<0.05;与半乳糖+ α-70组比较,BP<0.05;与半乳糖+HSP70组比较,CP<0.05,DP>0.05。
表3实验第21天裂隙灯下各组大鼠晶状体混浊度
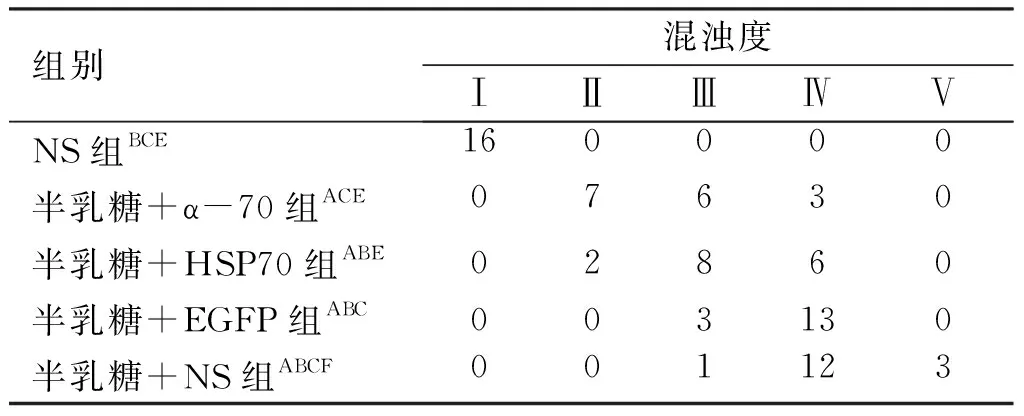
组别混浊度ⅠⅡⅢⅣⅤNS组BCE160000半乳糖+α-70组ACE07630半乳糖+HSP70组ABE02860半乳糖+EGFP组ABC003130半乳糖+NS组ABCF001123
注:与NS组比较,AP<0.05;与半乳糖+ α-70组比较,BP<0.05;与半乳糖+HSP70组比较,CP<0.05,与半乳糖+EGFP组比较,EP<0.05,FP>0.05。
表4实验第30天各组大鼠晶状体混浊程度
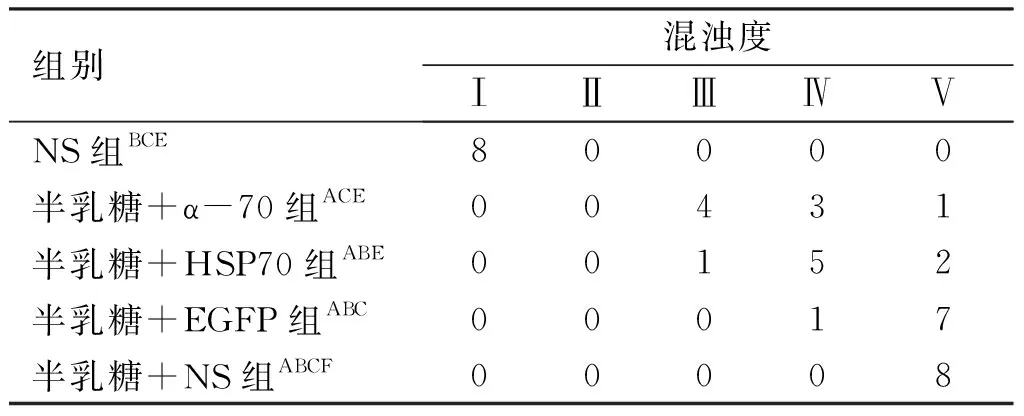
组别混浊度ⅠⅡⅢⅣⅤNS组 BCE80000半乳糖+α-70组 ACE00431半乳糖+HSP70组ABE00152半乳糖+EGFP组ABC00017半乳糖+NS组ABCF00008
注:与NS组比较,AP<0.05;与半乳糖+ α-70组比较,BP<0.05;与半乳糖+HSP70组比较,CP<0.05,与半乳糖+EGFP组比较,EP<0.05,FP>0.05。
2.2 外源基因表达的绿色荧光蛋白鉴定 NS组与半乳糖+NS组未见绿色荧光蛋白表达(图2A);半乳糖+α-70组(图2B)、半乳糖+HSP70(图2C)、半乳糖+EGFP组(2D)均可直接观察到大鼠晶状体上皮细胞中有绿色荧光,只是荧光强度不同。绿色荧光的平均荧光强度利用Image Pro Plus 6.0图像分析软件测得(见表5),半乳糖+α-70组的平均荧光强度最强,与其他4组相比有明显差异(P<0.01);半乳糖+EGFP组与半乳糖+HSP70组相比无明显差异(P>0.05);NS组与半乳糖+NS组相比无明显差异(P>0.05),这两组几乎没有绿色荧光,所测得的平均荧光强度都为0,明显低于其他3组(P<0.01)。
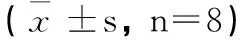
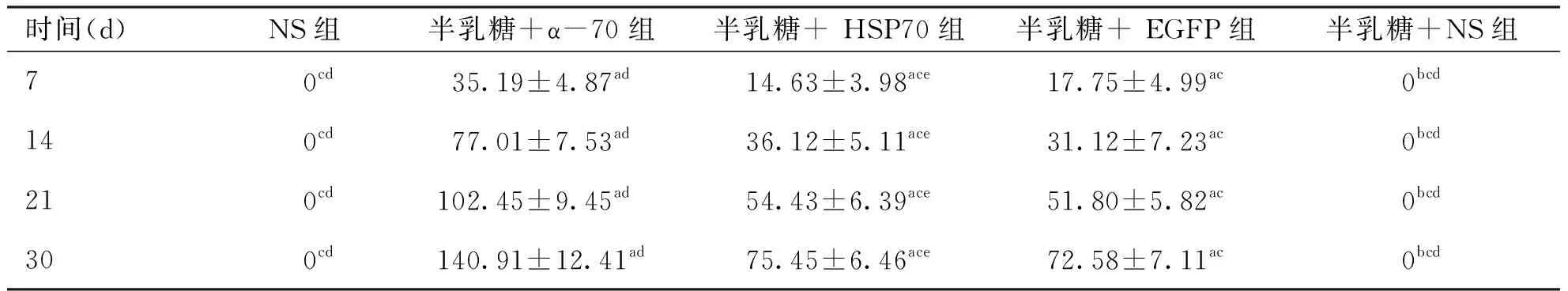
时间(d)NS组 半乳糖+α-70组半乳糖+ HSP70组半乳糖+ EGFP组半乳糖+NS组70cd35.19±4.87ad14.63±3.98ace17.75±4.99ac0bcd140cd77.01±7.53ad36.12±5.11ace31.12±7.23ac0bcd210cd102.45±9.45ad 54.43±6.39ace51.80±5.82ac0bcd300cd140.91±12.41ad75.45±6.46ace72.58±7.11ac0bcd
注:与NS组比较,aP<0.01,bP>0.05;与半乳糖+ α-70组比较,cP<0.01;与半乳糖+EGFP 组比较,dP<0.01,eP>0.05。
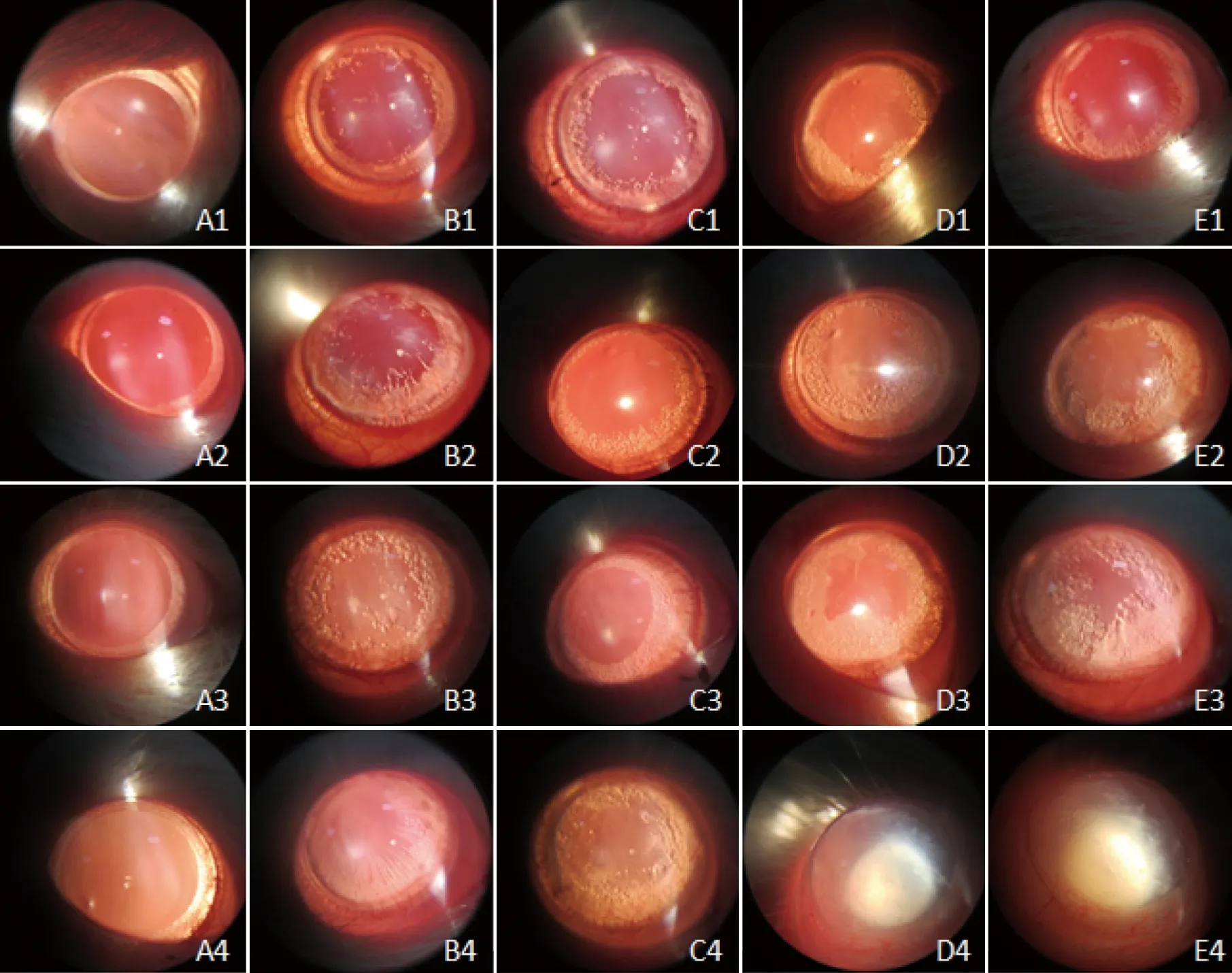
注:A、B、C、D、E分别表示NS组、半乳糖+α-70组、半乳糖+HSP70组、半乳糖+EGFP组、半乳糖+NS组;1、2、3、4分别表示第7、14、21、30 d。 图1 裂隙灯观察晶状体混浊度的主要变化
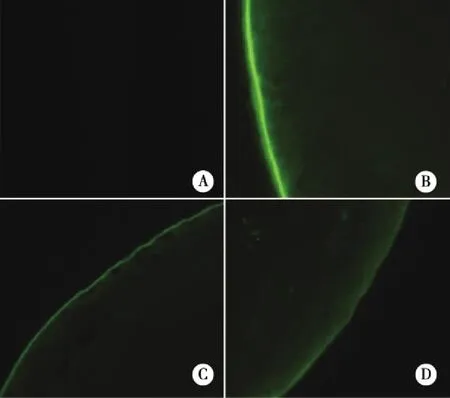
注:A:为NS组和半乳糖+NS组;B:为半乳糖+α-70组、C:为半乳糖+HSP70组、D:为半乳糖+EGFP组。 图2 第30天时荧光显微镜下观察结果(×100)
3 讨论
白内障表现为晶状体特定的区域或完全的混浊化[5]。维持晶状体的透明度对保护视功能有重大意义。晶状体比较特殊,无血管,无神经,只能从周围的房水中摄取营养物质,因此,不利于环境对其进行有效的调整,容易遭到损害。αA晶体蛋白仅局限于晶状体内表达,其它组织仅有少量被发现[6]。
研究表明,晶状体中α-晶体蛋白含量随着年龄增长会逐渐减少,高相对分子量蛋白质可能发生翻译后修饰改变,构象发生改变后形成大量的α- 晶体蛋白聚合物,导致分子伴侣功能下降,对其他晶体蛋白和酶的保护作用也相应下降,加剧其他晶体蛋白的凝聚和光散射[7],从而形成白内障。也有研究表明,随着年龄的增长,晶状体囊膜中HSP含量逐渐减少,晶体上皮细胞HSP的表达量减少反映了晶状体细胞自我修复功能的下降,可引起变性蛋白的恢复障碍和降解速度减慢,使晶状体的透明度降低,从而导致老年性白内障的形成,可见晶体上皮细胞内起分子伴侣作用的物质受损或降低也是导致白内障发生的主要因素之一。HSP70是HSP其中一员,它在正常细胞中表达水平较低,而应激后表达会显著性的增强。李桂荣等[8]等通过研究表明HSP70的应激表达对人晶状体上皮细胞起着重要的保护作用。Massey等[9]研究表明外源基因导入眼内后,可检测到晶状体内有相应蛋白表达。因此,本研究小组在前期已构建了αA晶体蛋白基因启动子(αACP)与HSP70基因融合表达载体(即pαACP-HSP70)[10],并将质粒导入体外培养的半乳糖性白内障大鼠晶状体组织中,结果显示外源性pαACP-HSP70在体外培养的大鼠晶状体内有表达,及其对大鼠半乳糖性白内障的形成有延缓作用。本实验从体外研究进一步发展到体内研究,将质粒导入半乳糖性白内障大鼠体内,结果显示裂隙灯观察半乳糖+α-70组与半乳糖+HSP70组白内障出现的时间与其他组相比明显延迟,测得的平均荧光强度也比其他组高(P<0.05),且半乳糖+α-70组比半乳糖+HSP70组程度更轻,半乳糖+α-70组平均荧光强度最强。之所以半乳糖+α-70组比半乳糖+HSP70组作用明显。我们推测可能的原因是:由于pαACP-HSP70中含有αA晶体蛋白基因启动子,它能够促进其下游的HSP70定向的表达,从而使HSP70含量增加。证明外源HSP70已定向在大鼠晶状体上皮细胞内有表达,并且发挥了其分子伴侣的功能,能防止蛋白质变性和降解,并能使聚集的蛋白质解聚,从而保证了晶状体的透明度,延缓了大鼠半乳糖性白内障的形成。
白内障是当今世界致盲的主要眼病。国内外学者正在积极探索治疗白内障的有效方法。随着科学技术的快速发展,白内障的基因治疗已受到人们的重视,经过不懈的努力,我们发现HSP70有阻止晶状体上皮细胞凋亡的作用,同时在保持蛋白质稳定性方面也起着重要作用。采用基因治疗的方法,通过导入外源的HSP70或诱导自身HSP70基因表达,从而抑制白内障形成,这为治疗白内障提供新的研究方法和思路。
[参考文献]
[1] 赵家良.我国白内障盲的防治任重道远[J].中华眼科杂志,2003,39(5):257-259.
[2] 张伟英,汪浩,宋蕾,等. HSP27和HSP70在老年性白内障和透明晶状体中的表达[J].同济大学学报:医学版,2008,29(3):33-37.
[3] 陆红玲,余晓,李琴山,等. 建立皮下注射d-半乳糖大鼠白内障动物模型[J].遵义医学院学报,2002,25(4):308-309.
[4] Kador P F,Inoue J,Seechi E F,et al. Effect of sorbitol dehydrogenase inhibition on cataract formation in gatactose fed and diabetic rats[J]. Exp Eye Res,1998,67(2):203-208.
[5] Wormstone I M,collison D J,hansom S P,et al.A focus on the human lens in vitro[J].Environ Toxico Pharmacol,2006,21(2):215-221.
[6] Kato K Shinohara H,Kurobe N,et a1.Immunoreactive aA-erystallin in rat non-lenticular tissues detected with a sensitive immunoassay method[J].Biochimica et Biophysica Acta,1991,1080(2):173-180.
[7] CarverJ A,Nicholls K A,Aquilina J A,et a1.Age-related changes in bovine αlpha-cry stallin and high-molecular-weight protein[J].Exp Eye Res,1996,63(6):639-647.
[8] 李桂荣,周鸿雁,张文松.热休克蛋白HSP27和HSP70在老年性白内障患者晶状体上皮细胞中表达及其意义[J].中国实验诊断学, 2011, 15(6):1048-1050.
[9] Massey A J,Williamson D S,Browne H,et al.A novel,small molecule inhibitor of Hsc70/ Hsp70 potentiates Hsp90 inhibitor induced apoptosis in HCT116 colon carcinoma cellp [J].Cancer Chemother Pharmacol, 2010,66(3):535-545.
[10] 姜婧怡,葛正龙.αA晶体蛋白基因启动子与HSP70融合基因表达载体的构建及鉴定[J].遵义医学院学报,2013,36(1):13-20.

