shRNA沉默DNA-PKcs表达对肝癌耐药细胞BEL7402/5-FU耐药性的影响
梁大敏,束 波,杨加伟,生 欣,范 芳
(遵义医学院 生物化学教研室,贵州 遵义 563099)
肝细胞癌(Hepatocellular carcinoma,HCC)是临床常见的恶性肿瘤之一,其发病机制和病因尚不明确。DNA双链断裂(double-stranded breaks,DSBs)是细胞最严重的一种损伤,可导致细胞失去分裂增殖能力而死亡,是抗癌药物致肿瘤细胞死亡主要机制。DNA依赖性蛋白激酶亚基(DNA-dependent kinase catalytic subunit,DNA-PKcs)是参与非同源重组修复(nonhomologous end-joining,NHEJ)的核心组分,在NHEJ、VDJ重组和维持端粒结构中起关键作用,同时可磷酸化诸多转录因子和修复基因[1-2]。除此之外,有研究报道DNA-PKcs与肝癌耐药有关[3-4]。本文将shDNA-PKcs转染肝癌耐药细胞株BEL7402/5-FU,通过检测DNA-PKcs沉默对细胞化疗药物敏感性的影响,初步探索shDNA-PKcs与肝癌耐药的关系。
1 材料与方法
1.1 材料 BEL7402/5-FU细胞株购于南京凯基生物科技发展有限公司,PRNAi-U6.1-Neo shRNA质粒购于百奥迈科生物科技有限公司,Lipofectamine®2000Reagent购于Invitrogen公司,DNA-PKcs抗体购自Assay biotech公司,P-Glycoprotein(P-gp)抗体购自abcam公司,其余试剂均为国产分析纯试剂。
1.2 方法
1.2.1 shRNA质粒提取与鉴定 按质粒提取试剂盒提取质粒,经BamH I、Hind III双酶切后,琼脂糖凝胶电泳(1.0 %琼脂糖,120 V,30 min),拍照。另取菌液1 mL送至百奥迈科生物技术有限公司测序。
1.2.2 BEL7402/5-FU细胞的培养 将BEL7402/5-FU细胞于含10 %胎牛血清、20 μg/mL 5-FU的1 640培养液,37 ℃、5 %CO2条件下培养。细胞贴壁生长,每天换液1次,2~3 d传代1次,取对数生长期细胞用于实验。
1.2.3 实验分组与质粒转染 实验分为4组:空白对照组、脂质体组、空质粒组、shDNA-PKcs实验组。将BEL7402/5-FU细胞接种于6孔培养板,每孔种8×104个细胞,当细胞融合度达到80%左右时吸去培养液,将质粒-脂质体复合物加至相应培养孔中,每孔200 μL,6 h后换液。48 h后荧光显微镜下计数,转染率=每个视野下的荧光细胞个数/相同视野下的细胞总数×100 %。
1.2.4 Real-time PCR检测DNA-PKcs mRNA水平的表达 细胞总RNA的提取按Trizol® Reagent试剂盒说明书进行,Real-time PCR引物:DNA-PKcs上游5′-GTGACAAGGCAACTGTATGAGC-3,下游3′-TTCTCTAAAAACACCAGCCACA-5′,扩增片段长度163bp;β-actin上游5′-TGACGTGGACATCCGCAAAG-3,下游3′-GGAGCGACAGGTGGAAGGTC-5′,扩增片段长度206bp。
各组样品DNA-PKcs mRNA表达量经Real-time PCR仪检测,PCR产物作熔解曲线分析,根据Ct值通过公式2-(△△CT)进行相对定量分析计算可得DNA-PKcs mRNA相对表达量。
1.2.5 Western blot检测DNA-PKcs、P-gp蛋白表达 提取各组细胞总蛋白,按BCA法制作标准曲线,计算样品蛋白浓度。取50 μg蛋白样品与上样缓冲液混均,SDS-PAGE电泳,转膜,封闭1 h(RT,1 h),孵一抗(4 ℃,过夜),TBST洗膜3次。孵二抗(37 ℃,1 h),TBST洗膜3次,ECL发光显色。用Quantity One定量分析软件分析灰度比。
1.2.6 MTT法检测药物敏感性 取BEL7402/5-FU细胞制成细胞悬液,接种于96孔培养板中,每孔种1×104个细胞,培养12 h后转染,6 h后弃培养基,分别按0、2、4、8、16、32、64、128 μg/mL加入阿霉素(ADM)、丝裂霉素(MMC)、顺铂(DDP)和按0、3、6、12、24、48、96、192 μg/mL加入5-氟尿嘧啶(5-FU)。48 h后弃培养液,加180 μL无血清培养液、20 μL MTT(0.5%),继续培养4 h后弃上清,加150 μL二甲基亚砜(DMSO),低速震荡10 min,全自动酶标仪(490 nm)测定各孔吸光度值。用Graphpad prism5.0计算各个药物的IC50。
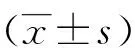
2 结果
2.1 shDNA-PKcs质粒的鉴定 酶切电泳结果显示:shDNA-PKcs质粒组、阴性质粒组约6300bp(见图1)。shDNA-PKcs质粒测序结果显示质粒插入序列如下:GATCCGGGCGCTAATCGTACTGAA TTCAAGAGATTCAGTACGATTAGCGCCCTTTTTTA。
2.2 荧光计数检测shDNA-PKcs质粒的转染率 结果显示:shDNA-PKcs质粒转染效率约为62.2%(见图2)。
2.3 Real time PCR检测DNA-PKcs、P-gp mRNA水平表达 实验结果使用2-△△Ct法进行分析,结果显示(见表1):空白对照组、脂质体组、质粒对照组DNA-PKcs、P-gp mRNA表达无明显差异(P>0.05),shDNA-PKcs实验组DNA-PKcs、P-gp mRNA的表达较对照组明显下调(P<0.01)。DNA-PKcs mRNA水平的沉默效率为82.6 %。
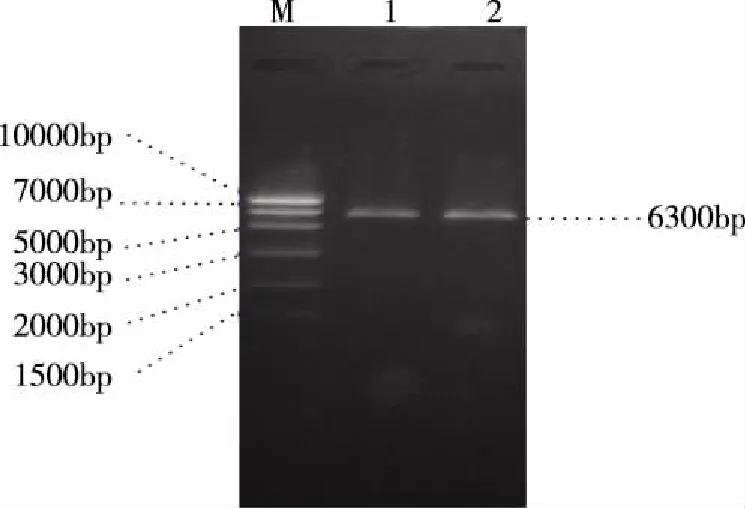
注:1:shDNA-PKcs质粒组;2:阴性质粒组。图1 酶切电泳结果
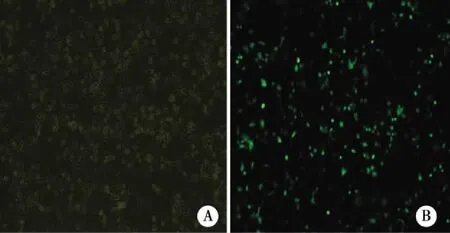
注:A:普通光源;B:荧光光源。 图2 shDNA-PKcs质粒细胞水平转染效率(×100)
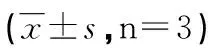
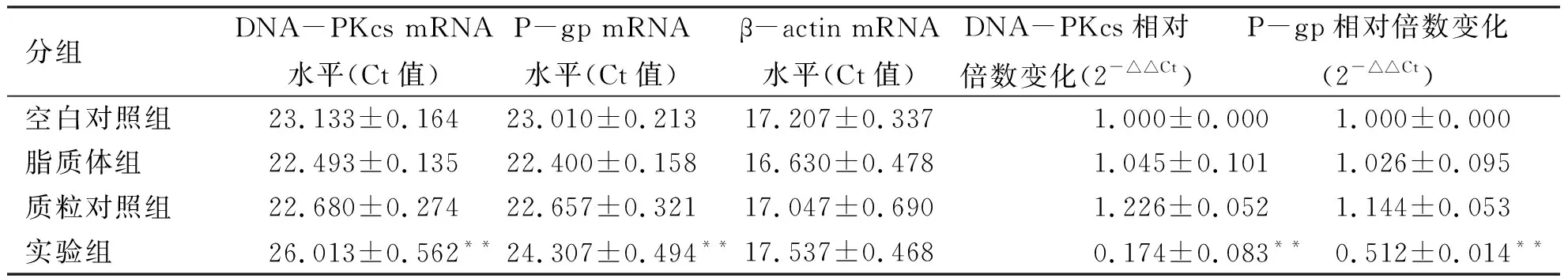
分组DNA-PKcs mRNA水平(Ct值)P-gp mRNA水平(Ct值)β-actin mRNA水平(Ct值)DNA-PKcs相对倍数变化(2-△△Ct)P-gp相对倍数变化(2-△△Ct)空白对照组23.133±0.16423.010±0.21317.207±0.3371.000±0.0001.000±0.000脂质体组22.493±0.13522.400±0.15816.630±0.4781.045±0.1011.026±0.095质粒对照组22.680±0.27422.657±0.32117.047±0.6901.226±0.0521.144±0.053实验组26.013±0.562**24.307±0.494**17.537±0.4680.174±0.083**0.512±0.014**
注:**:与空白对照组相比P<0.01。
2.4 Western blot检测DNA-PKcs、P-gp蛋白水平表达 结果显示:空白对照组、脂质体组、质粒对照组DNA-PKcs、P-gp表达无明显差异(P>0.05),shDNA-PKcs实验组DNA-PKcs、P-gp蛋白表达均下降,与对照组比较差异都具有统计学意义(P<0.01),DNA-PKcs蛋白水平的沉默效率为71.8%(见表2,图3)。
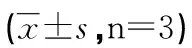

分组DNA-PKcs/β-actinP-gp/β-actin空白对照组1.214±0.2061.254±0.269脂质体组1.237±0.1351.301±0.053质粒对照组1.118±0.2121.167±0.120实验组0.282±0.032**0.225±0.001**
注:**:与空白对照组相比P<0.01。
2.5 MTT法检测BEL7402/5-FU细胞的药物敏感性 结果显示(见表3):空白对照组、脂质体组、质粒对照组对ADM、DDP、MMC、5FU的IC50差异
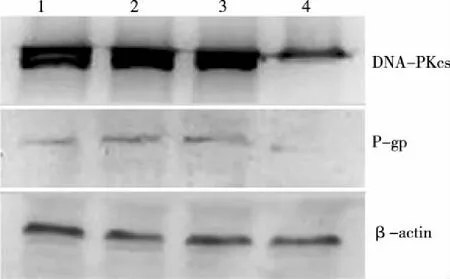
注:1:空白对照组;2:脂质体组;3:质粒对照组;4:shDNA-PKcs实验组。 图3 各组细胞DNA-PKcs、P-gp蛋白的表达
不明显(P>0.05),而shDNA-PKcs实验组对ADM、5FU IC50降低,与对照组相比差异具有统计学意义(P<0.05)。可见DNA-PKcs的沉默可增加肝癌耐药细胞BEL7402/5-FU对ADM、5FU的敏感性。
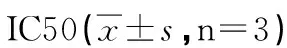
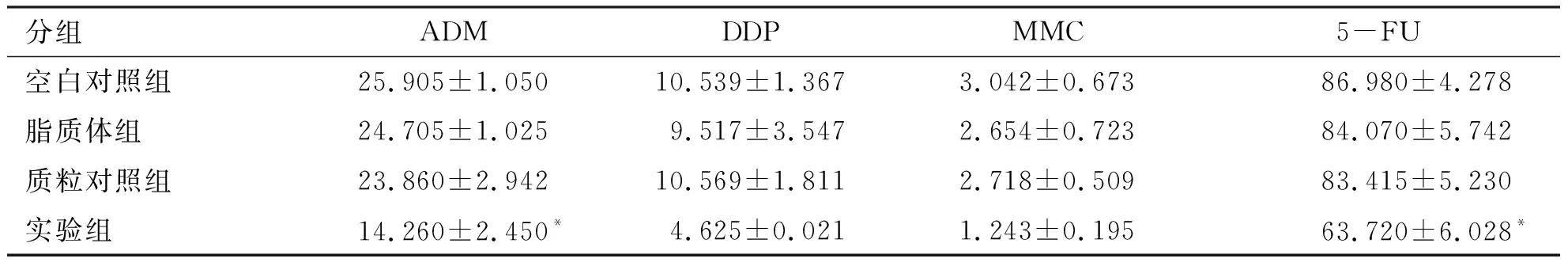
分组ADMDDPMMC5-FU空白对照组25.905±1.05010.539±1.3673.042±0.67386.980±4.278脂质体组24.705±1.0259.517±3.5472.654±0.72384.070±5.742质粒对照组23.860±2.94210.569±1.8112.718±0.50983.415±5.230实验组14.260±2.450*4.625±0.0211.243±0.19563.720±6.028*
注:*:与空白对照组相比P<0.05。
3 讨论
肝癌是一个最常见的、致命的肿瘤。目前临床上常采用手术联合放化疗,但长期放化疗后,易出现耐药,这可能与DNA损伤信号失调和DNA损伤修复有关[5-6]。其中,由电离辐射或抗癌药物如:阿霉素(拓补异构酶II抑制剂)等引起的DSBs是最严重的损伤。然而,在哺乳动物细胞中以DNA-PK为核心的非同源重组修复(non-homologous end joining,NHEJ)在DSBs修复的中发挥主要作用。
DNA -PKcs由4128个氨基酸组成的相对分子量为469 kD的大分子量蛋白质,基因位于染色体8 ql1,含有一系列磷酸化位点以及高度保守区[7]。DSBs发生后,DNA-PKcs与Ku70/80结合到DNA末端,通过自身磷酸化和磷酸化下游蛋白如:Artemis、DNA ligase4、XRCC4和Cernunnos等完成DNA损伤修复[8]。DNA-PKcs被认为具有肿瘤抑制功能,能维持基因组稳定性[9]。大量研究发现,在许多肿瘤患者经放化疗后,DNA-PKcs蛋白表达活性增加,且DNA-PKcs表达量的多少直接影响肿瘤的进一步治疗。因此,本实验采用RNAi技术沉默DNA-PKcs,检测肝癌细胞对4种常用化疗药物的敏感性,结果发现沉默后能够明显增加肝癌细胞对ADM、5-FU的敏感性。目前已有一些研究表明下调DNA-PKcs能增加肿瘤细胞对药物的敏感性[10-11]。然而,在耐顺铂的神经胶质瘤患者、口腔癌放疗患者中已发现DNA-PKcs活性增加[12],表明放化疗后机体产生了耐药性。为了进一步了解BEL7402/5-FU细胞耐药的可能机制,本实验用Real time PCR和Western blot法检测了各组细胞的多药耐药蛋白P-gp mRNA和蛋白表达情况。实验检测结果显示DNA-PKcs沉默后P-gp mRNA和蛋白表达减少,提示DNA-PKcs的沉默可能通过下调P-gp的表达,从而增加BEL7402/5-FU细胞对化疗药物的敏感性。因此推测DNA-PKcs沉默降低细胞耐药性的机制除了与抑制DNA损伤修复途径有关,还可能与下调P-gp表达存在一定的联系,具体机制还需作进一步的实验研究。目前也有少量研究表明通过抑制DNA-PKcs下调P-gp,从而增加耐药细胞对化疗药物的敏感性[3-4]。但DNA-PKcs如何调控P-gp逆转耐药,目前说法不一,还需要进一步研究。
[参考文献]
[1] Lee K J, Lin Y F, Chou H Y,et al.Involvement of DNA-dependent protein kinase in normal cellcycleprogression through mitosis[J]. J Biol Chem,2011,286(14):12796-12802.
[2] Hsu F M,Zhang S,Chen B P.Role of DNA-dependent protein kinasecatalytic subunit in cancerdevelopment and treatment[J].Transl Cancer Res,2012,1(1):22-34.
[3] Seo S B,Hur J G,Kim M J,et al.TRAIL sensitize MDR cells to MDR-related drugs by down-regulation of P-glycoprotein through inhibition of DNA-PKcs/Akt/GSK-3beta pathway and activation of caspases[J].Mol Cancer,2010,28(9):199.
[4] Lee P C,Lee H J,Kakadiya R,et al.Multidrug-resistant cells over expressing P-glycoprotein are susceptible to DNA crosslinking agents due to attenuated Src/nuclear EGFR cascade-activated DNA repair activity[J].Oncogene,2013,32(9):1144-1154.
[5] 张阳德,王宁,廖明媚,等.DNA损伤和修复在肝癌中的研究进展[J].中国现代医学杂志,2012,21(13):57-61.
[6] Bouwman P,Jonkers J.The effects of deregulated DNA damage signalling on cancer chemotherapy response and resistance[J].Nat Rev Cancer,2012,12(9):587-598.
[7] Curtin N J.DNA repair dysregulation from cancer driver to therapeutic target[J].Nat Rev Cancer,2012,12(12):801-817.
[8] Rothkamm K,Krüger I,Thompson L H,et al.Pathways of DNA double-strand break repair during the mammalian cell cycle[J].Mol Cell Biol,2003,23(16):5706-5715.
[9] 江娜,沈瑛,孔宪明,等.DNA-PK蛋白功能及其调控机制[J].医学分子生物学杂志,2011,8(3):278-282.
[10] Evert M,Frau M,Tomasi M L,et al.Deregulation of DNA-dependent protein kinase catalytic subunit contributes to human hepatocarcino genesis development and has a putative prognostic value[J]. Br J Cancer,2013,109(10):2654-2664.
[11] Cornell L,Munck J,Curtin N,et al.PTU-0420 DNA-PKor ATM inhibition inhibits non-homologous end joining and enhances chemo- and radio sensitivity in hepatocellular cancer cell lines[J].Gut,2012,61:A201.
[12] Söderlund Leifler K,Queseth S,Fornander T,et al.Low expression of Ku70/80,but high expression of DNA-PKcs, predict good response to radiotherapy in early breast cancer [J].Int J Oncol,2010,37(6):1547-1554.

