氟西汀致大鼠腹泻作用研究
任丽娜 张家瑞 刘 梅
氟西汀是一种选择性5-羟色胺再吸收抑制剂型的抗抑郁药,“百优解”或“百忧解”为其商品名,在临床上用于成人忧郁症、强迫症和神经性贪食症的治疗[1]。氟西汀临床应用较为广泛,但是在应用过程中仍然存在全身或局部过敏,心跳加速,厌食,头晕、头痛,睡眠异常,疲乏,精神状态异常,性功能障碍,视觉异常,呼吸困难等诸多不良反应。氟西汀导致的胃肠道不良反应尤为常见,如恶心、呕吐、消化不良、腹泻、吞咽困难等[2]。胃肠动力的异常经常会伴随炎症疾病的发生,比如炎性肠病,长此以往易导致全身系统性疾病的发生[3],因此考察氟西汀胃肠道不良反应发生机制临床意义深远。
氟西汀抗抑郁的作用机制主要是通过抑制神经突触细胞对神经递质五羟色胺(5-HT)的再吸收以增加细胞外可以和突触后受体结合的血5-HT水平,从而起到抗抑郁的作用[4]。5-HT经释放作用于相应受体发挥作用后,必须重吸收至细胞内,终止其神经递质信号,该过程即由 5-HT转运体(serotonin transporter,SERT)完成。近年研究显示,5-HT转运体在肠道动力紊乱、内脏感觉异常等机制中发挥重要作用。因此,本研究着重考察了氟西汀对肠道SERT表达的影响,有助于揭示其导致胃肠动力紊乱的机制。结肠组织中诱导型一氧化氮合酶(iNOS)过度表达可以诱导炎症反应的发生,导致炎症性腹泻的发生[6],本研究同时研究了氟西汀是否通过iNOS诱导炎症性腹泻。
1 材料和方法
1.1 实验动物 SD雄性大鼠40只(4~6周,体质量160~180 g)随机分为4组,每组10只。分别为对照组(每日以2 ml生理盐水灌胃)、氟西汀低剂量组(每日以3 mg/kg氟西汀灌胃,灌胃总体积2ml)、氟西汀中剂量组(每日以6 mg/kg氟西汀灌胃,灌胃总体积2 ml)以及氟西汀高剂量组(每日以12 mg/kg氟西汀灌胃,灌胃总体积2 ml)。实验组大鼠共处理14 d。
1.2 实验药品 氟西汀使用的为盐酸氟西汀原料药。盐酸氟西汀原料药用生理盐水溶解至适当浓度作为储备液使用。克氏液的组成:氯化钠114.0 mmol/L、氯化钾 4.7 mmol/L、氯化镁 1.2 mmol/L、氯化钙 2.5 mmol/L、磷酸二氢 1.8 mmol/L、葡萄糖 11.5 mmol/L、碳酸氢钠18.0 mmol/L、pH(7.4 ±0.5)mmol/L。
1.3 离体结肠平滑肌条的制备以及张力测量[7,8]大鼠预先禁食48 h,但给水。离断大鼠脊髓处死,迅速剖腹,取出一段结肠,迅速剪好约1~2 cm的肠管。麦氏浴槽内水温由恒温装置控制在37℃。麦氏浴管置于麦氏浴槽中以使浴管内克氏液保持恒温37℃。L型管置于浴管内,其上端与气源(充气气囊或气泵等)相联,用双凹夹固定于铁支架上,气流量以l~2个气泡/s为宜。浴管下端与排液管相联,其上端可用不同形式随时充入新的恒温营养液。将小肠平滑肌条下端固定于浴槽下部通气侧弯钩上,上端与换能器相连,将平滑肌置入装有20 ml的37℃克氏液浴槽中,并通以95%O2和5%CO2,稳定约30 min,待小肠平滑肌运动恢复正常后,记录1段正常活动曲线,开始滴加给药,记录收缩曲线。氟西汀依照预实验结果提示的剂量范围进行给药,预实验结果提示氟西汀在10~160 μM剂量范围内,对小肠收缩呈现良好的剂量依赖性。大鼠解剖后,取出一段结肠,迅速剪好约1~2 cm的肠管,在通气冰浴中保存5~8 h。结肠肠断一端系在L型管的小钩上,另一端用小钩钩住,调节其紧张度适宜,即保证平滑肌收缩的前负荷为1.0 g,然后通过张力传感器与记录仪相连,稳定50 min,记录收缩张力曲线。
1.4 结肠组织中SERT,iNOS表达测定 取灌胃氟西汀发生腹泻的大鼠结肠组织,结肠中SERT,iNOS蛋白质含量采用Western Blotting方法进行研究。组织分离蛋白定量后,进行电泳转膜。转膜完毕后,带有蛋白条带的PVDF膜使用SERT抗体(1∶1 000稀释)[Abcam公司(香港)]孵育过夜。条带检测和定量采用多光谱成像系统(UVP,剑桥,英国)。结肠中iNOS蛋白质含量采用和SERT含量检测类似方法研究。孵育抗体为iNOS抗体(1∶1 000稀释)[Abcam公司(香港)]。
1.5 大鼠排便情况观察 每日灌胃前收集大鼠上次灌胃后的粪便数目,粪便数目即为上一次灌胃后到本次灌胃前的排便颗粒总数,腹泻情况,以一个污迹计算为一颗粪便数。粪便湿重与粪便干重的差值与粪便湿重的比值即为粪便含水量。
1.6 统计方法 所有计量资料以均数±标准差(x±s)表示。组间比较采用单因素方差分析,P<0.01为具有显著性差异。
2 结果
2.1 氟西汀对结肠平滑肌组织收缩性作用研究 与对照组比较,10~160 μM氟西汀剂量-反应依赖性地促进了离体大鼠结肠平滑肌收缩,显著促进了其收缩张力,收缩幅度以及收缩频率,其半数有效量(EC50)为40 μM。对照组数值设定为100%,160 μM氟西汀孵育下,结肠平滑肌收缩张力从(100.0±9.3)% 增加到(213.6 ±20.3)%(P <0.01;n=6 结肠段);收缩幅度从(100.0 ±5.6)%增加到(312.6 ±29.6)%(P <0.01;n=6结肠段);收缩频率从(100.0±8.6)%增加到158.3±14.9)%(P <0.01;n=6 结肠段)。见图1。
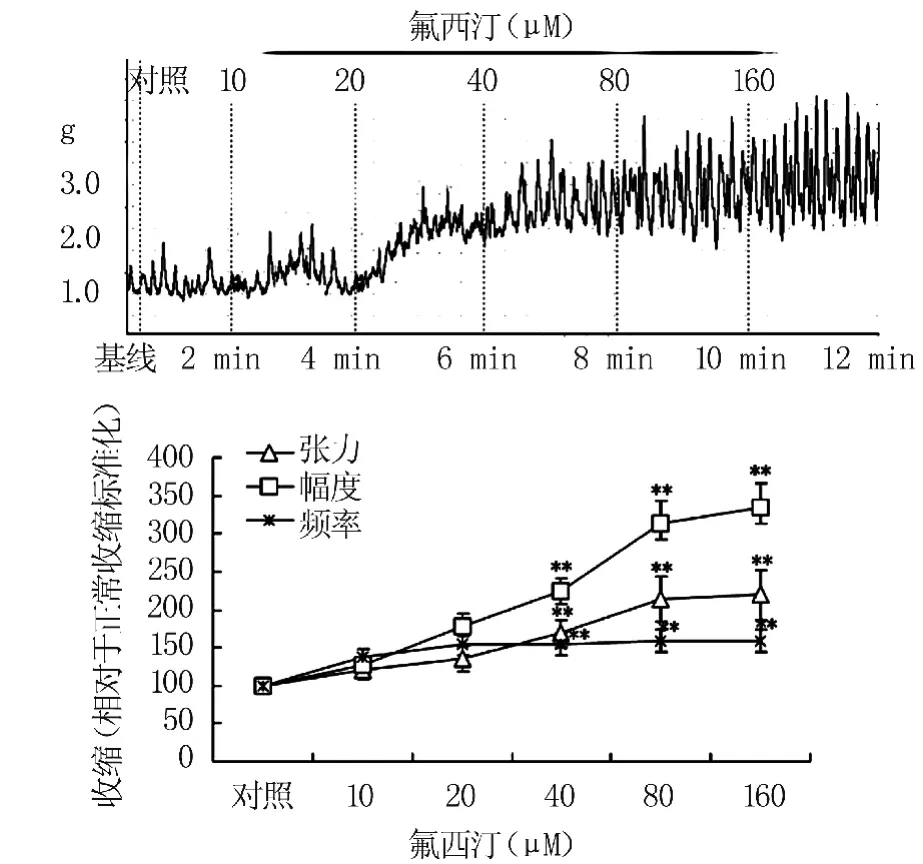
图1 氟西汀对正常大鼠离体结肠平滑肌收缩性的影响
2.2 氟西汀促进结肠收缩性作用与Ca2+以及胆碱能M受体关系研究 在无钙克氏液孵育的基础上,加入160 μM氟西汀,依然无法使结肠平滑肌恢复收缩功能,证实氟西汀对结肠平滑肌收缩的促进作用依赖于细胞外的钙离子的存在。但是,阿托品10 μM不能阻断氟西汀兴奋平滑肌收缩的作用,表明氟西汀兴奋胃肠平滑肌收缩的作用不是通过胆碱能M受体的。见图2。
2.3 氟西汀对大鼠排便习惯作用研究 与对照组比较,氟西汀灌胃2周后,各剂量组大鼠陆续开始出现腹泻现象,表现为排便数目及粪便含水量均显著增加(P<0.01)。见表1。

图2 氟西汀兴奋结肠平滑肌收缩性与细胞外钙离子的关系研究

表1 氟西汀对大鼠排便习惯影响研究
2.4 氟西汀对大鼠结肠组织SERT作用研究 氟西汀对SERT的影响:氟西汀灌胃2周后,结肠SERT含量显著降低,高剂量组结肠SERT含量相较于对照组的100.0% ±11.2% 降低至 21.02% ±1.93%,有显著性差异(P<0.01)。见图3。

图3 氟西汀对五羟色胺转运体(SERT)影响
2.5 氟西汀应用致大鼠炎性腹泻作用研究 氟西汀灌胃2周后,出现腹泻的大鼠结肠中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介质1β(IL-1β)含量显著增加。见图4。结肠组织中一氧化氮(NO)含量显著增加,诱导型一氧化氮合酶(iNOS)含量以及转录因子NF-KappaB含量均显著增加。见图5。
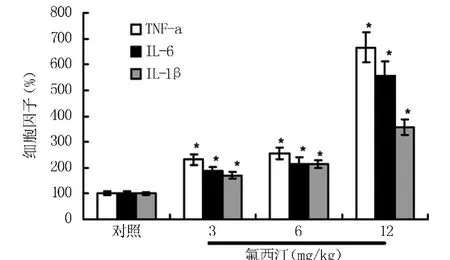
图4 应用氟西汀所致细胞因子的改变

图5 应用氟西汀所致一氧化氮(NO)相关改变
3 讨论
离体实验结果提示,氟西汀剂量-反应依赖性地兴奋了大鼠离体结肠的平滑肌收缩,其兴奋作用依赖于细胞外钙离子的浓度,与胆碱能M受体无关。
胞质内的Ca2+浓度升高时,Ca2+与Ca2+调蛋白结合,生成Ca2+与Ca2+调蛋白的复合物。Ca2+·Ca2+调蛋白复合物与肌球蛋白轻链激酶结合,并使之激活,活化的肌球蛋白轻链激酶使肌球蛋白轻链磷酸化,引起肌球蛋白头部构像的变化,从而导致横桥与细肌丝肌动蛋白的结合,进入横桥周期,肌肉产生收缩[9]。本实验研究结果提示,氟西汀显著增加平滑肌收缩性,其促进收缩的作用在无Ca2+条件下基本消失,提示其兴奋作用依赖于细胞外的Ca2+浓度。
灌胃氟西汀两周后,实验大鼠陆续出现腹泻现象,尤其是高剂量氟西汀组腹泻大鼠的数目比率显著增加,并且粪便含水量以及粪便数目相对于对照组显著增加。
5-HT体系在胃肠动力方面发挥着非常重要的作用,5-HT受体超家族可分为7种亚型和14种亚型。目前已知胃肠道存在5种5-HT受体亚型,分别为5-HT1、5HT2、5-HT3、5-HT4和 5-HT7的受体,其中 5-HT3、5-HT4对于胃肠动力的调节具有相对重要的作用[10]。SERT,即5-HT 转运体,为一种对五羟色胺具有高度亲和力,可重新摄取细胞间隙内的5-HT,从而调节神经信号的转导[10,11]。实验结果提示,灌胃氟西汀两周后,大鼠结肠平滑肌 SERT含量显著下降。SERT含量下降会导致局部5-HT含量增加,5-HT大量堆积于靶点部位,致使胃肠功能出现平滑肌收缩增强性质的胃肠功能紊乱[5],容易导致大鼠排便次数的增加。
在氟西汀导致的腹泻大鼠中研究发现,结肠中细胞因子TNF-α、IL-6以及 IL-1β均出现显著增加,iNOS以及NF-kappaB蛋白含量也显著增加,同样结肠组织中通过Elisa方法检测到的NO含量也显著增加。实验结果提示,氟西汀应用的过程中,可能通过 NF-kappaB通路诱导结肠iNOS表达增加,局部组织中NO含量过大,导致炎性免疫反应的发生,继而诱发炎性腹泻[12]。
本实验采用在体灌胃以及离体组织灌流的方法,考察氟西汀对大鼠胃肠动力改变,从在体和离体的角度证实了氟西汀使用具有增强胃肠动力的作用,但是存在导致炎性腹泻的危险。本实验揭示了氟西汀在使用时出现腹泻等不良反应的可能机制,为以后临床应用氟西汀在降低胃肠道不良反应方面提供科学参考信息。
[1]黎前明.氟西汀治疗癫痫伴发抑郁的疗效和安全性[J].中外医学研究,2013,11:22-23
[2]杨安永.氟西汀引起腹泻1例[J].临床精神医学杂志,2008,18:358
[3]Othman M,Aguero R,Lin HC.Alterations in intestinal microbial flora and human disease[J].Curr Opin Gastroenterol,2008,24:11-16
[4]姚丽艳.抗抑郁药氟西汀、帕罗西汀、度洛西汀和瑞波西汀的比较[J].中国医药指南,2013,11:747-748
[5]王静.5-羟色胺受体及转运体在肠易激综合征发病机制中的作用[J].上海交通大学学报(医学版),2008,28:1051-1054
[6]Cavicchi M,Whittle B.Potentiation of cytokine induced iNOS expression in the human intestinal epithelial cell line,DLD-1,by cyclic AMP[J].Gut,1999,45:367-374
[7]Frings M,Haschke G,Heinke B,et al.Spontaneous contractions of intestinal smooth muscle reaggregates from the new-born rat triggered by thromboxane A2[J].J Vet Med A Physiol Pathol Clin Med,2000,47:469-475
[8]Umer A,Lugowska H,Sein-Anand J,et al.The contractile effects of several substituted short analogues of porcine galanin in isolated rat jejunal and colonic smooth muscle strips[J].Pharmacol Res ,2005,52:283-289
[9]He WQ,Peng YJ,Zhang WC,et al.Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice[J].Gastroenterology,2008,135:610-620
[10]Coates MD,Mahoney CR,Linden DR,et al.Molecular defects in mucosal serotonin content and decreased serotonin reuptake transporter in ulcerative colitis and irritable bowel syndrome[J].Gastroenterology,2004,126:1657-1664
[11]Costedio MM,Coates MD,Brooks EM,et al.Mucosal serotonin signaling is altered in chronic constipation but not in opiateinduced constipation[J].The American journalof gastroenterology.2009,105(5):1173-1180
[12]Wen S,Huang TH,Li GQ,et al.Bromelain improves decrease in defecation in postoperative rats:modulation of colonic gene expression of inducible nitric oxide synthase[J].Life Sci,2006,78:995-1002

