栝楼果皮中腺嘌呤、鸟苷、瓜氨酸动态积累规律研究
于京平,张永清,林海燕,林 莺
1滨州医学院,烟台 264003;2山东中医药大学,济南 250355
栝楼Trichosanthes kirilowii Maxim.为葫芦科多年生草质藤本植物,其干燥成熟果皮是常用中药瓜蒌皮,可清热化痰、利气宽胸,具有抗心律失常、扩张冠状动脉、增加冠脉血流量等药理作用;临床常用于治疗肺热咳嗽、痰浊黄稠、胸痹心痛、肺痈等[1]。
有关瓜蒌皮的活性成分至今不明确,现行《中华人民共和国药典》仅收载了以对照药材薄层定性的鉴别方法,控制瓜蒌皮药材质量尚缺乏合理指标[1]。以瓜蒌皮为原料研制生产的瓜蒌皮注射液可行气除满、开胸除痹,用于治疗痰浊阻络之冠心病、稳定型心绞痛等。我们研究发现,腺嘌呤[2]、鸟嘌呤核苷[2]、瓜氨酸是瓜蒌皮注射液中存在的主要成分之一。现代研究显示,腺嘌呤、鸟苷、瓜氨酸均具有明显的药理活性。腺嘌呤可提高红细胞携氧和放氧能力,与磷酸的结合物可刺激白细胞增生,用于防治白细胞减少症[3];鸟苷可改善心脑血液循环,具有防止心率失常、抗肿瘤、抗病毒等活性[4]。瓜氨酸在体内转化为人体必需氨基酸:L-精氨酸,在维持心血管正常功能的一氧化氮代谢中发挥着重要作用[5]。因此,在活性成分尚不明确的情况下,可以将腺嘌呤、鸟苷、瓜氨酸作为瓜蒌皮药材质量的控制指标。
中药材采收期对保证中药材质量有重要意义,若采收期适宜,则可保证中药材中的药用部分产量和有效成分含量都达到较高水平。目前,有关采收时间对瓜蒌皮药材质量的影响等方面的研究几乎为空白。本文在统一种质的前提下,选取腺嘌呤、鸟苷、瓜氨酸等化学成分作为指标,对栝楼果皮不同生长期化学成分的动态积累进行分析,为确定瓜蒌皮药材的适宜采收期提供科学依据。
1 仪器与材料
1.1 仪器
高效液相色谱仪(Agilent 1200,美国Agilent);超声仪(KQ-200,昆山市超声仪器有限公司);数显鼓风干燥箱(GZX-9070MBE,上海博讯公司);电子天平(FA1104,上海天平仪器厂)。
1.2 瓜蒌皮药材
所用材料采自山东中医药大学药用植物园,经山东中医药大学张永清教授鉴定,确认为葫芦科栝楼属植物栝楼Trichosanthes kirilowii Maxim.。自7月3 日幼果期,在健壮枝条的中段选择花后发育天数相同的栝楼幼果,挂牌标记。自7 月3 日幼果期到10 月26 日果实成熟期共采样11 次,采样时间统一定在晴朗的上午8∶00 时左右。不同生长期栝楼果皮的采收时间及外观性状见表1。

表1 不同生长期栝楼果皮的外观性状Table 1 The morphologic characteristics of T.kirilowii peel from different growth periods
1.3 试剂
对照品:腺嘌呤(批号050302,上海伯奥生物科技有限公司)、鸟苷(批号26-2006,上海中药标准化中心),瓜氨酸(批号0875-200205,中国药品生物制品检定所),经HPLC-UV 检测纯度均达98%以上;邻苯二甲醛(色谱级,阿拉丁试剂上海有限公司);一氯甲酸芴甲酯(色谱级,阿拉丁试剂上海有限公司);乙腈(色谱级,Tedia,美国);甲醇(色谱级,Tedia,美国);纯净水。
2 实验方法
2.1 核苷类成分的测定
2.1.1 色谱条件
色谱柱:Waters Atlantis T3(5 μm,4.6 mm×150 mm);流动相:水(A)-甲醇(B);柱温为室温;检测波长:254 nm;进样量:50 μL。流动相梯度洗脱程序:0~15 min,100%A;15~35 min,100%~90%A;35~60 min,90%~70%A。
2.1.2 对照品溶液制备
精密称取一定量减压干燥至恒重的鸟苷、腺嘌呤对照品,加15%甲醇溶解,转移至20 mL 容量瓶中,定容,混匀,配制成腺嘌呤浓度为0.0310 mg/mL、鸟苷浓度为0.0704 mg/mL 的对照品溶液;以0.45 μm 滤膜滤过,取续滤液备用。
2.1.3 样品溶液制备
将瓜蒌皮置于55 ℃条件下烘干,粉碎,过四号筛。四分法取样,精密称定适量干燥粉末,置具塞瓶中,加15%甲醇10 mL,称重;50 ℃温浸1 h,50 ℃超声提取1 h,冷却,用15%甲醇补足重量,离心10 min(4500 rpm),取上清液,重复提取2 次,合并上清液,用0.45 μm 滤膜滤过,即得。
2.1.4 样品测定
分别精密吸取对照品溶液与样品溶液50 μL,按上述色谱条件测定其峰面积积分值,以外标法计算样品溶液中的鸟苷、腺嘌呤含量,重复3 次。
2.1.5 线性关系考察及标准曲线
制备腺嘌呤、鸟苷对照品系列浓度溶液,分别精密吸取50 μL 进样,按2.1.1 项下色谱条件测定峰面积,以峰面积为纵坐标(Y),以对照品实际进样量(mg)为横坐标(X),绘制标准曲线,腺嘌呤Y=8800000X-7.2062(R2=1),鸟苷Y=3500000X +6.8633(R2=1),见图1。
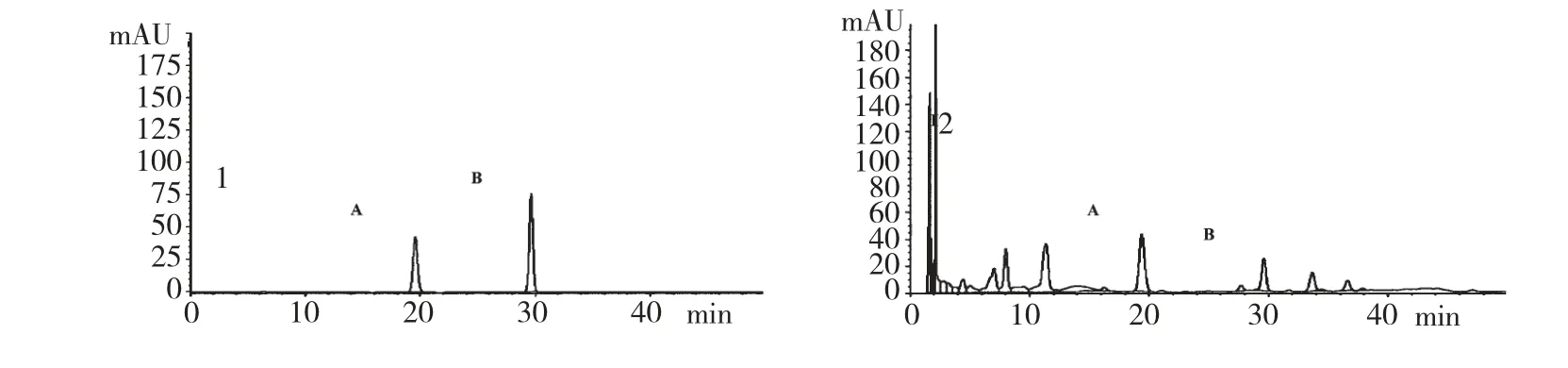
图1 对照品(1)与供试液(2)的HPLC 色谱图Fig.1 HPLC chromatograms of the reference substance (1)and sample (2)
2.2 瓜氨酸的测定
2.2.1 色谱条件
色谱柱:Agilent TC-C18柱(4.6 mm×250.0 mm,5 μm);流动相:取醋酸钠10.88 g,加水4000 mL 使溶解,加三乙胺0.8 mL,四氢呋喃24 mL,混匀,用2%冰醋酸溶液调节pH 值至7.20,即得流动相A;取醋酸钠10.88 g,加水800 mL 使溶解,用2%冰醋酸溶液调节pH 值至7.20,加乙腈1400 mL,甲醇1800 mL,混匀,即得流动相B。柱温:25 ℃;检测波长:338 nm;进样量:50 μL。快速柱前衍生化反应:供试品和对照品溶液在pH10.2 的硼酸缓冲液中首先和1%邻苯二甲醛(OPA)反应,再用0.5%一氯甲酸芴甲酯(FMOC)溶液进行衍生。
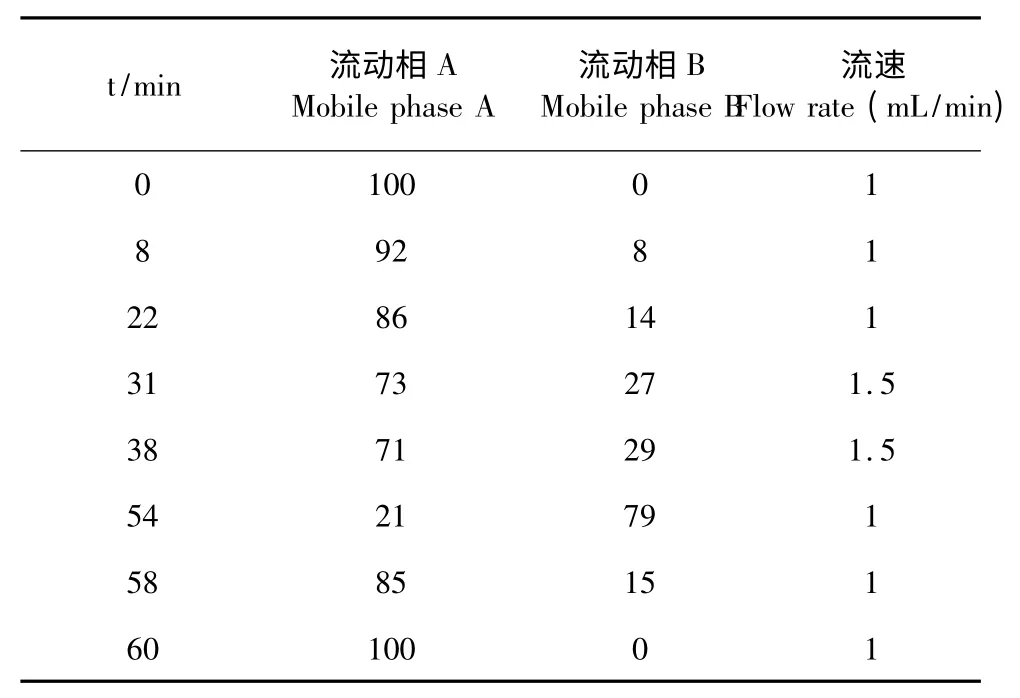
表2 流动相梯度洗脱程序Table 2 Gradient elution program
2.2.2 对照品溶液制备
精密称取一定量减压干燥至恒重的瓜氨酸对照品,加水溶解,转移至20 mL 容量瓶中定容,混匀,配制成浓度为0.368 mg/mL 对照品溶液;以0.45 μm滤膜滤过,即得。
2.2.3 样品溶液制备
精密称定适量干燥粉末,置具塞瓶中,加水10 mL,称重;50 ℃温浸1 h,50 ℃超声提取1 h,冷却,用水补足重量,离心10 min(4500 rpm),取上清液,重复提取2 次,合并上清液,用0.45 μm 滤膜滤过,即得。
2.2.4 样品测定
分别精密吸取对照品溶液与样品溶液50 μL,按上述色谱条件测定其峰面积积分值,以外标法计算样品溶液中的瓜氨酸含量,重复3 次。
2.2.5 线性关系考察及标准曲线
制备瓜氨酸对照品系列浓度溶液,分别精密吸取50 μL 进样,按2.2.1 项下色谱条件测定峰面积,以峰面积为纵坐标(Y),以对照品实际进样量(mg)为横坐标(X),绘制瓜氨酸标准曲线,Y=2000000X-1.3675(R2=1),见图2。
2.3.1 精密度试验
精密吸取对照品溶液,按2.1.1、2.2.1 项下色谱条件,测定腺嘌呤、鸟苷、瓜氨酸峰面积,重复5

图2 对照品(1)与供试液(2)的HPLC 色谱图Fig.2 HPLC chromatograms of the reference substance (1)and sample (2)
2.3 方法学考察次,其峰面积RSD 分别为1.17%、
2.3.2 稳定性试验
精密吸取样品溶液,在10 h 内测定腺嘌呤、鸟苷、瓜氨酸峰面积5 次,其峰面积RSD 值分别为2.12%、1.12%、1.00%,表明样品溶液在10 h 内稳定。
2.3.3 重复性试验
精密称取药材粉末,分别按照2.1.3、2.2.3 项下方法同时制备5 份,分别测定腺嘌呤、鸟苷、瓜氨酸含量,其RSD 均小于5%,表明重复性良好。
2.3.4 加样回收率试验
精密称量已知鸟苷、腺嘌呤、瓜氨酸含量的样品1.000 g,共6 份,分别加入一定量的对照品,分别按照2.1.3、2.2.3 项下方法制备,按2.1.1、2.2.1 项下色谱条件测定鸟苷、腺嘌呤、瓜氨酸含量,按回收率=(C-A)/B ×100%(A 为样品中所含被测成分量;B 为加入对照品量;C 为实测值)计算回收率,结果鸟苷、腺嘌呤、瓜氨酸对照品回收率均值分别为101.20%、100.67%、100.15%,其RSD 分别为1.63%、1.91%,1.70%,表明鸟苷、腺嘌呤、瓜氨酸对照品回收率符合要求。
3 结果与分析
3.1 不同生长期栝楼果皮鸟苷、腺嘌呤含量的测定及比较
对栝楼果皮生长发育过程中鸟苷、腺嘌呤含量进行动态测量,变化情况动态如图3。
由图3 可以看出,生长发育前期腺嘌呤、鸟嘌呤核苷含量总体呈下降趋势,9 月中旬果实体积、重量基本达到最大时,两者含量达到最低点;之后腺嘌呤、鸟苷快速积累,至果皮表面颜色稍微泛黄时,腺嘌呤含量达到最高值0.1893 mg/g,至果皮表面颜色基本全黄、仅维管束凸起处为绿色时鸟苷含量达到最高值0.4128 mg/g;随着果实进一步成熟,两者含量均出现下降,表现出随着果实成熟度增加而下降的变化趋势。
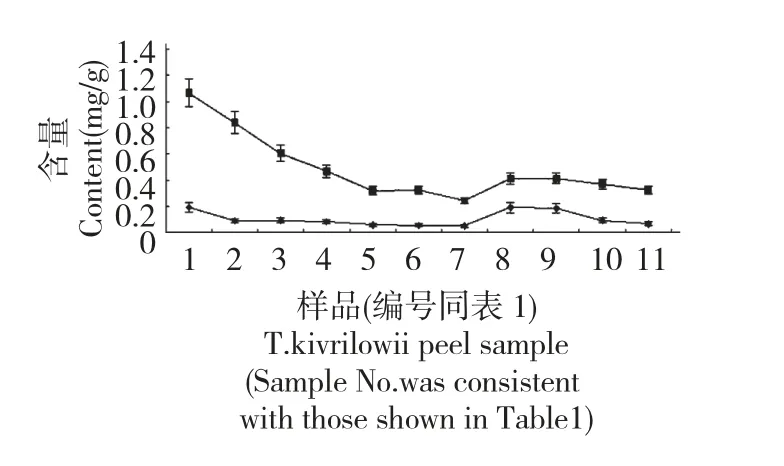
图3 不同生长期栝楼果皮腺嘌呤、鸟苷含量的变化Fig.3 The contents of adenine and guanine nucleoside in T.kirilowii peel from different growth periods
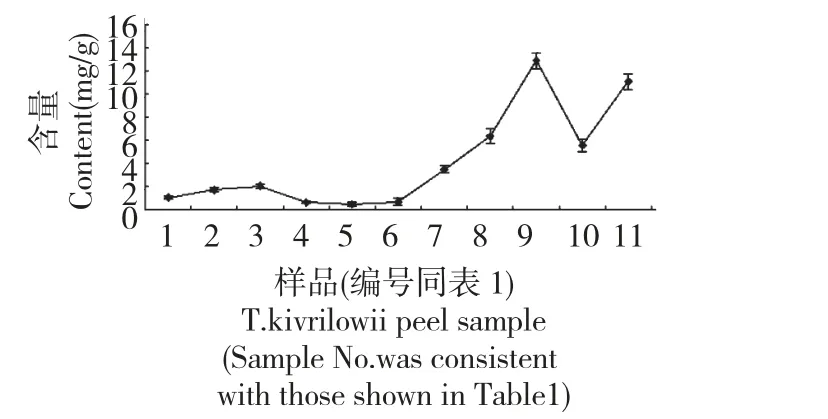
图4 不同生长期栝楼果皮瓜氨酸含量的变化Fig.4 The contents of citrulline in T.kirilowii peel from different growth periods
3.2 不同生长期栝楼果皮瓜氨酸含量的测定及比较
对栝楼果皮生长发育过程中瓜氨酸含量进行动态测量,变化情况动态如图4。
由图4 可以看出,瓜氨酸含量短暂升高之后平稳降低,8 月17 日达到最低仅为0.4492 mg/g,之后呈现逐渐升高,至果皮颜色基本为黄色仅维管束凸起部分为绿色,此时瓜氨酸含量达到最高值12.8834 mg/g,随着果实进一步成熟至果皮表面颜色基本全黄含量下降,至栝楼果实完全成熟果皮表面皱缩时含量稍微上升。
4 讨论与小结
4.1 栝楼果实生长动态
栝楼果实从形成到成熟呈现出生长动态规律变化,经历果实重量、果实体积、果实长、果实直径的增大、果实变软、果皮颜色变化等一系列变化。9 月26日果皮颜色稍微泛黄标志着栝楼果实进入转色期。
4.2 栝楼果皮生长过程中化学物质积累动态
我们系统研究栝楼果皮整个生长周期多种化学成分含量变化规律,进一步探讨栝楼果皮化学物质积累与生长发育的关系。果皮中腺嘌呤含量在果皮颜色微黄时达到最高;鸟苷、瓜氨酸含量在果皮颜色基本全黄仅维管束凸起处为绿色时达到最高;总的来说未完全成熟的栝楼果皮中的化学物质含量高于完全成熟的栝楼果皮,多种化学成分含量变化与果皮颜色转变密切相关。
4.3 采收期的确定
采收是药材生产过程中的重要环节,直接影响着瓜蒌皮药材的质量与产量,中药材的采收应综合考虑有效成分含量和产量的动态变化,最大限度保证中药材中的药用部分产量和有效成分含量均达到较高水平。针对栝楼果皮采收期没有明确记载,传统采收期多以栝楼果实为目标产物。栝楼果皮采收期与有效成分的动态累积有何内在关联,亦未见系统研究报道。结合实验结果我们认为果皮颜色未转黄之前是栝楼果皮生长和积累的重要时期,不宜采收;栝楼果皮应于10 月初果实尚未完全成熟时、果皮表面颜色基本为黄色仅维管束凸起处为绿色时采摘,此阶段栝楼果皮多种化学成分含量均达到最高峰;不宜过迟,否则果实老熟,皮薄,产量质量均下降。
不同采收时间瓜蒌皮药材质量有明显差异,获得高产质优的瓜蒌皮药材,需要精确到距离开花后的具体天数,之前提到由于其开花结果时间不一致,精确开花后的具体天数实践操作复杂;但通过果皮颜色变化药农就可以准确快速判断最佳采收时间,获得高产质优的瓜蒌皮药材,生产上直观性强。另外在采收时我们可以做到分批选择性采收,有效降低采收难度。
综上所述,栝楼为多年生藤本植物开花挂果持续时间长,目前栝楼果皮发育过程中化学物质积累规律等方面的研究尚为空白。栝楼果皮在发育和成熟过程中发生了很多结构和代谢上的变化,我们通过了解各种化学物质在栝楼果皮生长发育过程中的积累规律,探索栝楼果皮品质的形成规律,提示我们通过制定合理的栽培措施调控其化学物质含量具有可行性。
1 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,52.
2 Teng YR(滕勇荣).Studies on chemical constituents of Trichosanthes kirilowii Marim.and Trichosanthes skin injection.Jinan:Shandong University of Chinese Medicine(山东中医药大学),MSc.2011.
3 Xu HY(徐红颖).Determination of content of adenine in Isatidis RADIX.Inner Mongolia Petrochem Ind (内蒙古石油化工),2012,13:5-6.
4 Kinahan JJ,KowaL EP,Grindey GB.Biochemical and antitumor effects of the combination of thymidine and 1-β-D-arabinofuranosylcytosine against leukemia L1210.Cancer Res,1981,41:445-451.
5 Liu J(刘娟),Lu XX(路欣欣),Meng H(孟慧).Progress on pharmacological activities and production methods of citrulline.J Pharm Prac(药学实践研究),2011,32:173-175.

