天然斜发沸石吸附铅(Pb2+)机理
邵卫云,易文涛,周永潮,张 萍
(浙江大学 建筑工程学院 浙江省饮用水安全与输配技术重点实验室,浙江 杭州310058)
铅是一种在环境中易转移、不可生物降解的有害重金属,它在生物体内易于富集,对神经系统和内脏器官会产生不良影响.Pb2+的去除方法有多种,如吸附法[1]、化学沉淀、离子交换、膜分离、电化学法[2]和依靠植物吸收的生态处理方法[3]等.其中,沸石吸附法因其价格低廉、方法有效,在水处理行业中得到了广泛的应用.
沸石可以认为是一种由一定数量的Al3+取代Si4+所形成的含水架状结构的多孔硅铝酸盐矿物质.通常沸石为硅氧四面体和Al3+取代Si4+后形成的铝氧四面体结构,即以硅原子、铝原子为四面体中心,周围由4 个氧原子所包围.由于铝原子呈+3价,铝氧四面体中有一个氧原子的价电子没有得到中和,使其呈-1价状态.为了保持其整体电性的中和,其四面周围必须有一个带正价的阳离子(阳离子通常是Na+、K+、1/2Ca2+)[4].这些阳离子和铝硅酸盐结合力比较弱,因此具有很大的流动性,极易与周围水溶液中的阳离子发生离子交换作用[5-6].沸石的这种结构决定了它具有较大的静电引力和较强的离子交换性[6],因此沸石对重金属的去除可能包含着多种作用.Jenne等[7-8]的研究表明:沸石对重金属的去除机理主要包括离子交换和化学吸附作用,其中离子交换可能包含2种形式:金属离子与沸石表面羟基官能团中的质子发生交换;金属离子与沸石表面具有较强流动性的阳离子(Na+、K+、Ca2+等)发生交换[5,7,9].金属离子与沸石表面羟基发生的络合反应存在化学吸附作用,化学吸附通常包括表面络合作用和内部络合作用.相比表面络合作用,通常认为内部络合作用更加稳定,并且沸石与金属离子间的结合更加紧密[8,10].但是,Castaldi等[11]的研究并没有发现反应中有羟基络合物生成,他们认为斜发沸石对重金属离子的吸附为物理吸附和离子交换作用,并且除了表面吸附作用外,部分金属离子可能以脱水的形式扩散到微孔中.
由于沸石对Pb2+的吸附是一个非常复杂的过程,在不同初始浓度的重金属溶液与反应时间下,沸石对重金属的吸附主导机制存在动态差异性.为了更好地了解沸石吸附机理,本文以铅溶液为去除对象,进行高质量浓度、低质量浓度铅溶液下的沸石吸附及脱附实验,分析不同阶段沸石对Pb2+的吸附主导机制,探讨天然斜发沸石对Pb2+的动态吸附机理,为沸石对重金属的高效去除奠定理论基础.
1 实验材料与方法
1.1 实验材料与方法
实验所用的天然斜发沸石来自河南省巩义市元亨净水材料厂,沸石用去离子水洗净后,低温烘干后碾成粉末,过直径为0.2mm 的尼龙筛.实验所用的NaCl、Pb(NO3)2和NaOH 为 分 析 纯,HNO3为优级纯.
实验所用振荡装置为IKA ks4000i控制型恒温摇床,水样中Pb2+的测定采用原子吸收光谱仪(AAS,Thermofisher Scientific ice3500),溶 液 的pH 测定使用Thermofisher Scientific Orion3-star pH计,X射线衍射(XRD)分析使用X’pert PRO X 射线衍射仪.
1.2 Pb2+的吸附与脱附实验
等温吸附线可以很好地估算天然斜发沸石对Pb2+的吸附性能.取0.5g沸石粉加入塑料瓶中,分别加入不同初始质量浓度的铅溶液100 mL,Pb2+的初始质量浓度设置为0~124.32mg/L,调节pH值为5.7(此时铅均为游离态),振荡12h 后使用0.45μm孔径的微孔滤头抽滤取样,加稀硝酸后使用AAS检测.
为了探究NaCl和HNO3脱附的合适的物质的量浓度,分别设置NaCl和HNO3的脱附实验.取0.5g沸石粉吸附100mL质量浓度为82.88mg/L的铅溶液,饱和后再用0.45μm 孔径的滤膜真空抽滤,45℃烘干后得沸石粉,加入100mL不同初始物质的量浓度的NaCl溶液进行脱附,NaCl的初始物质的量浓度设置为0~1.0mol/L,振荡12h后取样检测溶液中Pb2+的质量浓度,选择对应最大脱附量的NaCl的物质的量浓度.取0.5g沸石粉吸附100 mL 82.88mg/L的铅溶液,饱和后采用0.5mol/L 的NaCl溶液脱附,再采用100mL不同初始物质的量浓度的HNO3溶液进行脱附,HNO3初始物质的量浓度设置为0~2.0mol/L,振荡12h后取样检测,选择对应最大脱附量的HNO3物质的量浓度.
沸石对Pb2+的吸附情况随着时间[8]和Pb2+的初始质量浓度的变化而变化[12],为了探究沸石在高质量浓度铅溶液(达到饱和吸附容量)和低质量浓度铅溶液(未达到饱和吸附容量)中的吸附机理随时间的变化情况,取0.5g沸石粉分别吸附100mL 82.88 mg/L的铅溶液和31.08mg/L的铅溶液,分别对吸附反应进行5、10、15、20、30、45、60、120、180、240、300、420、540 以 及720 min时 的 沸 石 依 次 使 用0.5 mol/L的NaCl溶液和0.05mol/L的HNO3溶液进行脱附,均振荡12h后依次取样检测.以上所有实验均设置3组平行实验,摇床温度为30 ℃,转速为200 r/min.
2 实验结果
2.1 等温吸附试验
沸石对重金属的吸附量由以下公式计算:
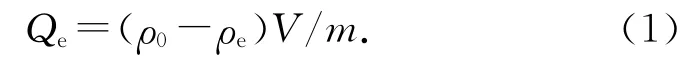
式中:Qe为平衡时沸石对Pb2+的吸附量,ρ0 为铅溶液的初始质量浓度;ρe 为平衡时溶液中Pb2+的质量浓度;V 为溶液的体积;m 为沸石的质量.
描述等温吸附线的模型有多种,常用的等温吸附模型有Langumir吸附模型、Freundlich 吸附模型[13]和Dubinin-Radushkevich(D-R)理论模型,其中,D-R 理论模型从宏观上阐释了吸附机理,认为吸附机理更为有效[14].D-R 等温线模型如下:

式中:Qm为饱和吸附量;β为活度系数,与吸附能力有关;ε为吸附势,R 为气体平衡常数;T 为绝对温度;E为吸附剂吸附单位摩尔吸附质的吸附能[15].使用Origin 8.6软件对D-R 方程进行非线性拟合,得到Qm=9.63mg/L,E =3.13kJ/mol,相关系数r2=0.904.通常认为,E<8kJ/mol是物理吸附过程,8 kJ/mol<E<16kJ/mol是离子交换过程[14-16].30 ℃时Pb2+离子的等温吸附曲线如图1所示.当Pb2+的质量浓度ρ(Pb)=82.88mg/L时,沸石已经达到最大饱和吸附量;当ρ(Pb)=31.08mg/L时,沸石并没有达到最大饱和吸附量.因此,后续实验选择这2种质量浓度来研究沸石对Pb2+的吸附机理变化情况.
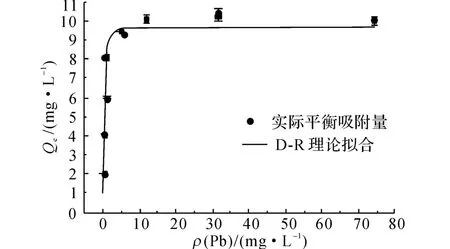
图1 30 ℃时Pb2+的等温吸附曲线Fig.1 Adsorption isotherms of Pb2+at 30 ℃
2.2 NaCl和HNO3 的脱附实验
天然斜发沸石具有良好的离子交换性能,Mozgawa等[10-11,17]使用盐溶液脱附吸附饱和后的沸石来表征沸石的离子交换性能,由于天然斜发沸石具有交换性能的阳离子主要为K+和Na+,本研究选用NaCl进行脱附[10].
NaCl脱附曲线如图2 所示,可以看出,当c(NaCl)=0.5mol/L时,12h后Pb2+的脱附量已经达到最大,因此后续实验中采用0.5mol/L的NaCl进行脱附实验.在实验开始一段时间内,溶液中Pb2+的脱附量m(Pb)与c(NaCl)几乎成正比,相关的线性拟合精度达到0.99,并且Pb2+的脱附量迅速达到平衡.这说明该部分脱附的Pb2+几乎全部由Na+交换出来的,相应地,可以认为该部分Pb2+通过离子交换吸附.
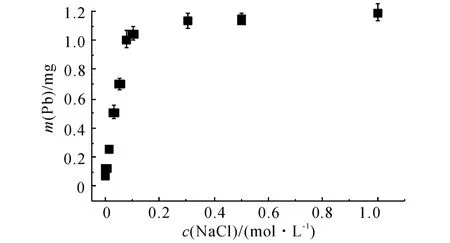
图2 不同NaCl浓度时的铅脱附量曲线Fig.2 Desorption of Pb2+on clinoptilolite at different concentrations of NaCl
HNO3的脱附实验如图3 所示.可以看出,HNO3具有较好的脱附性,HNO3和NaCl大概能够脱附出全部吸附铅的90%;在各个阶段,HNO3的脱附量均远大于NaCl的脱附量.随着HNO3浓度的增加,沸石在HNO3的物质的量浓度为0.05 mol/L时就达到稳定的脱附量,此后即使HNO3的物质的量浓度高达2mol/L,仍有剩余10%的Pb2+无法脱附出来.这说明沸石对Pb2+的吸附过程比较复杂,这部分未脱附的Pb2+与沸石结合比较紧密.
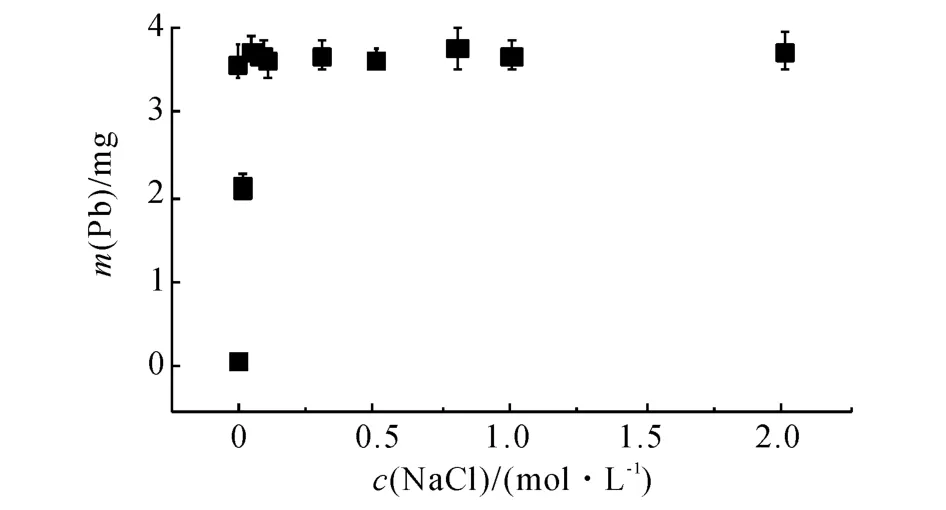
图3 不同HNO3 浓度时的铅脱附量曲线Fig.3 Desorption of Pb2+on clinoptilolite at different concentrations of HNO3
2.3 高质量浓度动态脱附实验
在高质量浓度的铅溶液中,Pb2+的脱附情况如图4、5所示.图4的横坐标t为吸附反应进行的时间.图5的横坐标γ与吸附反应进行的时间相对应,纵坐标P 表示Pb2+的脱附百分比:
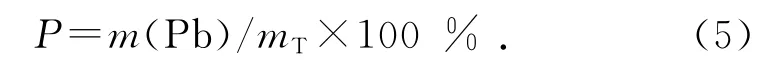
式中:mT为Pb2+的总吸附量.由图4中NaCl脱附的铅量曲线可以发现,在吸附反应进行5 min 后,NaCl脱附的铅量不再随着吸附反应的进行而增加,此时q =1.09mg,这说明沸石对该部分Pb2+的吸附非常迅速,几乎在5min内完成,因此离子交换过程非常迅速.由图5可知,NaCl脱附的铅量百分比在γ=12(t=420min)前呈下降趋势,由γ=1(t=5min)时的34%下降到γ=12(t=420 min)时的21%,而后P=21%,保持不变.
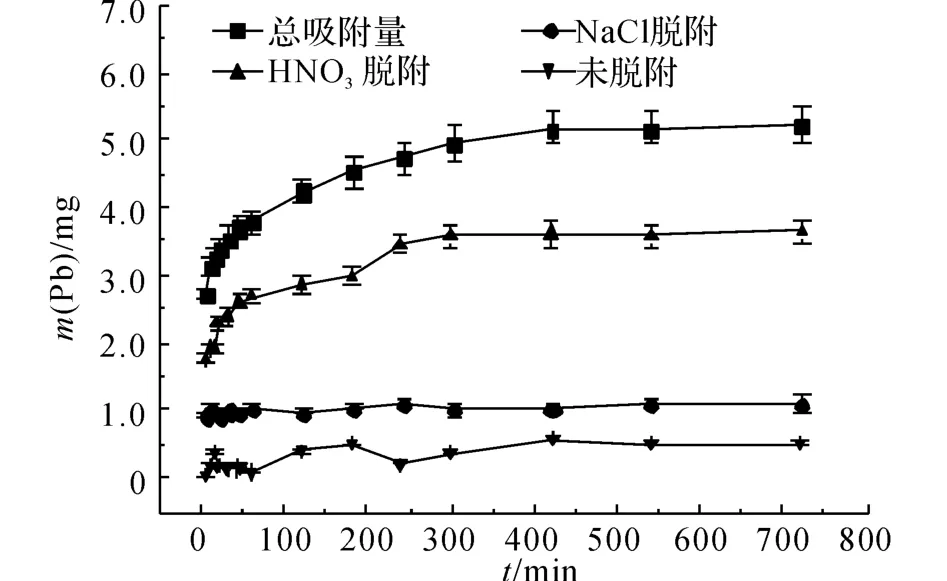
图4 高质量浓度铅溶液中Pb2+的脱附量Fig.4 Mounts of desorpted Pb2+in lead solution of high initial mass concentration
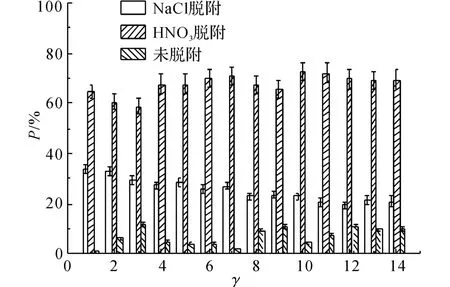
图5 高质量浓度铅溶液中Pb2+的脱附百分比(γ 值与取样时间相对应)Fig.5 Percentages of desorpted Pb2+in lead solution of high initial mass concentration(values ofγcorrespond to sample time)
由HNO3脱附的铅量曲线可以看出,在γ=1(t=5min)时,Pb2+具有较大的初始脱附量,说明沸石对该部分Pb2+的吸附比较迅速;而后,Pb2+的脱附量缓慢增加,最终在t=300 min时达到平衡,其脱附量由起始的1.7mg增加到平衡时的3.6mg,在吸附平衡时P=69%.未脱附出来的Pb2+占10%左右,这部分Pb2+的脱附量在t=420 min时不再变化,相应地此时对该部分Pb2+的吸附量不再增加达到平衡.这与总的吸附过程在420 min时达到平衡是一致的.
2.4 低质量浓度动态脱附实验
低质量浓度时Pb2+的脱附情况如图6、7所示.同样地,由NaCl脱附的铅量曲线可以发现离子交换过程进行得非常迅速,几乎在t=5 min 前基本完成,q=1.10mg,这 与 高 质 量 浓 度 铅 溶 液 中(ρ(Pb)=82.88mg/L)Pb2+的脱附量基本一致.由图7可知,NaCl对Pb2+的脱附百分比基本不变,保持在36%~39%.
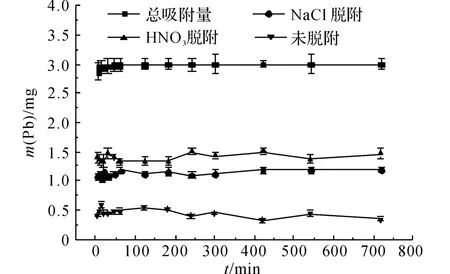
图6 低质量浓度铅溶液中Pb2+的脱附量Fig.6 Mounts of desorpted Pb2+in lead solution of low initial mass concentration
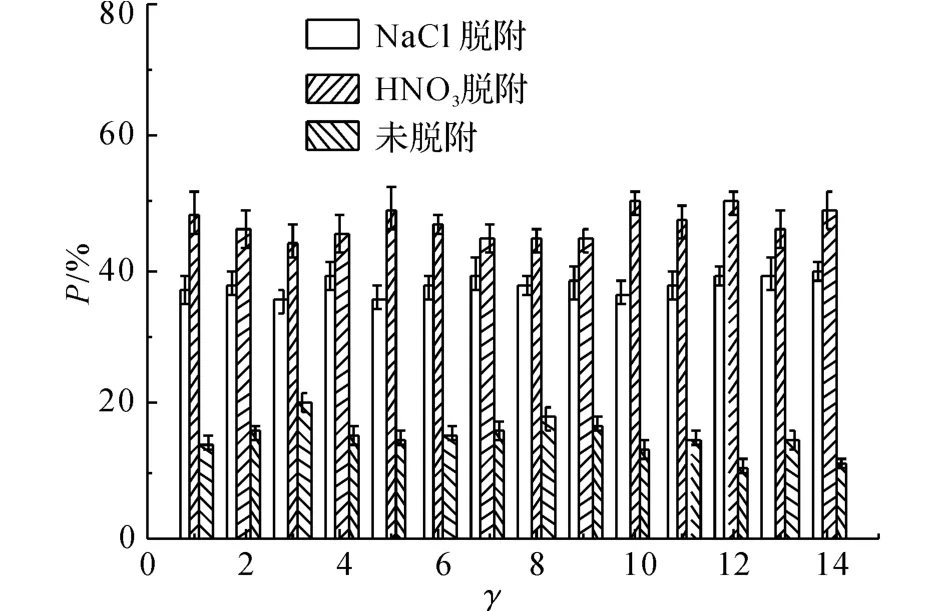
图7 低质量浓度铅溶液中铅离子的脱附百分比(γ值与取样时间相对应)Fig.7 Percentages of desorpted Pb2+in lead solution of low initial mass concentration(values ofγcorrespond to sample time)
由图6可以看出,当t=5 min时,HNO3脱附的铅量就达到1.40mg,此后基本不变,这说明该部分Pb2+在t=5min时就达到吸附平衡,最终达到吸附平衡时P=48%.
未脱附出来的Pb2+占12%左右,这部分Pb2+的脱附量在t=45min时不再变化,此时对该部分Pb2+的吸附达到平衡.同样地,这与总吸附过程在45min时达到平衡是一致的.
2.5 XRD 分析实验
如图8所示为原始沸石和吸附进行12h后沸石的XRD 谱图,其中2θ表示衍射角,I表示衍射强度.由图8可知,在高质量浓度和低质量浓度情况下,吸附前后的沸石晶体结构与XRD 衍射峰的强度均未发生明显的变化,实验中并未发现有新的峰产生,相关检索也并未发现有Pb2+的羟基络合物生成.
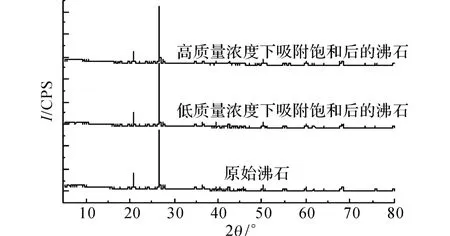
图8 沸石的X射线衍射谱图Fig.8 X-ray diffraction patterns of clinoptiololite
3 讨 论
由D-R 理 论 拟 合 所 得 的E 值(E =3.13kJ/mol)处于物理吸附范围,同时XRD 分析未发现有Pb2+的络合物生成,因此,从总体上看,沸石对Pb2+的吸附机理主要包含物理吸附和离子交换过程.而由离子交换作用吸附的Pb2+已经由NaCl脱附出来,那么通过HNO3脱附的Pb2+是由于物理吸附作用而吸附的.由图4、6 可知,整个吸附过程中HNO3脱附的铅量都比NaCl脱附的铅量大,可以认为物理吸附在整个吸附过程中占主导地位.
在高质量浓度(ρ(Pb)=82.88 mg/L)和低质量浓度(ρ(Pb)=31.08 mg/L)的Pb2+溶液中,当t=5min时,2种质量浓度下的离子交换量均不再增加,可见离子交换过程的进行均非常迅速,几乎在t=5min前完成.由此可推测离子交换过程主要发生在沸石外表面,使得Pb2+比较容易到达并且两者的结合比较容易,导致Pb2+很容易就从沸石表面脱附下来,使得离子交换具有可逆性.由于t=5 min时,总的吸附反应并未达到平衡,因此,随着吸附的进行,离子交换的吸附百分比随着时间逐渐降低,直至总吸附达到平衡后,其所占的百分比才保持不变.在高质量浓度和低质量浓度铅溶液中,交换的铅量基本一致,可见离子交换过程受溶液中Pb2+质量浓度的影响不明显.由于高质量浓度铅溶液中,沸石的总吸附量更高,相对于高质量浓度,低质量浓度的情况下离子交换所占百分比更大,作用更明显.
由高质量浓度和低质量浓度铅溶液中HNO3的脱附曲线可知,在低质量浓度铅溶液中,吸附反应在5min后,物理吸附过程就达到平衡,而在高质量浓度铅溶液中,5 min后由物理作用吸附的铅仍在缓慢增加.这说明铅溶液的初始质量浓度差异导致了这一现象,可推知在高质量浓度铅溶液中,铅离子不仅在沸石外表面与相关吸附位发生吸附作用,还会扩散到微孔中并在其表面发生吸附作用,由于扩散作用比较缓慢,耗时较长,物理吸附作用达到平衡所需的时间更长.而在低质量浓度的铅溶液中,Pb2+的质量浓度梯度无法克服进入微孔的阻力,即使溶液中仍存在剩余的Pb2+,沸石也无法达到饱和吸附容量.因此,在微孔表面发生的物理吸附作用受铅溶液的质量浓度影响较大,相对于低质量浓度的铅溶液而言,高质量浓度铅溶液中的物理吸附所占百分比更高,效应更显著.
关于未脱附出来的Pb2+,有学者认为Pb2+进入沸石晶格空间中的笼型结构和通道中,在笼型结构中结合比较紧密,故很难脱附出来[11,18].实验中发现未脱附的Pb2+量随着时间的变化比较明显,相对于离子交换和物理吸附过程,该过程达到平衡所需时间较长,因此沸石对该部分Pb2+的吸附决定总吸附达到平衡的时间.
4 结 论
(1)该天然斜发沸石对Pb2+的吸附包括物理吸附和离子交换作用,其中物理吸附占主导地位,实验中并未发现化学吸附作用.
(2)离子交换作用主要发生在沸石外表面,该过程发生比较迅速,达到平衡时间较短.离子交换量受铅溶液的初始质量浓度的影响不大.在低质量浓度铅溶液中,离子交换所占的百分比更高,效应更显著.
(3)物理吸附作用受铅溶液的初始质量浓度影响较大.在低质量浓度铅溶液中,物理吸附主要发生在沸石外表面,吸附作用比较迅速,在短时间内就达到平衡.在高质量浓度铅溶液中,由于扩散还会发生在微孔中,物理吸附的发生程度取决于溶液中Pb2+的浓度梯度与微孔扩散阻力的平衡关系,微孔中发生的物理吸附过程则比较缓慢.在高质量浓度的铅溶液中,物理吸附所占百分比更高,作用更明显.
(4)部分Pb2+由于与沸石结合比较紧密,无法脱附出来,该过程的进行比较缓慢,决定总吸附达到平衡的时间.
(5)随着吸附反应的进行,在高质量浓度的铅溶液中,离子交换所占百分比逐渐降低,相对于物理吸附作用逐渐减弱,而物理吸附作用相对逐渐增强,直至吸附达到平衡;在低质量浓度的铅溶液中,离子交换和物理吸附作用均很快达到平衡,随后两者的相对作用基本保持不变.
(
):
[1]SPRYNSKYY M,BUSZEWSKI B,TERZYK A P,et al.Study of the selection mechanism of heavy metal(Pb2+,Cu2+,Ni2+,and Cd2+)adsorption on clinoptilolite[J].Journal of Collide and Interface Science,2006,304(1):21-28.
[2]FU F L,WANG Q.Removal of heavy metal ions from wastewaters:a review[J].Journal of Environmental Management,2011,92(3):407-418.
[3]LORESTANI B,YOUSEFI N.CHERAGHI M,et al.Phytoextraction and phytostabilization potential of plants grown in the vicinity of heavy metal-contaminated soils:a case study at an industrial town site[J].Environmental monitoring and Assessment,2013,185(12):10217-10223.
[4]ERDEM E,KARAPINAR N,DONAT R.The removal of heavy metal cations by natural zeolites[J].Journal of Collide and Interface Science,2004,280(2):309-314.
[5]MONTOYA V H,PEREZ-CRUZ M A,MENDOZACASTILLO D I,et al.Competitive adsorption of dyes and heavy metals on zeolitic structures[J].Journal of Environmental Management,2013,116:213-221.
[6]方火明.改性沸石对水中铅的去除技术研究[D].上海:同济大学,2009:6-8.FANG Huo-ming.Study on the methods for removing Pb2+in water by modified zeolite[D].Shanghai:Tongji University,2009:6-8.
[7]JENNE E.Adsorption of metals by geomedia:variables,mechanism and model applications[M].San Diego:Academic Press,1998:68-79.
[8]MOZGAWA W,BAJADA T.Spectroscopic study of heavy metals sorption on clinoptilolite[J].Physics and Chemistry of Minerals,2005,31(10):277-286.
[9]WANG S,ARIYANTO E.Competitive adsorption of malachite green and Pb ions on natural zeolite[J].Journal of Colloid and Interface Science,2007,34(1):25-31.
[10]MOZGAWA W,KROL M,BAJDA T.Application of IR spectra in the studies of heavy metal cations on natural sorbents [J].Journal of Molecular Structure,2009,924:427-433.
[11]CASTALDI P,SANTONA L,ENZO S.Sorption processes XRD analysis of a natural zeolite exchanged with Pb2+,Cd2+and Zn2+cations[J].Journal of Hazardous Materials,2008,156(1-3):428-434.
[12]KRAGOVIC M,DAKOVIC A,SEKULIC Z,et al.Removal of lead from aqueous solutions by using the natural and Fe(III)-modified zeolite[J].Applied Surface Science,2012,258(8):3667-3673.
[13]相波,李义久.吸附等温式在重金属吸附性能研究中的应用[J].有色金属,2007,59(1):77-80.XIANG Bo,LI Jiu-yi.Application of isothermal adsorption equations of to heavy metal ions adsorption phenomenon[J].Nonferrous Metals,2007,59(1):77-80.
[14]ZHANG J H,FU H,LV X S,et al.Removal of Cu(II)from aqueous solution using the rice husk carbons prepared by the physical activation process[J].Biomass and Bioenergy,2011,35(1):464-472.
[15]XU D,TAN X L,CHEN C L,et al.Adsorption of Pb(II)from aqueous solution to MX-80 bentonite:effect of pH,ionic strength,foreign ions and temperature[J].Applied Clay Science,2008,41(1/2):37-46.
[16]ZHU C S,WANG L P,CHEN W B.Removal of Cu(II)from aqueous solution by agricultural by-product:Peanut hull[J].Journal of Hazardous Materials,2009,168(2/3):739-746.
[17]MON J,DENG Y,FLURY M,et al.Cesium incorporation and diffusion in cancrinite,sodalite,zeolite,and allophane[J].Microporous and Mesoporous Materials,2005,86(1-3):277-286.

