鱼腥藻PCC7120质粒上毒素-抗毒素基因对alr9029/asr9028的初步研究
陈思礼,吴汇兰,陈 洁
(中南民族大学 生命科学学院,武汉 430074)
鱼腥藻PCC7120质粒上毒素-抗毒素基因对alr9029/asr9028的初步研究
陈思礼,吴汇兰,陈洁
(中南民族大学 生命科学学院,武汉 430074)
摘要指出了大肠杆菌的毒素-抗毒素系统(TAs)能介导解离后致死机制维持细菌质粒的稳定性和参与环境胁迫诱导细菌生长抑制或死亡,在鱼腥藻PCC7120质粒上的基因对alr9029/asr9028具有与TA系统较高的同源性.为了证实该基因对属于TA系统,通过生物信息学分析了alr9029/asr9028的遗传结构,设计特异性引物,扩增得到大小为198 bp的asr9028和387 bp的alr9029. PCR产物经BamH I和Hind Ш 双酶切后被插入pMD18-T和pET-30a中,依次构建克隆载体和表达载体. 经SDS-PAGE电泳检测,含有His6标签的表达蛋白相对分子量分别为12.4 kDa和19.2 kDa,且为可溶性蛋白. 故初步认定asr9028为抗毒素基因,alr9029为毒素基因,二者共同构成一个TA系统.
关键词鱼腥藻PCC7120;TA系统;alr9029;asr9028
TA系统广泛存在于原核生物体中,由分别编码稳定的、具有功能的毒素蛋白和不稳定抗毒素蛋白的两个基因组成[1].毒素主要在转录、翻译及膜结构的形成过程中发挥作用,而抗毒素蛋白能通过与毒素形成复合体而抑制其毒性[2].普遍认为质粒上的TA系统能介导解离后致死机制使质粒稳定遗传或抵抗不相容质粒的入侵[3-5],而染色体上的TA系统是基因水平转移进化而来[6,7],尽管推测II型系统是压力应答模块,尚无充分证据证明这一推论.
随着大量生物体全基因组的完成和公布,生物信息学分析发现,在鱼腥藻PCC7120的染色体和质粒上存在着大量的TA系统,但只有极少数TA系统被鉴定,且相关功能的研究进展缓慢.分析鱼腥藻PCC7120质粒上的TA系统发现,质粒Epsilon上基因对alr9029-asr9028与大肠杆菌中的Phd-Doc家族同源,alr9029具有Doc的保守结构域,而asr9028有RHH1结构域可与DNA结合,故推测alr9029-asr9028属于TA家族.本文分别克隆了asr9028基因和alr9029基因,并插入带有His6融合标签的载体pET-30a中构建了表达载体并诱导蛋白表达,初步研究了其相关分子生物学的特征,旨在完善鱼腥藻TA系统鉴定,为后续功能研究奠定基础.
1材料与方法
1.1材料和仪器
PCC7120(Anabaenasp.PCC7120) 购于中国科学院水生生物研究所,由中南民族大学生命科学学院病原分子生物学研究室保存,在BG 11培养基中26 ℃和100 μmol photons/(m2·s)的光照条件下静置培养.E.coli菌株 DH5α、BL21 (DE3)、载体pET-30a (+) 由本实验室保存.载体pMD-18T、限制性内切酶BamHⅠ和Hind Ш、DNA聚合酶、T4连接酶、DNA Mark DL2000、DL5000(TaKaRa公司).抗生素(Biosharp公司),氨苄青霉素100 μg/mL,卡那霉素50 μg/mL.引物的合成和相关基因测序由Genescript(Nanjing) Co., Ltd公司完成.
双人超净工作台(SW-CJ-2FD型, 苏州净化设备有限公司),高速冷冻离心机(5810R, 5417R, Eppendorf),空气浴振荡器(HZQ-C型, 哈尔滨市东明医疗仪器厂),水平电泳仪(DYCP-31BN, 上海民桥精密科学仪器有限公司),垂直电泳仪(JKY-700型, 宁波江南仪器厂公司).
1.2同源基因的生物信息学分析
根据已鉴定的细菌TA系统的基因序列及TA系统的遗传结构特点,在NCBI中对鱼腥藻PCC7120的基因组进行检索和分析,确定目的基因的位置和结构,并利用CDD和UniProt对其蛋白的保守性及相关蛋白分子性能进行在线分析.
1.3引物设计和目的基因PCR
已从NCBI数据库中获得目的基因asr9028和alr9029的基因序列,根据引物设计原则利用Oligo7.0获得表1中两对引物. 以鱼腥藻PCC7120基因组为模板,引物asr9028-F和asr9028-F扩增asr9028基因,alr9029-F和alr9029-R扩增alr9029基因,通过降落式PCR扩增得到目的片段,经DNA回收试剂盒纯化后回收,于-20 °C保存备用.
PCR程序如下:94 ℃ 4 min预变性;94 ℃ 1 min变性,51 ℃(0.5↓) 1 min退火,72 ℃ 40 s延伸,10个循环;94 ℃ 1 min变性,48 ℃ 1 min退火,72 ℃ 40 s延伸,25个循环;72 ℃延伸7 min.

表1 引物序列
1.4克隆及表达载体构建
将目的片段与克隆载体PMD18-T连接并分别转化到由CaCl2法制备的DH5α感受态细胞中,在涂有氨苄青霉素(100 μg/mL)的固体培养基上经蓝白斑筛选获得阳性重组菌,菌落PCR及测序检验正确后保留菌种.随后,用BamHⅠ和Hind Ш对重组质粒进行双酶切,用T4连接酶将目的片段连接到pET-30a的相应酶切位点上构建pET-30a-asr9028和pET-30a-alr9029,经卡那霉素(50 μg/mL)固体平板筛选、双酶切检验及测序正确后获得重组表达载体.
1.5在大肠杆菌中诱导表达
为了分析毒素抗毒素的表达情况,用终浓度50 μg/mL卡那霉素的LB培养基培养pET-30a-asr9028和pET-30a-alr9029,37 ℃、220 r/min培养菌体浓度OD600至0.4~0.6,加入0.8 mM的IPTG诱导表达.诱导条件在以往实验基础上改良,37 ℃、220 r/min诱导8 h[8].
1.6蛋白样品处理
全菌样品处理:收集1 mL菌液,12000 r/min离心5 min后弃上清950 mL,加入1×上样Buffer混匀,沸水浴3 min后静置冷却至室温,12000 r/min离心15 min,取上清8 μL点样. 上清蛋白样品处理:12000 r/min离心5 min收集5 mL菌体,用PBS buffer悬浮清洗2次.超声波破碎细胞:200 W超声1 s,间隔1 s,破碎15 min.12000 r/min离心30 min后收集上清蛋白裂解物,沉淀用200 μL无菌水重悬,涡旋混匀.将上清和沉淀分别加入50 μL 5×上样Buffer混匀,沸水浴煮6 min,冷却后12000 r/min离心15 min,取上清10 μL点样.
2结果与分析
2.1alr9029-asr9028基因序列分析
对鱼腥藻PCC7120基因组数据库分析显示:基因对alr9029-asr9028位于Epsilon质粒上(见图1),asr9028的开放阅读框为198 bp,位于其下游384 bp的阅读框为alr9029.两阅读框之间有两个碱基间隔且表达方向相同.其结构特点与II型TA系统phd-doc家族相似,典型的II型TA系统由两个基因组成,受控制于同一个操纵子,上游基因编码抗毒素,下游编码毒素[2].在数据库中显示:两个目的基因表达的蛋白均为假定蛋白,但通过CDD的蛋白质同源序列在线分析显示(见图2),alr9029与细菌Doc家族具有相同保守序列,预测alr9029为毒素基因.而asr9028含有Ribbon-helix-helix 蛋白结构域,可能是DNA结合蛋白.目前研究最透彻的Phd-Doc家族是大肠杆菌溶原噬菌体P1上的Phd和Doc蛋白.Phd蛋白在溶液中内在无序,其N端与Phd-Doc上游启动子结合,调控蛋白表达,C端与Doc的α螺旋紧密结合,形成异源三聚体抑制毒性作用[9-11].根据UniProt预测asr9028的编码产物为65个氨基酸,分子量为7402,等电点为4.52,具有良好的水溶性;alr9029的编码产物为127个氨基酸,分子量为14188,等电点为4.8.两蛋白在生理条件下的电荷特点显示,asr9028和alr9029的编码产物通过静电引力相互作用的可能性不大,其形成复合体的方式可能与Phd-Doc相似,通过折叠互补产生.
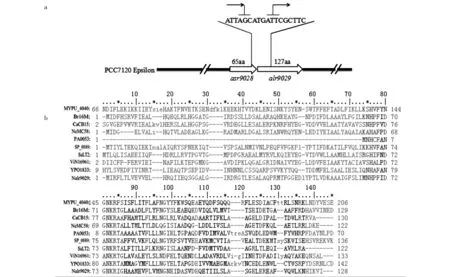
箭头所示asr9028和alr9029转录方向 ; MYPU_4040 : Mycoplasma pulmonis UAB CTIP ; Br16M : Brucella melitensis bv. 1 str. 16M ;CaCB15: Caulobacter crescentus CB15 ; NeMC58 : Neisseria meningitidis MC58 ; PA0053: Pseudomonas aeruginosa PAO1 ;SP_0889: Streptococcus pneumoniae TIGR4 ; SaLT2 : Salmonella enterica subsp.enterica serovar Typhimurium str. ;ViN16961: Vibrio cholerae O1 biovar El Tor str. N16961 ;YPO1833 : Yersinia pestis CO92 ; Nalr9029: Nostoc sp.PCC 7120a) alr9029-asr9028遗传结构示意图; b) Alr9029与毒素蛋白doc保守序列比对图1 asr9028和alr9029在PCC7120的Epsilon质粒上的遗传结构图Fig.1 Genetic construct map of asr9028and alr9029 on plasmid Epsilon of PCC7120
2.2表达载体的成功构建
为了研究asr9028和alr9029的分子特性,PCR扩增两个基因,并对其产物进行琼脂糖凝胶电泳检测,由于引物设计时添加酶切位点,故预期的片段长度要增加10多个碱基,asr9028约为210 bp,alr9029约为400 bp (见图2).结果表明:基因片段的实际大小与预期片段大小相符.

M) Mark DL2000; 1) 400 bp的alr9029; 2) 210 bp的asr9028图2 基因对alr9029-asr9028 PCR产物电泳检测Fig.2 Electrophoresis identification of alr9029-asr9028 PCR products
扩增得到目的片段后,将其直接连接到pMD18-T上,将氨苄青霉素和蓝白斑筛选得到的阳性克隆.选取BamH I和Hind Ш两个酶切位点对的阳性克隆进行双酶切,电泳(见图3)结果显示,得到约210 bp和400 bp大小的片段,测序结果100%相同,表明克隆重组菌构建成功.回收上述经双酶切的目的片段后经T4连接酶连接过夜,使片段连接到pET-30a的相应酶切位点,再转化到BL21中,经卡那霉素固体培养基筛选得到阳性重组菌.经双酶切检验(见图4)和测序证明,pET-30a-asr9028和pET-30a-alr9029两个表达载体已构建成功.

M) DL5000; 1) 210 bp的asr9028; 2) 400 bp的alr9029图3 asr9028/alr9029克隆载体双酶切电泳检测结果Fig.3 Electrophoresis identification of asr9028/alr9029 cloningvector by double enzyme digestion

M) DL5000;1) 400 bp的alr9029;2) 210 bp的asr9028图4 asr9028/alr9029表达载体双酶切电泳检测结果Fig.4 Electrophoresis identification of asr9028/alr9029 expressionvector by double enzyme digestion
2.3蛋白诱导表达
活化表达重组菌,目的片段位于T7启动子的控制下,用1 mM/L IPTG诱导8 h进行体外表达,全菌SDS-PAGE(见图5)表明:毒素、抗毒素蛋白在37 ℃、220 r/min、1 mM IPTG诱导条件下均能表达,但alr9029的表达水平明显比asr9028表达水平低,初步认定Alr9029为毒素蛋白.根据UniProt蛋白质在线预测可知,Asr9028的分子量为7.402 KDa,Alr9029的分子量为14.188 KDa.由于蛋白一端添加了His6融合标签,故蛋白大小约增加5 KDa,实际检测到的大小应约为抗毒素蛋白12.4 KDa,毒素蛋白19.2 KDa,与图5中蛋白条带位置一致.

M) 蛋白Mark;1) 空载体空白对照;2) 诱导pET-30a-alr9029表达结果;3) 诱导pET-30a-asr9028表达结果图5 IPTG诱导pET-30a-alr9029/asr9028表达的SDS-PAGE检测Fig.5 SDS-PAGE identification of TPTG induced pET-30a-alr9029/asr9028 expression
为进一步验证毒素、抗毒素蛋白为可溶性蛋白,利用超声波法破碎细胞,收集获得蛋白裂解液,对上清及沉淀蛋白进行SDS-PAGE分析(见图6).如图6所示,上清样品能清楚看到毒素和抗毒素蛋白,说明毒素、抗毒素蛋白均为可溶性蛋白.

M) 蛋白Mark;1) pET-30a-asr9028上清蛋白;2) pET-30a-alr9029上清蛋白;3) pET-30a-asr9028沉淀蛋白;4) pET-30a-alr9029沉淀蛋白图6 Asr9028和Alr9029可溶性分析SDS-PAGEFig.6 SDS-PAGE identification of Asr9028 and Alr9029 solublity
3讨论
本实验通过生物信息学分析预测了PCC7120 Epsilon质粒上的alr9029/asr9028基因对属于毒素抗毒素系统,并设计了特异性引物,采用降落式PCR扩增目的基因,构建相应的克隆和表达载体,测序正确后,在大肠杆菌中诱导表达,分析蛋白分子的基本特性. 实验发现alr9029的表达载体构建较为困难,即使在经过卡那霉素筛选和双酶切验证之后仍不能保证该重组菌的正确性.重复测序结果表明:alr9029的碱基突变率明显高于asr9028,推测可能与毒素基因的稳定性有关.
pET-30a-asr9028和pET-30a-alr9029转化进大肠杆菌BL21后,在1 mM IPTG、37 ℃、220 r/min条件下诱导表达,全菌SDS-PAGE检测获得约12.4 KDa和19.2 KDa的His6融合型蛋白,但Alr9029的表达量明显低于Asr9028,预示Alr9029为毒素蛋白. Alr9029具有Doc家族的保守结构,Doc不同于其他mazEF家族通过核酸酶作用裂解mRNA,Doc通过与核糖体30s亚基结合抑制翻译的延伸,抑制细胞生长[12].上清和沉淀蛋白分别经SDS-PAGE检测结果显示:在上清组分中都存在Asr9028和Alr9029,说明两蛋白均为可溶性蛋白,沉淀组分中存在Asr9028,估计未能将蛋白完全从沉淀中分离.
TA系统广泛存在于原核生物的染色体及质粒上,不同种属来源的TA家族同源程度存在差异,但遗传结构和功能非常相似.序列分析结果表明:alr9029编码产物与Doc同源,但asr9028编码产物含有RHH1结构且与Phd的同源性较低,由于目前对Phd-Doc家族的认识有限,故该基因对是否具有Phd-Doc家族相同的生理功能和作用方式尚待深入研究.本实验结果为后续蛋白质的理化性质研究、蛋白质相互作用、毒素蛋白靶标定位等研究奠定了基础. 鉴于毒素与抗毒素家族之间可能存在的交叉作用,可进一步从蛋白质组学水平上完善TA系统的相关网络调控.
参考文献
[1]Yamaguchi Y, Park J H, Inouye M. Toxin-antitoxin systems in bacteria and archaea[J]. Annu Rev Genet, 2011, 45:61-79.
[2]Pandey D P, Gerdes K. Toxin-antitoxin loci are highly abundant in free-living but lost from host-associated prokaryotes[J]. Nucleic Acids Res, 2005, 33(3): 966-76.
[3]Yarmolinsky M B. Programmed cell death in bacterial populations[J]. Science, 1995, 267(5199): 836-837.
[4]Gerdes K, Rasmussenb P B , Molin S. Unique type of plasmid maintenance function: postsegregational killing of plasmid-free cells[J]. Proc Natl Acad Sci USA,1986, 83(10): 3116-3120.
[5]Cooper T F ,Heinemann J A. Postsegregational killingdoes not increase plasmid stability but acts to mediate the exclusion of competing plasmids[J]. Proc Natl Acad Sci USA, 2000, 97(23): 12643-12648.
[6]Leplae R, Geeraerts D , Hallez R, et al. Diversity of bacterial type II toxin-antitoxin systems: a comprehensive search and functional analysis of novel families[J]. Nucleic Acids Res, 2011, 39(13):5513-25.
[7]Koonin E V , Wolf Y I. Genomics of bacteria and archaea: the emerging dynamic view of the prokaryotic world[J]. Nucleic Acids Res, 2008, 36(21): 6688-719.
[8]陈思礼, 梅菊. 鱼腥藻 PCC7120 染色体上relBE同源基因的克隆及表达[J]. 中南民族大学学报(自然科学版), 2012, 31(1): 16-19.
[9]McKinley J E , Magnuson R D.Characterization of the Phd repressor-antitoxin boundary[J]. J Bacteriol, 2005,187(2):765-770.
[10]Smith J A ,Magnuson R D.Modular organization of the Phd repressor-antitoxin protein[J]. J Bacteriol,2004, 186(9): 2692-2698.
[11]Gazit E ,Sauer R T.The Doc toxin and Phd antidote proteins of the bacteriophage P1 plasmid addiction system form a heterotrimeric complex[J]. J Biol Chem,1999, 274(24): 16813-8.
[12]Liu M, Zhang Y, Inouye M, et al. Bacterial addiction module toxin Doc inhibits translation elongation through its association with the 30S ribosomal subunit[J]. PNAS, 2008, 105(15): 5885-5890.
Preliminary Study of a Pair of Toxin-Antitoxin Gene alr9029/asr9028 in Plasmid of Anabaena sp.PCC7120
ChenSili,WuHuilan,ChenJie
(College of Life Sciences, South-Central University for Nationalities, Wuhan 430074, China)
AbstractToxin-Antitoxin systems(TAs) inE.colican mediate post-segregational killing to maintain the stability of plasmids and induce bacterial growth inhibition or death responding to environmental stresses. Gene pairalr9029/asr9028 in plasmid ofAnabaenasp.PCC7120 is homologous with TAs. To verify that the genes belong to TAs, bioinformatic techniques were used to analyze the genetic structure ofalr9029/asr9028. The specific primers were designed to amplify target genesasr9028 with 198 bp andalr9029 with 387 bp by PCR. The products were inserted into pMD18-T and pET-30a by double digestion ofBamH I andHind Ш to construct clone and expression vectors successively. SDS-PAGE showed that the molecular weights of the expressed proteins with His6 tag were 12.4 kDa and 19.2 kDa respectively, and both were soluble. It was preliminarily determined that the gene pairalr9029-asr9028 constructed a toxin-antitoxin system, withasr9028 as antitoxin andalr9029 as toxin.
KeywordsAnabaenasp.PCC7120; toxin-antitoxin system;alr9029;asr9028
收稿日期2015-09-14
作者简介陈思礼(1955-),男,教授,博士,研究方向:分子病院生物学,E-mail: sili.chen@163.com
基金项目国家自然科学基金资助项目(31001099/C190101);中央高校自然科学基金资助项目(CJSl3003,CJS13004);中南民族大学微生物与生物转化重点实验室资助项目(XJS09002)
中图分类号Q71
文献标识码A
文章编号1672-4321(2016)02-0026-05

