壳寡糖对阿霉素肾病大鼠的作用研究❋
刘玉英, 迟金华, 蒋志雯, 李 南, 杨 艳, 刘万顺, 韩宝芹
(中国海洋大学海洋生命学院,山东 青岛 266003)
壳寡糖对阿霉素肾病大鼠的作用研究❋
刘玉英, 迟金华, 蒋志雯, 李 南, 杨 艳, 刘万顺, 韩宝芹❋❋
(中国海洋大学海洋生命学院,山东 青岛 266003)
本文探讨壳寡糖(COS)对阿霉素诱导的肾病大鼠的作用效果。通过股静脉注射阿霉素构建阿霉素肾病大鼠模型,分别灌胃壳寡糖高、中、低剂量,检测尿蛋白和肾脏重量系数的变化,血清肌酐、尿素氮、总胆固醇、甘油三酯、总蛋白、白蛋白、IL-1β、TNF-α、TGF-β1的变化,以及肾脏组织中GSH-PX和SOD的变化,并对肾脏组织病理切片进行观察。结果表明COS各剂量组均能有效降低尿蛋白含量,明显降低血清肌酐、尿素氮、总胆固醇、甘油三酯、IL-1β、TNF-α、TGF-β1含量,显著提高血清总蛋白、白蛋白含量以及肾组织中GSH-PX、SOD活力,COS作用剂量与效果间呈量效关系。说明COS保护肾脏结构和功能效果显著,能够提高肾脏抗氧化能力,抑制介导纤维化、炎症反应和肾小球硬化进展的相关因子的合成或释放,对肾脏具有一定的保护作用。
壳寡糖;肾小球硬化;阿霉素
局灶性节段性肾小球硬化(Focal segmental glomerulosclerosis, FSGS)是肾小球肾炎的一种,其病变特点为部分肾小球的小叶发生硬化,临床主要表现为肾病综合征。FSGS很少自动缓解,多数呈慢性进展,多发展为慢性肾小球肾炎,50%的患者在发病后十年内发展为终末期肾小球肾炎[1]。近年来原发性FSGS发病率呈增高趋势,因此对FSGS的治疗研究具有重要意义。在1976年首次报道阿霉素诱导的肾病大鼠模型后,阿霉素肾病模型被广泛和深入研究。阿霉素是一种经典的啮齿类肾脏损伤诱发剂,导致的症状包括肾小球硬化、肾间质炎症和纤维化,能够很好的模拟人类FSGS[2]。
壳聚糖是一种天然阳离子碱性多糖,主要提取自海洋生物的甲壳中,是目前海洋生物医药领域的重要研究材料。而壳寡糖(Chitosan oligosaccharides, COS)由壳聚糖经酶水解制得,具有水溶性好,安全无毒、易吸收等优点。COS具有很好的抗肿瘤、抗氧化、降血糖血脂、增强机体免疫力等的作用[3-4]。本文研究了COS对阿霉素诱导的大鼠肾病模型的作用,为FSGS的治疗以及COS在生物医药领域的应用提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 材料 壳寡糖,由本实验室制备并纯化,MALDI-TOF-MS图谱分析其聚合度为2~6糖。
1.1.2 试剂 阿霉素,大连美仑生物技术有限公司。尿蛋白、肌酐(CRE)、尿素氮(BUN)、总胆固醇(T-CHO)、甘油三酯(TG)、白蛋白、BCA法蛋白定量、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)测试盒以及Masson染液、糖原(PAS)染液试剂盒均为南京建成生物工程研究所。大鼠转化生长因子beta1(TGF-β1)ELISA试剂盒、大鼠白介素1β(IL-1β)ELISA试剂盒、大鼠肿瘤坏死因子α(TNF-α)ELISA试剂盒,为武汉博士德生物工程有限公司。
1.1.3 实验动物 清洁级Wistar大鼠,雄性,体重(250±30)g,60只,由青岛市药品检验所提供,实验动物许可证号SYXK(鲁)2014 0002。在清洁级环境下饲养,使用符合国家标准的商品饲料,饮用水为无菌蒸馏水,空气清洁度为10 000级,相对湿度40%~80%,温度20~25 ℃。
1.2 阿霉素肾病(AN)大鼠动物模型的构建
实验大鼠适应性饲养一周,术前12 h禁食不禁水,用3%戊巴比妥钠(1 mL·kg-1)腹腔注射麻醉大鼠,剔除手术部位多余被毛并消毒,在腹股沟处切开皮肤,钝性分离肌肉,暴露股静脉,造模大鼠一次性股静脉注射6 mg/kg的阿霉素构建阿霉素肾病模型,注射后用无菌棉球压迫血管片刻,缝合皮肤并消毒。空白对照大鼠注射等量的生理盐水,作空白对照组。
1.3 分组及给药
建模后,实验分为空白对照组(N),造模大鼠随机分为模型对照组(M)、COS高剂量组(CH)、COS中剂量组(CM)、COS低剂量组(CL),每组12只。COS高、中、低剂量组分别以0.3、0.2和0.1 g·kg-1·d-1的剂量灌胃给予COS,空白对照组和模型对照组灌胃等量的蒸馏水,每日1次,连续灌胃8周。各组大鼠分笼饲养,每笼6只,统一配置足量鼠粮和饮用水,每天定时清洁大鼠排泄物,保持饲养环境清洁。
1.4 实验观察及指标检测
大鼠日常状态观察:观察并记录各组大鼠的饮食、排泄、精神状态。
标本采集及指标测定:分别于造模前一天和灌胃后1、2、3、4、5、6、7、8周末,采集各组大鼠24 h尿液,定量检测尿蛋白。在灌胃后的第4周、第8周末,大鼠禁食12 h,随机取各组大鼠6只,分别称体重;腹主动脉取血,收集血清,检测血清肌酐、尿素氮、总胆固醇、甘油三酯、总蛋白、白蛋白、IL-1β、TNF-α、TGF-β1;取双侧肾脏称重,计算大鼠肾脏重量系数;取0.55 g左侧肾脏,剪碎,放入含有5 mL预冷生理盐水的10 mL离心管中,用组织均浆机制备10%肾组织均浆,检测SOD和GSH-PX活性;取部分右侧肾组织于10%福尔马林溶液中固定,HE染色、Masson染色和PAS染色。
1.5 统计学分析
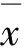
2 实验结果
2.1 大鼠日常状态大体观察和体重变化
空白对照组大鼠精神状态良好,毛色有光泽,活动灵敏,饮食水正常。造模大鼠注射阿霉素5 d左右开始出现异常,阿霉素导致的副作用明显,饮水摄食量明显减少,腹泻,动作迟滞,精神萎靡,体重下降。造模大鼠中,约有30%在注射部位出现不同程度的腐烂,经过持续的消毒处理,情况逐渐好转。在2周左右,上述症状明显改善,造模大鼠逐渐恢复正常。COS高剂量组和COS中剂量组较模型组恢复较快。
各组大鼠在第4、8周时的体重见图1,M组、CH组、CM组、CL组大鼠体重均明显低于N组(P<0.05);第4、8周时,CH组、CM组大鼠体重均显著高于M组(P<0.05),表明COS对阿霉素所致毒副作用具有一定的缓解作用,并呈现量效关系。
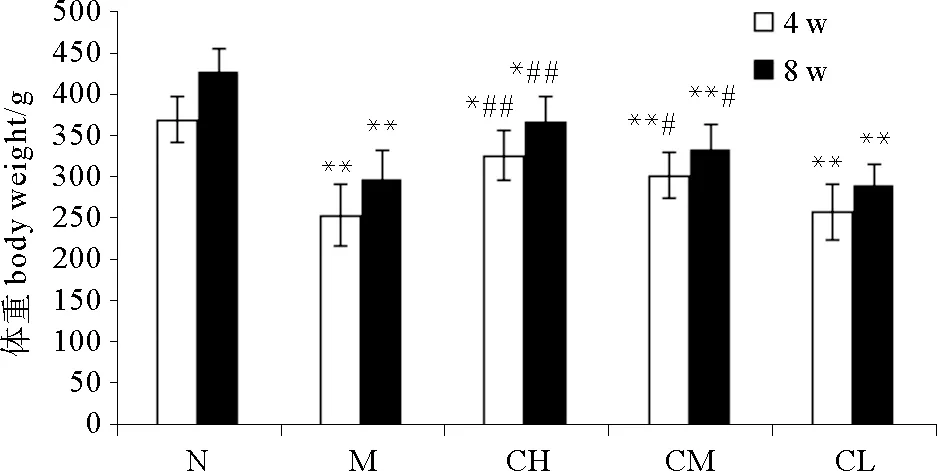
(*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。Compared with blank control group*P<0.05,**P<0.01; Compared with model group#P<0.05,##P<0.01.)
图1 大鼠体重变化
Fig.1 Change of body weight of the rats
2.2 COS对阿霉素肾病大鼠尿蛋白和肾脏重量系数的影响
由表1可以看出,实验后1周,M组、CH组、CM组、CL组大鼠较N组大鼠24 h尿蛋白排泄量显著升高(P<0.01);实验后3周,CH组较M组显著降低(P<0.01);实验后4周,CH组、CM组较M组均显著降低(P<0.05);实验后7周,CH组、CM组、CL组较M组均显著降低(P<0.05),差异有统计学意义;表明COS具有降低阿霉素肾病大鼠尿蛋白的作用,并呈量效关系。
由表2可以看出,在4、8周时,M组、CH组、CM组、CL组大鼠较N组大鼠肾重量系数显著升高(P<0.01);4周时,CH组、CM组较M组显著降低(P<0.01);8周时,CH组、CM组、CL组较M组均显著降低(P<0.01),差异有统计学意义;表明COS具有降低阿霉素肾病大鼠的肾脏重量系数的作用,并呈量效关系。
2.3 COS对阿霉素肾病大鼠血清甘油三酯、总胆固醇、总蛋白和白蛋白的影响
COS对血脂的影响见表3。M组、CH组、CM组、CL组大鼠的血清甘油三酯和总胆固醇较N组大鼠显著升高(P<0.01);4周时,CH组较M组显著降低(P<0.01);8周时,CH组、CM组、CL组较M组均显著降低(P<0.01),差异有统计学意义;表明COS具有降低阿霉素肾病大鼠血清甘油三酯和总胆固醇的作用,并呈量效关系。
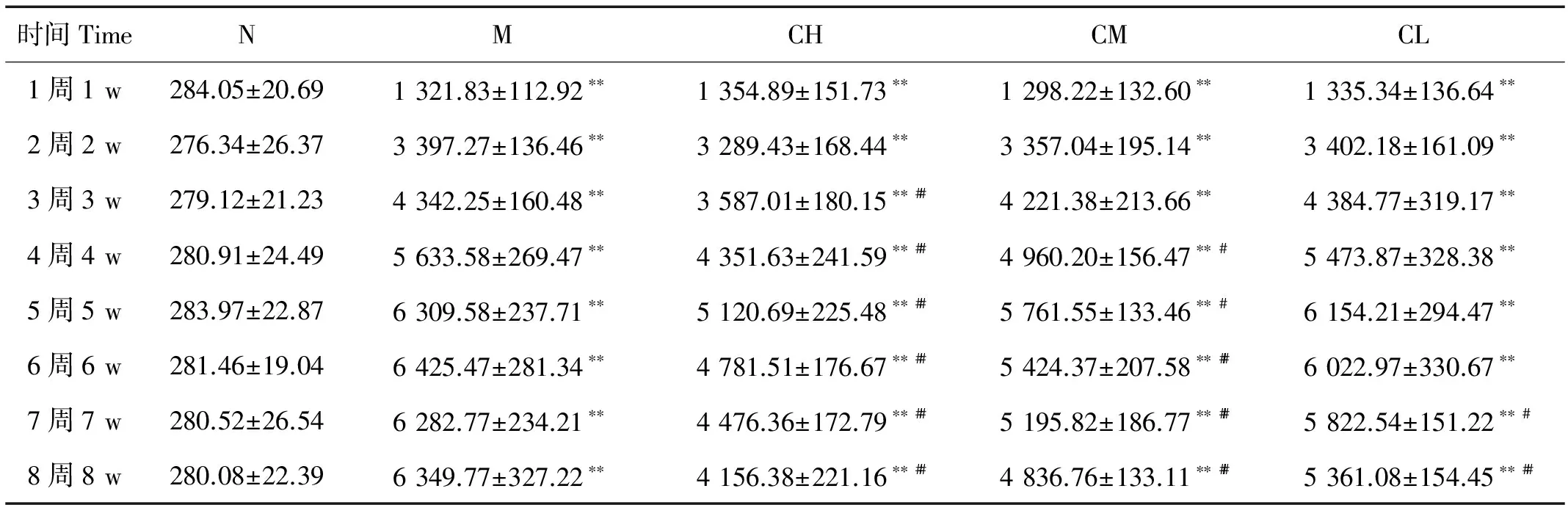
时间TimeNMCHCMCL1周1w284.05±20.691321.83±112.92∗∗1354.89±151.73∗∗1298.22±132.60∗∗1335.34±136.64∗∗2周2w276.34±26.373397.27±136.46∗∗3289.43±168.44∗∗3357.04±195.14∗∗3402.18±161.09∗∗3周3w279.12±21.234342.25±160.48∗∗3587.01±180.15∗∗##4221.38±213.66∗∗4384.77±319.17∗∗4周4w280.91±24.495633.58±269.47∗∗4351.63±241.59∗∗##4960.20±156.47∗∗#5473.87±328.38∗∗5周5w283.97±22.876309.58±237.71∗∗5120.69±225.48∗∗##5761.55±133.46∗∗#6154.21±294.47∗∗6周6w281.46±19.046425.47±281.34∗∗4781.51±176.67∗∗##5424.37±207.58∗∗##6022.97±330.67∗∗7周7w280.52±26.546282.77±234.21∗∗4476.36±172.79∗∗##5195.82±186.77∗∗##5822.54±151.22∗∗#8周8w280.08±22.396349.77±327.22∗∗4156.38±221.16∗∗##4836.76±133.11∗∗##5361.08±154.45∗∗##
注:*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。
Note:Compared with blank control group*P<0.05,**P<0.01; Compared with model group#P<0.05,##P<0.01.
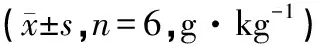


组别Group4周4work8周8workN2.23±0.072.21±0.05M3.64±0.11∗∗5.62±0.14∗∗CH3.02±0.13∗∗##2.86±0.14∗∗##CM3.36±0.12∗∗##3.27±0.11∗∗##CL3.73±0.13∗∗3.68±0.09∗∗##
注:*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。
Note: Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.
COS对血清总蛋白和白蛋白的影响见表4。M组、CH组、CM组、CL组大鼠较N组大鼠的血清总蛋白和白蛋白显著降低(P<0.01);4周时,CH组、CM组较M组均明显升高(P<0.05);8周时,CH组、CM组、CL组较M组均显著升高(P<0.05),差异有统计学意义;表明COS具有提高阿霉素肾病大鼠血清总蛋白和白蛋白的作用,并呈量效关系。
2.4 COS对阿霉素肾病大鼠肾功能的影响
由表5可见,M组、CH组、CM组、CL组大鼠的血清肌酐和尿素氮较N组大鼠显著升高(P<0.01);4周时,CH组大鼠的血清肌酐和尿素氮较M组大鼠显著降低(P<0.05);8周时,CH组、CM组、CL组大鼠的血清肌酐和尿素氮均较M组大鼠显著降低(P<0.05),差异有统计学意义;表明COS具有降低阿霉素肾病大鼠血清肌酐和尿素氮的作用,并呈量效关系。
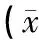
表3 COS对阿霉素肾病大鼠血清甘油三酯和总胆固醇的影响±s,n=6)
注:*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。
Note: Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.
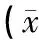
表4 COS对阿霉素肾病大鼠血清总蛋白和白蛋白的影响±s,n=6)
注:*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。
Note: Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.
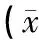
表5 COS对阿霉素肾病大鼠血清肌酐和尿素氮的影响±s,n=6)
注:*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。
Note:Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.
2.5 COS对阿霉素肾病大鼠肾脏组织中GSH-PX和SOD活力的影响
由表6可见,M组、CH组、CM组、CL组大鼠肾脏中GSH-PX和SOD的活性较N组大鼠明显降低(P<0.01);4周时,CH组大鼠肾脏中GSH-PX和SOD的活性与M组相比明显升高(P>0.05);8周时,CH组和CM组大鼠肾脏中GSH-PX和SOD的活性均较M组大鼠均显著升高(P<0.01),差异具有统计学意义;表明COS具有提高阿霉素肾病大鼠肾组织GSH-PX和SOD活力的作用,并呈量效关系。
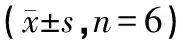
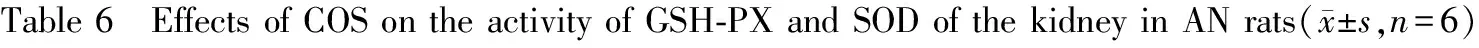

组别GroupGSH⁃PX/U4周4work8周8workSOD/U·mgprot-14周4work8周8workN818.83±17.59806.74±22.18377.46±12.65381.18±14.79M613.19±36.09∗∗216.21±48.58∗∗285.01±20.58∗∗181.95±33.97∗∗CH696.35±34.20∗∗#525.76±32.57∗∗##325.51±12.81∗∗#303.38±22.75∗∗##CM644.85±42.51∗∗410.36±26.74∗∗##303.93±22.04∗∗256.06±25.59∗∗##CL619.34±33.45∗∗282.50±44.23∗∗286.17±13.34∗∗205.99±19.21∗∗
注:*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。
Note:Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.
2.6 COS对阿霉素肾病大鼠血清中TGF-β1、IL-1β和TNF-α含量的影响
由图2可知,M组、CH组、CM组、CL组血清中TGF-β1的含量较N组显著升高(P<0.01);4周时,CH组、CM组、CL组血清中TGF-β1的含量较M组无明显差异(P>0.05);8周时,CH组、CM组、CL组血清中TGF-β1的含量显著低于M组(P<0.05),差异具有统计学意义;表明COS具有降低阿霉素肾病大鼠血清TGF-β1含量的作用,并呈量效关系。
由图3可知,M组、CH组、CM组、CL组血清中IL-1β的含量较N组显著升高(P<0.01);4周时,CH组血清中IL-1β的含量较M组显著降低(P<0.05);8周时,CH组、CM组、CL组血清中IL-1β的含量均显著低于M组(P<0.01),差异具有统计学意义;表明COS具有降低阿霉素肾病大鼠血清IL-1β含量的作用,并呈量效关系。
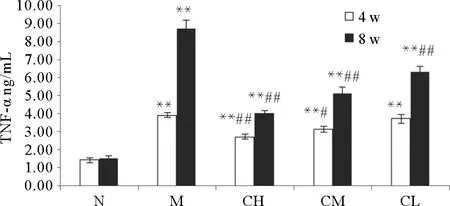
由图4可知,M组、CH组、CM组、CL组血清中TNF-α的含量较N组显著升高(P<0.01);4周时,CH组、CM组血清中TNF-α的含量较M组显著降低(P<0.05);8周时,CH组、CM组、CL组血清中TNF-α的含量均显著低于M组(P<0.01),差异具有统计学意义。表明COS具有降低阿霉素肾病大鼠血清TNF-α含量的作用,并呈量效关系。
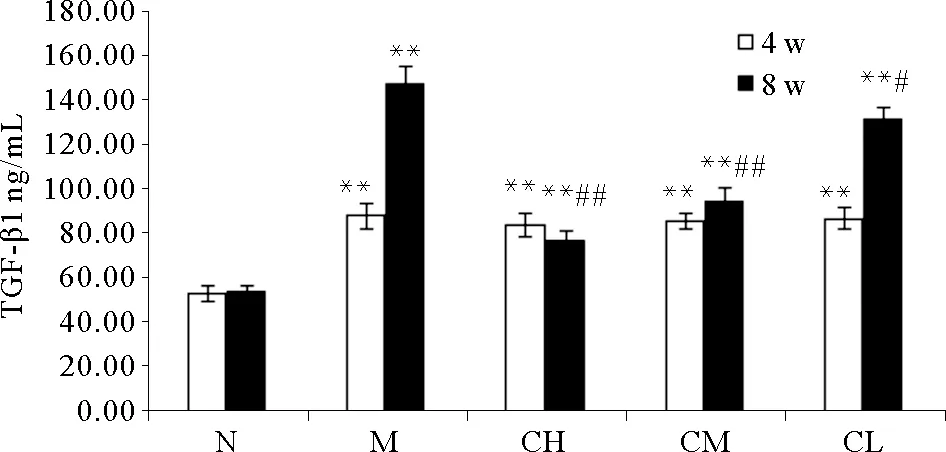
(*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.)
图2 血清中TGF-β1的含量变化
Fig.2 The content of TGF-β1 in the serum
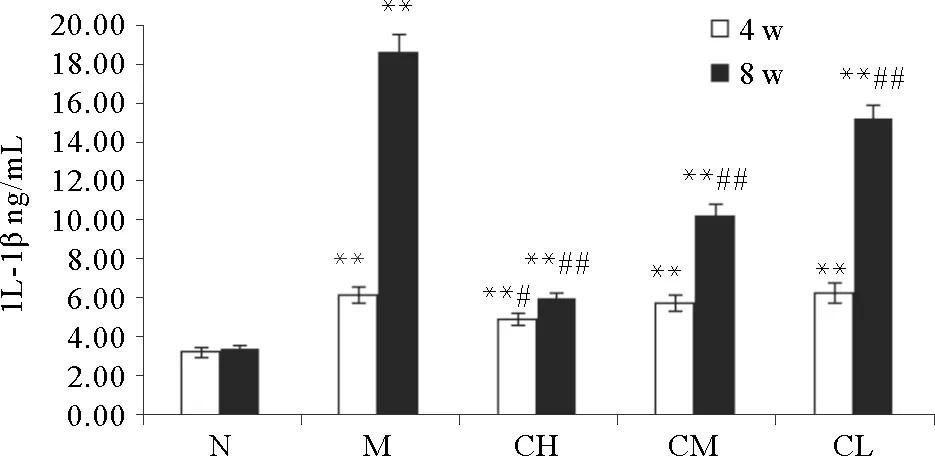
(*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.)
图3 血清中IL-1β的含量变化
Fig.3 The content of IL-1β in the serum
(*P<0.05,**P<0.01,与空白对照组比较;#P<0.05,##P<0.01,与模型对照组比较。Compared with blank control group*P<0.05,**P<0.01;Compared with model group#P<0.05,##P<0.01.)
图4 血清中TNF-α的含量变化
Fig.4 The content of TNF-α in the serum
2.7 大鼠肾脏组织病理学结果
HE染色结果见图5,N组肾小球和肾小管均正常,未见异常改变。4周时,M组肾小管上皮细胞细小空泡变性广泛,管腔内出现一些蛋白管型,肾间质水肿可见,炎性细胞浸润明显;CH组和CM组较M组病变明显较轻,肾小管上皮细胞细小空泡变性呈现局灶性;CL组肾小管上皮细胞细小空泡变性广泛,个别肾小管内可见蛋白管型。8周时,M组出现局灶性节段性肾小球硬化以及肾小球玻璃样变,肾小管扩张或萎缩均明显,肾小管上皮细胞粗大空泡变性、脱落,管腔内有大量的蛋白管型,有大量的炎性细胞浸润;CH组和CM组与M组相比,无明显的肾小球硬化及玻璃样变,有个别的肾小管扩张或萎缩现象,肾小管上皮细胞空泡变性明显改善,管腔内可见少量的蛋白管型,炎性细胞浸润明显减少,尤其是CH组,药物干预效果极其明显;CL组药物干预效果不明显,较M组有轻微改善。
Masson染色结果见图6,N组没有纤维化现象。4周时,M组、CH组、CM组、CL组均可见轻微的肾间质纤维化,M组相对严重;8周时,M组肾间质纤维化明显,呈弥漫性分布,CH组仅见轻微的肾间质纤维化,CM组纤维化呈现局灶性,CL组纤维化呈轻度弥漫性。
PAS染色结果见图7,N组肾小球血管袢薄而清晰,内皮细胞和系膜细胞数目正常。4周时,M组肾小球系膜基质有增多现象,并且肾小球系膜轻度增生,CH组、CM组、CL组情况相似;8周时,M组肾小球系膜基质严重增多,肾小球系膜重度增生,肾小球内出现结节和团块状区域,呈弥漫性分布,且伴有球囊粘连,CH组和CM组肾小球系膜增生较轻,系膜基质有少量增多,药物干预效果良好,CL组肾小球系膜中度增生,系膜基质大量增多。
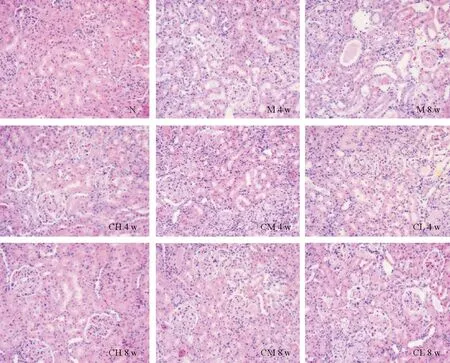
图5 肾脏组织病理切片HE染色
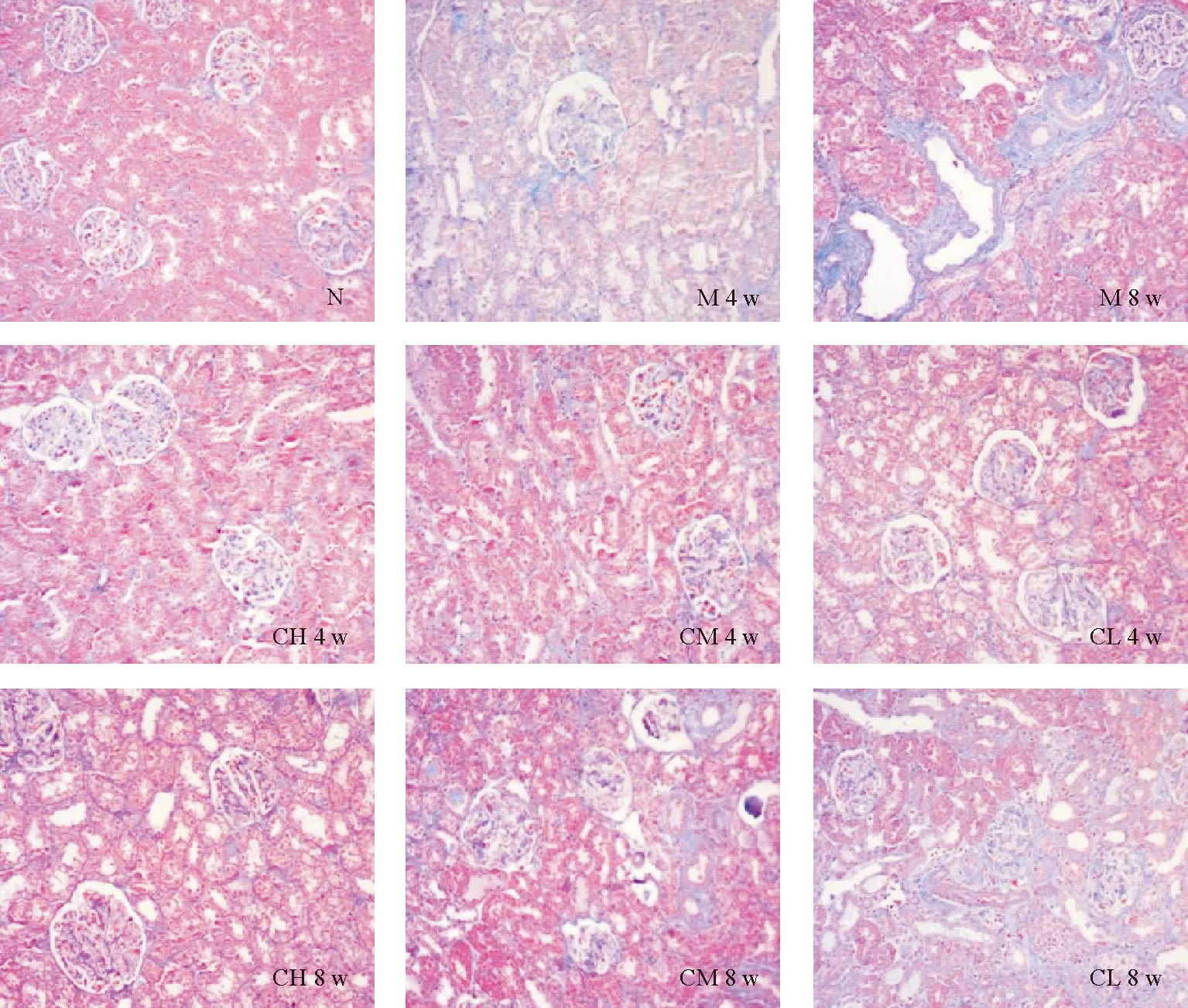
图6 肾脏组织病理切片Masson染色
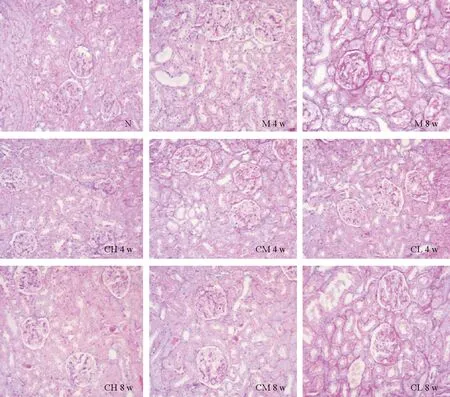
图7 肾脏组织病理切片PAS染色
3 讨论
阿霉素是一种含醌的蒽环类抗肿瘤抗生素,其在肾脏内代谢被还原为半醌型自由基,后者与氧反应产生活性氧,诱发肾小球上皮细胞脂质过氧化反应,影响肾小球上皮细胞糖蛋白代谢,破坏肾小球滤过膜的结构和功能,最终导致基底膜滤过屏障的选择性变化,引起蛋白尿,是经典的肾小球疾病模型之一[5]。本实验通过股静脉注射阿霉素构建了阿霉素肾病大鼠模型,从预实验和本次实验均达到了很好的模拟效果。
蛋白尿是肾小球疾病早期即出现的常见症状,它反映了肾小球损伤的进展情况,并介导了之后的氧化应激、炎症反应、纤维化[5]。COS高、中、低剂量组的尿蛋白含量分别在3、4、7周时明显下降,较对应模型组差异显著,表明COS能够有效修复肾小球损伤。低蛋白血症和高脂血症都是肾病综合征的主要表现,由于大量蛋白质从尿中丢失,机体内蛋白合成和分解代谢失衡,机体所需蛋白得不到满足,导致肝脏合成和分泌脂蛋白过度。模型组血清总蛋白和白蛋白含量显著下降,血清总胆固醇和甘油三酯含量显著升高,低蛋白血症和高脂血症表现明显。COS高剂量组在干预4周时即显著提高了血清总蛋白和白蛋白的含量,降低了总胆固醇和甘油三酯的含量,干预8周时,COS各剂量组的血清总蛋白和白蛋白均显著升高,总胆固醇和甘油三酯均显著降低,与尿蛋白检测结果相呼应。血清肌酐和尿素氮在一定程度上反映了肾小球滤过功能的损害程度。COS高剂量组在干预4周时血清肌酐和尿素氮的含量显著降低,较模型组差异显著,说明肾小球的滤过功能得到明显改善,COS各剂量组在干预8周时血清肌酐和尿素氮的含量较模型组均显著降低,表明COS对肾小球具有持续的修复和保护作用。
氧化应激在阿霉素肾病的发生发展过程中具有重要作用。有研究表明,阿霉素进入机体内,积聚在肾小球,对其清除的延迟导致持续的毒性浸润和自由基的大量释放,直接导致足细胞损伤[6-7]。SOD能有效清除超氧阴离子自由基保护细胞免受损伤。GSH-PX使有毒的过氧化物还原为无毒的羟基化合物,从而保护细胞膜的结构和功能不受过氧化物的干扰和损害。COS高剂量组SOD和GSH-PX的活力在干预4周时较模型组明显升高,COS高、中剂量组SOD和GSH-PX的活力在干预8周时较模型组均显著升高,表明COS具有抗氧化应激的作用。
TGF-β1是多种肾脏疾病发生发展的重要因子,它介导上皮细胞的分化、成纤维细胞的增殖、细胞外基质的合成等多个环节,与肾小球硬化、肾间质纤维化的发生密切相关。TGF-β1不仅在肾小球系膜细胞的胞浆中表达,还在内皮细胞胞浆中表达。在FSGS病变中,TGF-β1表达量显著增加[8]。COS各剂量组在干预8周时血清TGF-β1的含量较模型组显著降低,表明COS能够有效抑制TGF-β1的合成,进而阻止TGF-β1对肾脏在多方面的损害。
IL-1β是重要的前炎症因子,可诱导T淋巴细胞、单核巨噬细胞和成纤维细胞浸润到肾组织内,破坏正常组织结构,最终引发肾小球硬化[9]。COS高剂量组在干预4周时血清IL-1β的含量即明显降低,较模型组差异显著,干预8周时COS各剂量组血清IL-1β的含量较模型组均显著降低,表明COS在作用早期就能持续有效调控IL-1β的含量,减少其在炎症方面以及对肾小球等的损伤。
TNF-α在炎症反应中具有重要作用,它可促进其它炎症因子(IL-1、IL-6)、单核细胞趋化蛋白-1(MCP-1)和生长因子(TGF)的释放,在介导肾间质纤维化、加剧肾损伤的过程中起着重要作用。TNF-α能够促进炎症细胞聚集、浸润,刺激肾小球系膜细胞合成TGF-β,引起纤维蛋白沉积于肾小球[10]。COS高、中剂量组在干预4周时较模型组均显著降低了血清中TNF-α的含量,在一定程度上间接减少了TGF-β1和IL-1β的含量,对于肾脏的保护具有重要意义。
综上所述,COS能够改善低蛋白血症和高脂血症,提高肾脏组织的抗氧化能力,抑制介导纤维化、炎症反应和肾小球硬化进展的相关因子的合成或释放,能一定程度修复肾小球损伤,对肾脏功能具有改善和保护作用,其作用机制还有待进一步研究。
[1] 陈杰, 李甘地. 病理学[M]. 2版. 北京: 人民卫生出版社, 2010: 323-336. Chen Jie, Li Gandi. Pathology[M]. Version 2. Beijing: People’s Medical Publishing House, 2010: 323-336.
[2] Vincent WS Lee, Davin CH Harris. Adriamycin nephropathy: A model of focal segmental glomerulosclerosis [J]. Nephrology, 2011, 16(1): 30-38.
[3] 乔莹, 白雪芳, 杜昱光. 壳寡糖医药保健功能的研究进展[J]. 中国生化药物杂志, 2008, 29(3): 210-213. Qiao Ying, Bai Xuefang, Du Yuguang. The research progress of chitosan oligosaccharides in medicine and health care function[J]. Chin J Biochem Pharm, 2008, 29(3): 210-213.
[4] Se-Kwon Kim, Niranjan Rajapakse. Enzymatic production and biological activities of chitosan oligosaccharides(COS): A review[J]. Carbohydrate Polymers, 2005, 62(4): 357-368.
[5] 陈春艳, 王闻婧, 纪宝华, 等. 防己黄芪汤对阿霉素肾病大鼠蛋白尿和肾组织Nephrin的作用[J]. 中国中医急症, 2013, 22(3): 361-363. Chen Chunyan, Wang Wenjing, Ji Baohua, et al. The effects of tetrandra and astragalus decoction on the urine protein and kidney nephrin of adriamycin nephrosis in rats[J]. Journal of Emergency in Traditional Chinese Medicine, 2013, 22(3): 361-363.
[6] Ricardo S D, Bertram J F, Ryan G B. Antioxidants protect podocyte foot processes in puromycin aminonucleoside-treated rats [J]. J AM Soc Nephrol, 1994, 4(12): 1974-1986.
[7] Shin M, Matsunaga H, Fujiwara k. Differences in accumulation of anthracyclines daunorubicin, doxorubicin and epirubicin in rat tissues revealed by immunocytochemistry [J]. Histochem Cell Biol, 2010, 133(6): 677-682.
[8] 温红辉, 霍燕微, 刘捷裕, 等. NF-κB和TGF-β1在阿霉素肾病模型中的检测与病理意义[J]. 现代医院, 2015, 13(5): 28-30. Wen Honghui, Hua Yanwei, Liu Jieyu, et al. The detection and pathological significance of NF-κB and TGF-β1 in adriamycin nephrosis model[J]. Modern Hospital, 2015, 13(5): 28-30.
[9] Segerer S, Nelson PJ, Schlondorff D. Chemokines, chemokine receptors and renal disease: From basic science to pathophysiologic and therapeutic studies [J]. J Am Soc Nephrol, 2000, 11(1): 152-176.
[10] Timoshanko J R, Sedgwick J D, Holdsworth S R, et al. Intrinsic renal cells are the major source of tumor necrosis factor contributing to renal injury in murine crescentic glomerulonephritis [J]. J Am Soc Nephrol, 2003, 14(7): 1785-1793.
责任编辑 高 蓓
Effects of Chitosan Oligosaccharides on Adriamycin Nephrosis in Rats
LIU Yu-Ying, CHI Jin-Hua, JIANG Zhi-Wen, LI Nan, YANG Yan, LIU Wan-Shun, HAN Bao-Qin
(College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China)
The effects of chitosan oligosaccharides(COS) on adriamycin nephrosis in rats were investigated. Adriamycin, which is a kind of classic rodent kidney damage inducer, was injected into femoral vein by syringe to make adrimycin nephrosis model in rats. And the rats of blank control group received normal saline by the same route. For the (COS)-treated adrimycin nephrosis groups, the rats were given a gavage of COS of high, middle and low doses respectively one time a day. The rats of Blank control group and model control group were given a gavage of distilled water with the equal amount. The study lasted a total of 8 weeks and urine samples of 24 hours were collected every one week. The body weight of the rats was recorded, and the blood and kidney of the rats were collected every 4 weeks. Serum, kidney tissue homogenate and kidney tissue paraffin section were made and preserved in certain conditions to prepare for corresponding detections. Urine protein, reflecting the progress of glomerular injury, was measured and kidney weight coefficient was caculated. The changes of serum creatinine, urea nitrogen, total cholesterol, triglyceride, total protein, albumin, TGF-β1, IL-1β and TNF-α were measured by corresponding kits, which indicated the changing situations of the structure and functions of kidney directly or indirectly. The activity of GSH-PX and SOD of the kidney were examined, both of which are very important antioxidant enzymes in the body. Histological changes were observed by light microscopy through three different pathological dyeing methods—hematoxin eosin(HE), periodic acid Schiff(PAS), and Masson’s trichrome stain. Results revealed that each dose of COS could apparently reduce the content of urine protein, and the level of serum creatinine, urea nitrogen, total cholesterol, triglyceride, TGF-β1, IL-1β and TNF-α, and significantly enhance the content of serum total protein and albumin and the activity of GSH-PX and SOD of the kidney tissue. In addition to this, the results presented an apparent dose effect between the therapeutic action to adrimycin nephrosis and the doses of COS. In conclusion, COS had certain protective effect to the kidney, which could effectively protect the structure and function of kidney, improve the antioxidation capacity of kidney, and inhibit the synthesis or release of relevant cytokines causing fibrosis, inflammatory reaction and glomerulosclerosis.
chitosan oligosaccharides; glomerulosclerosis; adriamycin
NSFC-山东联合资助海洋研究中心项目(U1406402-5);山东省计划项目(2014ZZCX06203)资助 Supported by the National Natural Science Foundation of China and the Government of Shandong Province Joint Fund Marine Science Research Center Project(U1406402-5); The Project of Shandong Province(2014ZZCX06203)
2016-02-18;
2016-03-22
刘玉英(1989-),女,硕士生,研究方向为生物化学与海洋生物材料。
❋❋ 通讯作者:E-mail: baoqinh@ouc.edu.cn
R692.3+1;R931.77
A
1672-5174(2016)12-051-09
10.16441/j.cnki.hdxb.20160021
刘玉英, 迟金华, 蒋志雯, 等. 壳寡糖对阿霉素肾病大鼠的作用研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(12): 51-59.
LIU Yu-Ying, CHI Jin-Hua, JIANG Zhi-Wen, et al. Effects of chitosan oligosaccharides on adriamycin nephrosis in rats[J]. Periodical of Ocean University of China, 2016, 46(12): 51-59.

