青藏高原几种牧草附着耐低温乳酸菌的筛选
许冬梅, 曹 蕾, 荆佩欣, 张永辉, 张红梅, 张万祥, 郭旭生*
(1.兰州大学生命科学学院 草地农业生态系统国家重点实验室,甘肃 兰州 730000;2.甘肃省草原技术推广总站,甘肃 兰州 730046; 3.兰州大学草地农业科学技术学院草地农业生态系统国家重点实验室,甘肃 兰州 730020)
青藏高原几种牧草附着耐低温乳酸菌的筛选
许冬梅1, 曹 蕾2, 荆佩欣1, 张永辉2, 张红梅3, 张万祥2, 郭旭生1*
(1.兰州大学生命科学学院 草地农业生态系统国家重点实验室,甘肃 兰州 730000;2.甘肃省草原技术推广总站,甘肃 兰州 730046; 3.兰州大学草地农业科学技术学院草地农业生态系统国家重点实验室,甘肃 兰州 730020)
为筛选出适宜青藏高原低温发酵优良菌株,针对从青藏高原垂穗披碱草(Elymusnutans)、燕麦(AvenasativalL.)和藏嵩草(Koeleriatibetica)中分离出的148株乳酸菌,经10 ℃低温条件下MRS液体培养基与不同培养时间(12、24、36和48 h)初筛后,进一步将初筛的菌株通过不同温度 (10、15和25 ℃) 条件下绿汁发酵液的复筛,并对其进行生理生化特性研究。结果表明,植物乳杆菌(Lactobacillusplantarum) 31、干酪乳杆菌(Lactobacilluscasei) Q5、戊糖片球菌(Pediococcuspentosaceus) Q6和棒状乳杆菌(Lactobacilluscoryniformis) Q7 这4株菌在MRS液体培养基和绿汁发酵液较低温环境中生长活性和快速产酸能力较强,而且生理生化特性指标表明,Q5比对应模式菌具有更广泛的糖源利用能力,Q7较对应模式菌具有更强的耐酸和耐低温特性。因此,上述4株乳酸菌可作为适宜青藏高原低温发酵青贮饲料备选菌株。
青藏高原;乳酸菌;绿汁发酵液;低温
由于青藏高原纬度低,海拔高,气候严寒,空气密度小,紫外线强,降雨量少,牧草生长期短,饲草产量低,造成青藏高原牧区饲草短缺限制畜牧业发展。近年来,随着牧草保存和加工技术的提高,青藏高原地区的饲草加工水平相对有所提高,饲草青贮技术在该地区开始推广。普通牧草青贮过程是各类微生物综合发酵的过程,主要有乳酸菌、酵母菌和霉菌等;理想牧草青贮应使乳酸菌发挥主要作用,甚至应由乳酸菌控制发酵全程。青贮可以利用乳酸菌分解有机质产生的乳酸降低青贮饲料pH值,维持健康的发酵环境,同时促进可溶性碳水化合物和粗纤维的转化,提高青贮饲料的青贮品质和适口性。乳酸菌是一种益生菌,可促进动物消化和营养物质的吸收,利于有机无公害畜产品的生产。因此,乳酸菌作为一种青贮饲料添加剂非常有利于高品质牧草的保存和有机畜牧业的发展。目前,国内对乳酸菌种质资源的开发越来越多,对乳酸菌添加至青贮饲料中的研究开始被广泛关注。韩吉雨[1]从玉米(Zeamays)和苜蓿(Medicagosativa)青贮饲料中分离鉴定出植物乳杆菌、短乳杆菌(Lactobacillusbrevis)、魏斯氏菌(Weissellacibaria)等,而从不同地区的玉米和苜蓿青贮原料中发现了较多与青贮发酵无关的菌种,其中乳酸菌种类有植物乳杆菌、魏斯氏乳酸菌及布什乳杆菌(Lactobacillusbuchneri),但数量相对较少 。高静[2]、杨杨[3]和秦丽萍[4]也从来自青藏高原的不同种类牧草中发现了植物乳杆菌、戊糖片球菌、清酒乳杆菌(Lactobacillussakei)、魏斯氏乳酸菌、肠膜明串珠菌(Leuconostocmesenteroides)、短乳杆菌等。一般市售乳酸菌添加剂的最适生长温度约为 30 ℃,而青藏高原牧草收获季节的平均温度为10~20 ℃[5],温度成为限制青藏高原牧草青贮乳酸菌添加剂利用的关键因素。而有关我国高寒地区牧草附着乳酸菌及耐低温乳酸菌的研究鲜见报道。本研究通过青藏高原耐低温乳酸菌的筛选,探索出适宜青藏高原低温环境的青藏高原本土乳酸菌,为青藏高原饲草青贮提供优良乳酸菌添加剂。
1 材料与方法
1.1 材料
1.1.1 原料 2013年8月于西藏当雄地区采集藏嵩草和燕麦,将藏嵩草和燕麦草样剪碎至2~3 cm后晾至水分含量为65%~70%,用30 cm×23 cm聚氯乙烯塑料袋装200 g草样,真空包装机抽真空并封口后带回实验室青贮。
1.1.2 菌种来源 来自青藏高原燕麦和藏嵩草表面的乳酸菌共40株,进行MRS液体培养基及绿汁发酵液筛选;本课题组于2012年7月从青藏高原果洛藏族自治州采集的垂穗披碱草青贮饲料中分离得到108株乳酸菌,经过液体培养基筛选后,确定7株乳酸菌为优良乳酸菌[4]。其编号和菌种依次为Q1(清酒乳杆菌)、Q2(植物乳杆菌)、Q3(短乳杆菌)、Q4(弯曲乳杆菌(Lactobacilluscurvatus))、Q5(干酪乳杆菌)、Q6(戊糖片球菌)、Q7(棒状乳杆菌)。这7株乳酸菌参与本研究中绿汁发酵液筛选。生理生化特性试验中用购自中国普通工业微生物中心(CGMCC)的模式菌作对比,编号和菌种依次为1.2437(植物乳杆菌)、1.2435(干酪乳杆菌)、1.2695(戊糖片球菌)、1.1879(棒状乳杆菌)。
1.1.3 培养基 绿汁发酵液:将采集的拔节期新鲜草地早熟禾(Poapretensis)(多年生,适宜气候冷凉、湿度较大的环境,抗寒能力强,耐旱性稍差,耐践踏。根状茎繁殖迅速,再生能力强,耐修剪)按草∶水=1∶2.5比例(质量比),先用榨汁机榨取绿汁发酵液,再用4层纱布过滤,1 000 r/min离心后4 ℃冷藏备用。由于绿汁发酵液不进行灭菌处理,建议现制现用。
1.1.4 主要仪器与设备 PB-10pH计(赛多利斯科学仪器有限公司)、MLS-3780高压灭菌锅(三洋公司)、DYY-6C电泳仪(北京市六一仪器厂)、U-2910紫外可见分光光度计(日立公司)、SIM-F140Y65制冰机(三洋公司)、Microfuge 18型台式离心机(BECKMAN公司)、生化反应管(20支×0.25 mL)(杭州滨和微生物试剂有限公司)、细菌总基因组DNA提取试剂盒(天根生化科技有限公司)。
1.2 方法
1.2.1 乳酸菌分离纯化 ①菌体分离:将青贮9和14 d后的藏嵩草和燕麦样品,用灭菌后的榨汁机(主要靠酒精和紫外线灭菌)按草∶水=1∶5比例(质量比)进行榨汁,然后分装至灭菌的15 mL离心管中,添加质量分数2%的葡萄糖,分别置于15 ℃和25 ℃下培养0.5、1和2 d,按照10-1~10-5进行稀释后,选取适当浓度涂MRS固体培养基[4]平板,分别置于无菌厌氧盒15 ℃和25 ℃生化培养箱中厌氧培养3 d,根据菌落形态,大小、光泽、透明度等,挑取优势菌的单菌落,进行革兰染色、过氧化氢酶检验和油镜镜检试验[6]。革兰染色阳性、过氧化氢酶阴性的菌株均为疑似乳酸菌。②优势菌纯化:将挑出的优势菌用划线法,先在37 ℃厌氧条件和MRS固体培养基上培养48 h,然后挑选单菌落连续纯化2次后,接种至MRS液体培养基培养12 h,再加入体积分数10%的二甲基亚砜,保存在-80 ℃超低温冰箱备用。
1.2.2 优势菌菌种鉴定 ①DNA提取:将所挑优势菌菌液按照体积分数10%的接种量接到MRS液体培养基中,37 ℃厌氧培养12 h以上,连续活化2~3次后进行DNA提取。使用天根细菌DNA提取试剂盒,具体方法严格遵守试剂盒使用方法说明。②PCR扩增16S rDNA基因序列:引物序列为27f∶5′-AGAGTTTGATCCTGGCTCAG-3′和1492r:5′-AAGTCGTAACAAGGTAACC-3′。PCR扩增反应体系为95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s;72 ℃ 5 min,循环30次[7]。扩增完成后,取5 μL扩增产物与等量的6×Loading Buffer混合进行琼脂糖凝胶电泳,电泳后在紫外灯下与Marker条带对比观察是否有与之对应的亮带。确保PCR扩增成功后进行下一步送样测序。③16S rDNA基因序列测序:将PCR产物送样测序,测序由上海美吉生物技术有限责任公司完成。④16S rDNA基因序列同源性分析:将乳酸菌菌株16S rDNA基因序列在GenBank中用BLAST(http://blast.ncbi.nlm.nih.gov/blast.cgi)程序搜索与待测菌株同源性最高的菌种。如测序菌株与搜索出的同源性最高菌株同源性高于97.5%,一般便可判断它们属于同一个种[8-10]。本研究中,选取同源性≥ 99%的菌种进行对照。
1.2.3 耐低温乳酸菌筛选及生理生化指标测定 ①优势菌MRS液体培养基初筛:将纯化后的乳酸菌菌液按照10%的接种量,用MRS液体培养基活化2~3次后,稀释菌液,使其数量为108cfu/g,按3%的接种量,将稀释好的菌液接至MRS液体培养基,分别于10 ℃条件下低温培养3 d。在600 nm处测定其吸光值(OD值),同时用pH计测定发酵液酸度,选取OD值高且pH值低的菌株作为初筛优良菌。将MRS液体培养基初筛所得优良菌进行绿汁发酵液筛选。②绿汁发酵液筛选:分别把活化好的乳酸菌稀释至108cfu/g,按3%的接种量将乳酸菌稀释液接种到装有绿汁发酵液的灭菌的15 mL离心管中,分别置于10、15和25 ℃培养箱中培养3 d,测定发酵液pH值,选择pH值较低的乳酸菌为优良乳酸菌。③乳酸菌生理生化特性测定:因在菌体分离过程中已经完成革兰染色试验和过氧化氢酶检验及油镜镜检试验,此处只进行不同温度和pH值条件下MRS液体培养基培养,糖发酵试验与精氨酸产氨、葡萄糖产气和硝酸盐还原试验。a.MRS液体培养基培养,按3%接种量将稀释至乳酸菌为106cfu/g的菌液,接至MRS液体培养基,分别在4、10、15、25、45和50 ℃条件下培养3 d,分光光度计600 nm处测定其OD值,同样在pH值为3.0、3.5、4.0、8.0、8.5和9.0条件下,37 ℃培养3 d后测定其OD值,以判断其生长状况;b.糖发酵试验和精氨酸产氨、葡萄糖产气和硝酸盐还原试验全部采用细菌微量生化反应管,用接种针从平板挑取单菌落至生化管,灭菌石蜡封口,37 ℃培养72 h,观察其变色情况,操作严格按照使用说明书进行。
1.2.4 数据分析 所得数据用EXCEL进行基础数据计算,并制作图表。用SPSS17.0进行单因素方差分析。
2 结果与分析
2.1 16S rDNA菌种鉴定
本试验分离得到的40株乳酸菌经过16S rDNA测序后发现,40株乳酸菌分属于植物乳杆菌和戊糖片球菌两个种,其中来自青藏高原燕麦的植物乳杆菌4株,戊糖片球菌16株;来自藏嵩草的植物乳杆菌6株,戊糖片球菌14株(表1)。

表1 16S rDNA菌种鉴定结果
2.2 MRS液体培养基筛选
40株乳酸菌在10 ℃、MRS培养液中培养12 h时,编号为11、14、15、16、24、31、34、38的乳酸菌MRS培养液OD值均超过0.3;24 h时,11、12、14、15、16、24、31、34的OD值均高于0.6;36 h时,14、15、16、17、18、24、31的OD值达0.8以上;48 h时,14、15、16、17、24的OD值均在1.0以上(图1)。
40株乳酸菌在10 ℃下MRS培养液的pH值在培养12 h时,编号为14、15、16、24、31、34的乳酸菌MRS培养液pH值为5.4左右;24 h时,14、15、24、31、34的pH值低于5.4;36 h时,14、15、16、17、18、24、31的pH值低于5.2;48 h时,14、15、16、17、18、24、31、34的pH值低于5.0(图2)。 综合乳酸菌MRS培养液的OD值和pH值,确定编号为14、15、16、17、18、24、31的乳酸菌为初筛优良乳酸菌。
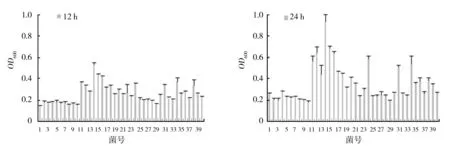

图1 40株菌10 ℃ MRS培养液中培养12、24、36和48 h菌液OD值Fig.1 OD value of bacteria solution incubated at 10 ℃ in MRS medium for 12,24,36 and 48 h

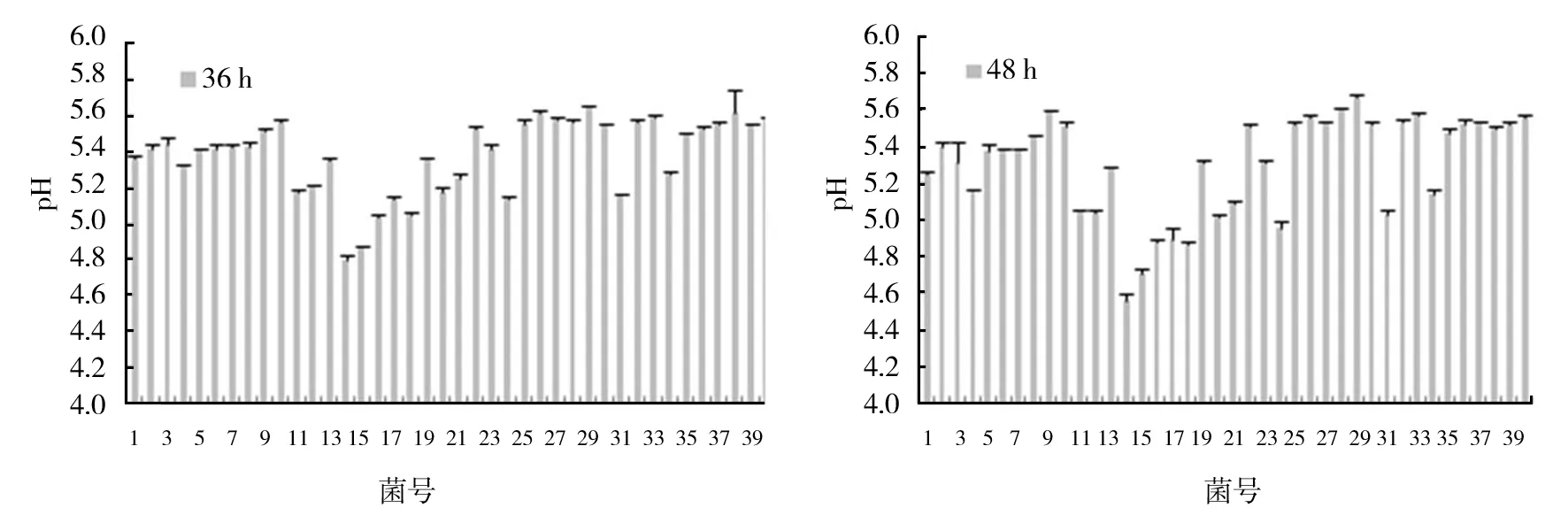
图2 40株菌10 ℃ MRS培养液中培养12、24、36和48 h菌液pH值Fig.2 pH value of bacteria solution incubated at 10 ℃ in MRS medium for 12、24、36 and 48 h
2.3 绿汁发酵液筛选
绿汁发酵液在10、15、25 ℃条件下培养48 h后pH值结果见表2。10 ℃条件下,编号为14、15、16、31、Q5、Q6、Q7的7株乳酸菌绿汁发酵液pH值低于5.50,尤其是14的发酵液pH值最低为5.32;15 ℃条件下,编号为31、Q3、Q4、Q5、Q6、Q7的6株乳酸菌发酵液pH值在4.70左右,其中Q7、Q6的绿汁发酵液pH值最低,降低至4.6左右;25 ℃条件下,除编号为16、17、Q2、Q3的4株乳酸菌发酵液pH值显著高于其他菌株,其余菌株pH值均降低至4.0左右。综合三个温度条件下绿汁发酵液的pH值以及乳酸菌来源,考虑编号为14、31、Q5、Q6、Q7为耐低温优良乳酸菌,但由于14与Q6同为戊糖片球菌,综合考虑,最终确定编号为31、Q5、Q6、Q7的乳酸菌作为青藏高原耐低温乳酸菌。

表2 10、15、25 ℃下乳酸菌在绿汁发酵液中培养48 h时pH值
注:14、16、17、18、Q6:戊糖片球菌;15、24、31、Q2:植物乳杆菌;Q1:清酒乳杆菌; Q3:短乳杆菌;Q4:弯曲乳杆菌;Q5:干酪乳杆菌; Q7:棒状乳杆菌;同行不同字母表示差异显著(P<0.05)
2.4 所选优良菌株生理生化特性
所选耐低温乳酸菌生理生化特性结果见表3。4株耐低温乳酸菌各自与其对应的模式菌进行糖源利用能力对比后发现,实验室所选植物乳杆菌不能利用棉籽糖和蜜二糖,植物乳杆菌的模式菌1.2437可以利用,对其他糖源的利用能力除了效率有所差异外,其结果差异不大;虽然实验室所选干酪乳杆菌不能利用乳糖,其对应模式菌1.2435可以利用,但是它可以利用山梨醇、苦杏仁苷、七叶苷、纤维二糖,而与其对应的模式菌则不能利用,干酪乳杆菌与其对应的模式菌利用其他糖源的能力一致,所以,实验室所选干酪乳杆菌糖源利用能力强于购自CGMCC干酪乳杆菌模式菌。实验室所选戊糖片球菌可以利用甘露醇、山梨醇,对鼠李糖可微弱利用,但其对应的模式菌1.2695则不能利用,戊糖片球菌的模式菌可以利用乳糖和L-阿拉伯糖,但是实验室筛选的戊糖片球菌不能利用这两种糖源。实验室筛选的棒状乳杆菌和其对应的模式菌糖源利用能力差异不大。综合来看,除了干酪乳杆菌外,其他菌株与其对应的模式菌糖源利用能力差异不大。
实验室所选植物乳杆菌和干酪乳杆菌都可以精氨酸产氨,其对应的模式菌不能利用精氨酸产氨,而戊糖片球菌的模式菌1.2695可以精氨酸产氨,实验室所选戊糖片球菌不可以(表3)。
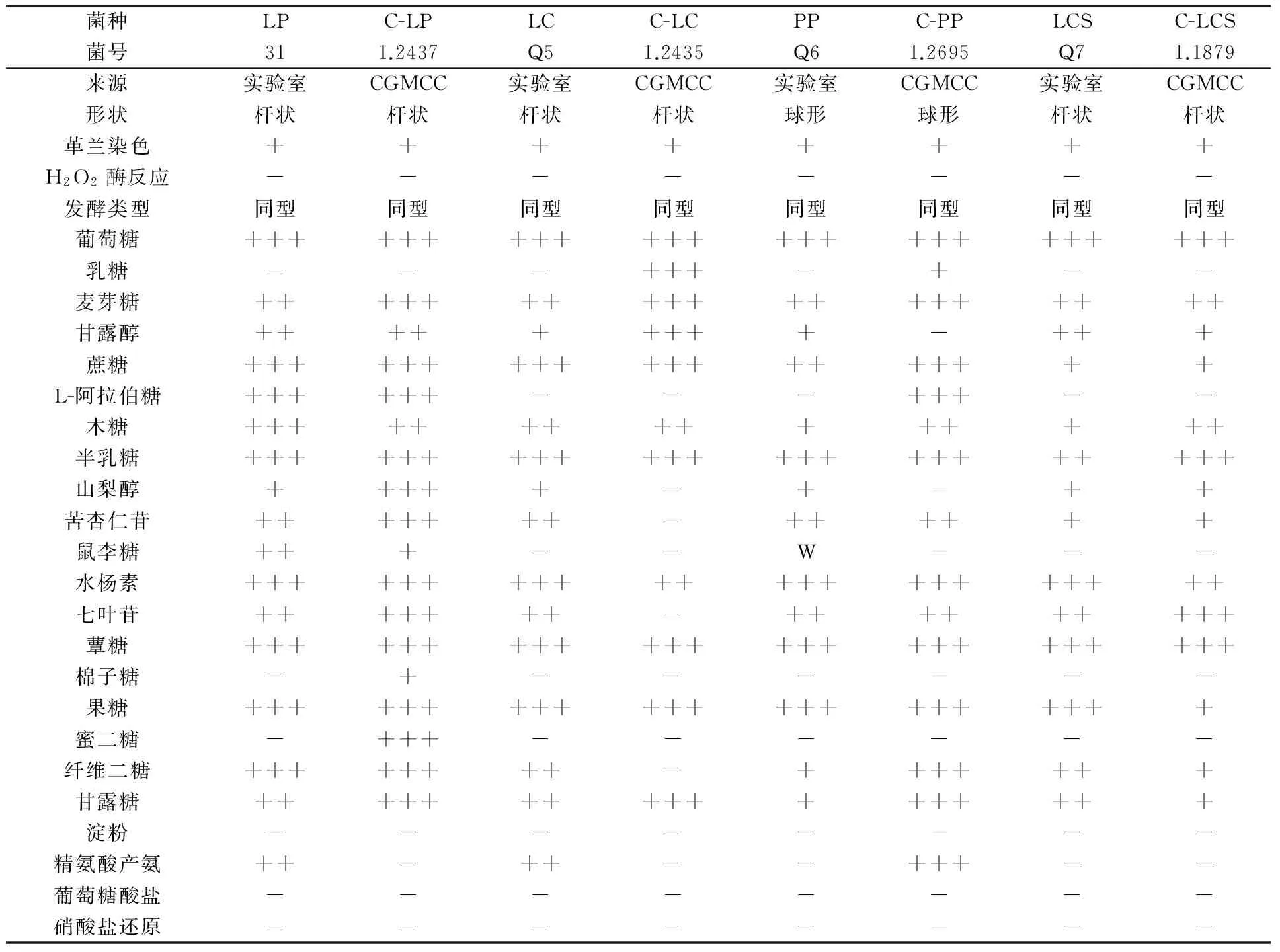
表3 耐低温乳酸菌生理生化特性
注:31:植物乳杆菌,1.2437:植物乳杆菌模式菌;Q5:干酪乳杆菌,1.2435:干酪乳杆菌模式菌;Q6:戊糖片球菌,1.2695:戊糖片球菌模式菌;Q7:棒状乳杆菌,1.1879:棒状乳杆菌模式菌;“+++”代表糖发酵管在18~24 h以内变色;“++”代表糖发酵管在24~36 h以内变色;“+”代表糖发酵管在36~72 h以内变色;W代表糖发酵管在72 h时颜色从深蓝紫色变成无色;“-” 代表不变色
乳酸菌在不同pH值条件下MRS液体培养基中培养3 d后的生长状况见表4。pH 3.0时,所有乳酸菌均不能生长;pH 3.5时,只有植物乳杆菌和棒状乳杆菌的模式菌不能生长,其他乳酸菌可以微弱生长;pH 4.0、8.0、8.5、9.0条件下,所有乳酸菌都生长良好。碱性环境中,乳酸菌可以利用自身产生的乳酸中和环境pH值,从而生长良好。在4 ℃条件下,菌株Q5、Q6和Q7能微弱生长,模式菌则不能生长;10 ℃条件下,实验室所选菌只有棒状乳杆菌生长情况一般,不如对应的模式菌株,其他实验室所选菌生长都优于对应模式菌;15、25和45 ℃条件下,所有乳酸菌菌株都能良好生长;而在50 ℃条件下培养3 d后,所有乳酸菌都不能生长。
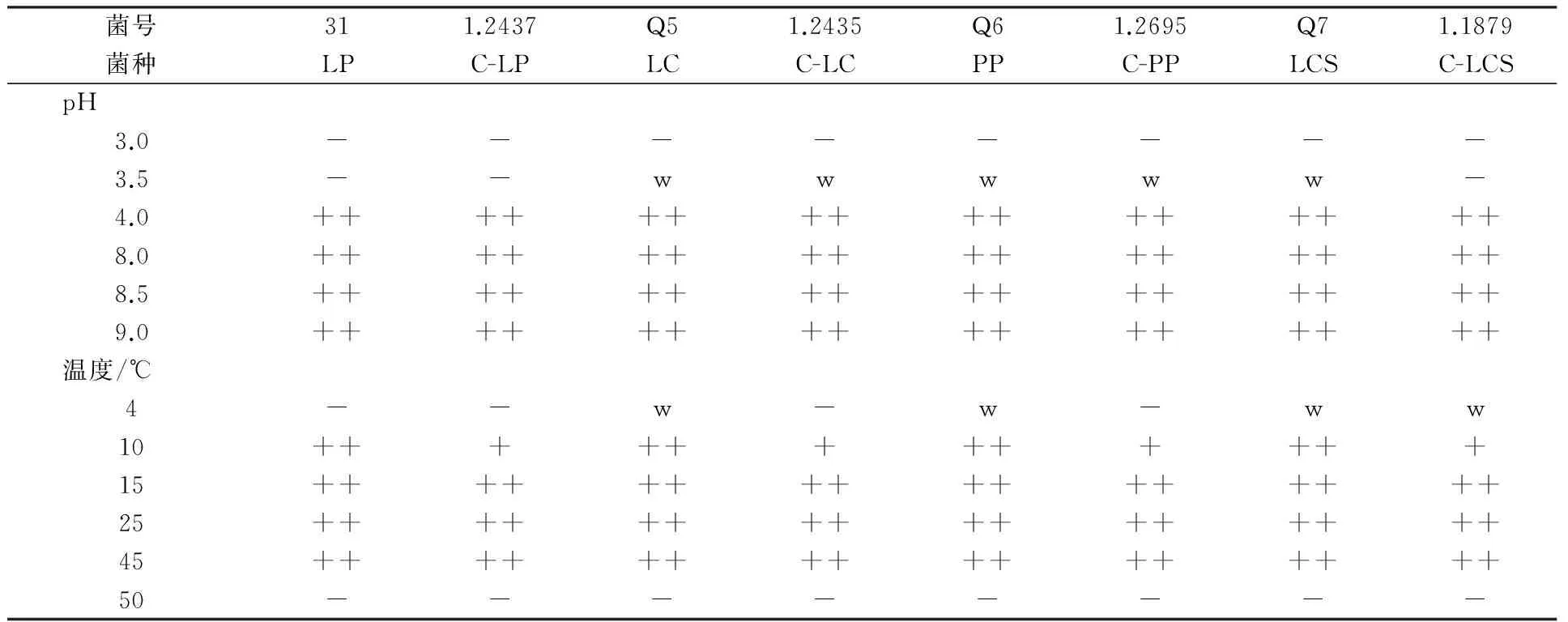
表4 耐低温乳酸菌在不同pH值和不同温度的MRS液体培养基中的生长状况
注: ++、+、w、- 分别表示生长良好(OD>0.5)、可生长(0.1 低温成为限制传统乳酸菌添加剂在青藏高原利用的重要因素,因为一些乳酸菌不能在低温环境中良好生长(低于15 ℃)[11-12]。分离筛选耐低温乳酸菌可能成为提高青藏高原青贮饲料品质的有效途径。长期生存于特殊环境中的微生物具有能够适应恶劣环境的特性,与模式菌相比本研究中筛选的乳酸菌表现出更强的耐低温特性。菌株Q5、Q6和Q7能在4 ℃环境下微弱生长,在10 ℃ 环境下生长良好,该结果与Pang等[13]从青藏高原分离乳酸菌研究结果相似,而Tohno等[14]分离的乳酸菌大部分都不能在10 ℃环境中生长。高静[2]、杨杨[3]、秦丽萍[4]发现青藏高原乳酸菌与传统商品乳酸菌相比可以利用更广泛的糖源。本研究对所选4株优良菌株进行糖发酵试验发现,实验室所选的干酪乳杆菌和戊糖片球菌均不能利用乳糖,而其对应的模式菌可以利用。编号为Q5的干酪乳杆菌可以利用山梨醇、苦杏仁苷、七叶苷和纤维二糖,而模式菌不可以利用,其具有更广泛的糖源利用能力。本研究中与模式菌相比,只有部分乳酸菌可以利用更广泛的糖源。本研究结果和上述文献的结果有出入,可能是所选乳酸菌种间有差异。 本研究从当雄地区藏嵩草和燕麦青贮样品中分离得到的40株乳酸菌分属于植物乳杆菌和戊糖片球菌两个种。Ennahar等[15]从不同发酵时期的青贮饲料中分离得到的株菌,经过16S rDNA序列分析分属于肠球菌、明串珠菌属、片球菌、乳杆菌属和乳球菌属。杨杨[3]对藏北嵩草附着乳酸菌进行分离鉴定,从德庆、那曲古露和纳木错地区藏北嵩草表面共分离得到的19株乳酸菌分属于明串珠菌(Leuconostocmensenteroides)和魏斯氏(Weissella)乳酸菌两个属。本研究分离的乳酸菌和杨杨[3]的研究不一致,这可能是由于样品来源地不同,微生物生存的微环境不同。徐婷等[16]对青海省人工种植的燕麦表面乳酸菌进行分离鉴定后发现,植物乳杆菌、戊糖片球菌和干酪乳杆菌[16]与本研究中乳酸菌的鉴定结果相似,说明不同地区的同种饲草的乳酸菌种类既有相似又有不同。秦丽萍在对来自青藏高原青海省玛沁县的垂穗披碱草附着乳酸菌进行分离鉴定后发现,所分离的108株乳酸菌分属于18个种,其中就包括植物乳杆菌和戊糖片球菌[4],说明不同地区的饲草,其微生物构成既有联系又有区别。另外,秦丽萍用灭菌绿汁发酵液进行15和25 ℃下乳酸菌的筛选后确定清酒乳杆菌Q1、植物乳杆菌Q2、戊糖片球菌Q6作为优良乳酸菌,与本研究结果不一致[4],这说明绿汁发酵液灭菌与否对乳酸菌的生长有明显影响。这可能是因为未灭菌绿汁发酵液中杂菌种类较多,与乳酸菌的生长发酵形成竞争,但是具体的竞争机理尚不明确。 MeDonald等[17]和Woolford[18]提出,在青贮过程中发挥作用的乳酸菌应该具有统一的发酵途径,有效利用可溶性碳水化合物,快速发酵产生足够的乳酸,有一定的耐酸能力,使得青贮饲料pH值达到4.0左右,以抑制有害微生物的生长,提高青贮饲料品质,维持青贮体系稳定。由此可见产酸能力和耐酸能力是衡量乳酸菌在青贮过程中发酵性能的重要指标。本研究对所分离的乳酸菌进行10 ℃条件下MRS液体培养基的初筛,培养48 h后,表现较好的乳酸菌培养液pH值降低至5.0左右。而用未灭菌的绿汁发酵液进行筛选时,10 ℃条件下发酵3 d后,培养液pH值由发酵前的6.3降低至5.4左右,尤其是编号为Q6的戊糖片球菌,其在绿汁发酵液筛选过程中不同温度下pH值都较低;在对所选乳酸菌进行不同pH值条件下的培养时发现,实验室所选的青藏高原棒状乳杆菌比对应的模式菌株具有更强的耐酸性。本研究所筛选的优良乳酸菌有待进一步验证其青贮性能。 本研究从燕麦、藏嵩草和垂穗披碱草中共分离出148株乳酸菌,筛选后最终确定编号为31(植物乳杆菌)、Q5(干酪乳杆菌)、Q6(戊糖片球菌)和Q7(棒状乳杆菌)为青藏高原耐低温优良菌株,可作为当地优良发酵备选菌株。通过对其生理生化特性的研究发现,编号为Q5的干酪乳杆菌比与之对应的模式菌具有更广泛的糖源利用能力;棒状乳杆菌Q7与其模式菌相比,具有更强的耐低温与耐酸特性。 [1] 韩吉雨.青贮发酵体系中乳酸菌多样性的研究[D].呼和浩特: 内蒙古农业大学,2009. [2] 高静.藏北嵩草附着乳酸菌的生物学特性及对苜蓿青贮饲料发酵品质的影响[D].兰州:兰州大学,2013. [3] 杨杨.西藏地区藏嵩草附着乳酸菌分离、鉴定及理化特性研究[D].兰州: 兰州大学,2013. [4] 秦丽萍. 青藏高原垂穗披碱草青贮饲料中耐低温乳酸菌的筛选及其发酵性能的研究[D].兰州:兰州大学,2014. [5] 崔棹茗, 郭刚, 原现军,等. 青稞秸秆青贮饲料中优良乳酸菌的筛选及鉴定[J]. 草地学报,2015,23(3): 607-615. [6] 赵斌,何绍江.微生物学试验[M].北京:科学出版社,2002. [7] Cai Y, Benno Y, Ogawa M, et al. Effect of applying lactic acid bacteria isolated from forage crops on fermentation characteristics and aerobic deterioration of silage[J]. Journal of Dairy Science,1999, 82(3): 520-526. [8] Rachman C N, vKabadjova P, Prevost H, et al. Identification ofLactobacillusalimentariusandLactobacillusfarciminiswith 16S-23S rDNA intergenic spacer redion polymorpHism and PCR amplification using species-specific oligonucleotide[J]. Journal of Applied Microbiology, 2003, 95(6):1207-1216. [9] Bringel F, Castini A, Olukoya D K, et al.Lactobacillusplantarumsubsp.Argentoratensissubsp.nov.,isolated from vegetabie matrices[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(Pt4):1629-1634. [10]McGarvey J A, Franco R B, Palumbo J D, et al. Bacterial population dynamics during the ensiling ofMedicagosativaand subsequent exposure to air[J]. Journal of Applied Microbiology, 2013, 114(6): 1661-1670. [11]Chen M M, Liu Q H, Xin G R, et al. Characteristics of lactic acid bacteria isolates and their inoculating effects on the silage fermentation at high temperature[J]. Applied Microbiology, 2013, 56(1):71-78. [12]Zhang Q, Yu Z , Wang X G. Isolating and evaluating lactic acid bacteria strains with or without sucrose for effectiveness of silage fermentation[J].Grassland Science, 2014, 61(3): 167-176. [13]Pang H L, Tan Z F, Qin G Y, et al. Phenotypic and phylogenetic analysis of lactic acid bacteria isolated from forage crops and grasses in the Tibetan Plateau[J]. Journal of Microbiology, 2012,50(1):63-71. [14]Tohno M, Kobayashi H, Nomura M, et al. Genotypic and phenotypic characterization of lactic acid bacteria isolated from Italian ryegrass silage[J]. Animal Science Journal, 2012, 83(2): 111-120. [15]Ennahar S, Cai Y M,Fujita Y. Phylogenetic diversity of lactic acid bacteria associated with paddy rice silage as determined by 16S ribosomal DNA[J]. Applied and Environmental Microbiology, 2003, 69(1):444-451. [16]徐婷,崔占鸿,钟谨,等.青海省部分地区人工种植燕麦青贮乳酸菌的筛选[J].江苏农业科学,2015,43(2):204-212. [17]MeDonald P, Henderson A R, Heron S J E. The biochemistry of silage[M].Abersytwyth, UK:Chalcombe Publications,1981:199-208. [18] Woolford M K. The detrimental effeets of air on silage[J].Journal of Applied Bacteriology, 1990, 68(2):101-112. Screening of Cryophilic Lacto-Bacteria from Several Qinghai-Tibet Plateau Herbages XU Dong-mei1, CAO Lei2, JING Pei-xin1, ZHANG Yong-hui2, ZHANG Hong-mei3, ZHANG Wan-xiang2, GUO Xu-sheng1 (1.Schl.ofLifeSci.,StateKeyLab.ofGrassland&Agro-Ecosys.,LanzhouUni.,Lanzhou730000; 2.GansuProv.DisseminationSta.ofGrasslandTech.,Lanzhou730046; 3.Coll.ofPastoralAgric.Sci. &Technol.,StateKeyLab.ofGrassland&Agro-Ecosys.,LanzhouUni.,Lanzhou730020) In order to screen lacto-bacteria (LAB) that can adapt low temperature fermentation in Qinghai-Tibet Plateau 148 strains fromElymusnutans, oat andKoeleriatibeticain Qinghai-Tibet Plateau were isolated. These strains were confirmed as cryophilic LAB by means of culture medium under 10 ℃ for different time (12, 24, 36 and 48 h) and rescreened by fermented in green juice at 10 ℃,15 ℃ and 25 ℃, as well as studied their physiological and biochemical characteristics. The results showed that strains 31 (Lactobacillusplantarum), Q5 (Lactobacilluscasei), Q6 (Pediococcuspentosaceus), and Q7 (Lactobacilluscoryniformis) performed higher activity and acid-producing ability in MRS medium and fermented in green juice, and the physiological and biochemical characteristics indexes indicted that Q5 could performed more kinds of carbohydrates than corresponding model strain, Q7 had stronger acid and low temperature resistance properties than model strain. The above four LAB strains can be alternative strains for low temperature fermentation of ensilage in Qinghai-Tibet Plateau. Qinghai-Tibet Plateau; lacto-bacteria; green juice fermented broth; low temperature 国家自然科学基金项目(31272486);甘肃省2016年草牧业试验试点和草业技术创新联盟科技支撑项目(GCLM2016002) 许冬梅 女, 硕士研究生。研究方向为青贮饲料与乳酸菌发酵。E-mail: xudm15@lzu.edu.cn * 通讯作者。男,教授,博士,博士生导师。主要从事的研究方向为青藏高原乳酸菌种质资源发掘、创新与利用;饲料青贮技术及 2016-07-25; 2016-08-26 Q939.11+7 A 1005-7021(2017)03-0087-08 10.3969/j.issn.1005-7021.2017.03.014 营养价值评价。E-mail:guoxsh07@lzu.edu.cn3 讨 论

