不同来源溶藻菌的分离、鉴定及溶藻效果比较
章登岚, 赵以军, 吴 刚, 程 凯
(湖北工业大学 资源与环境工程学院 河湖生态修复与藻类利用湖北省重点实验室,湖北 武汉 430068)
不同来源溶藻菌的分离、鉴定及溶藻效果比较
章登岚, 赵以军, 吴 刚, 程 凯*
(湖北工业大学 资源与环境工程学院 河湖生态修复与藻类利用湖北省重点实验室,湖北 武汉 430068)
为了探究从何种类型的自然生境中更易分离得到溶藻微生物,采用高氏1号培养基分别从水库底泥、湖泊底泥、农田土壤、林地土壤等四种来源共36份样品中分离了7 600株菌,并最终从中筛选得到了5株溶铜绿微囊藻(Microcystisaeruginosa)的溶藻菌,其中4株为假单胞菌(Pseudomonassp.),1株为黄杆菌(Flavobacteriumsp.),5株菌溶藻效率的变化范围为62%~95%。结果表明,当采用高氏1号培养基作为分离培养基时,湖泊底泥和水库底泥中的成功筛选概率最高,农田土壤次之,而林地土壤中则难以筛选得到,假单胞菌是较容易筛选得到的溶藻菌。
溶藻微生物;铜绿微囊藻;假单胞菌;黄杆菌
水体富营养化引起蓝藻水华的频发,造成严重的生态破坏及巨大的经济损失,蓝藻毒素也对人类健康有极大威胁[1]。微生物控藻技术安全、环保、有效,已备受关注[1]。溶藻细菌是能通过直接或间接方式抑制藻类生长或杀死藻类的微生物。许多研究表明水华和赤潮的突然消亡可能与溶藻微生物的感染有关[2-5]。面对日益严重的水华问题,在物理、化学和其他生物方法除藻技术仍存在诸多局限的情况下,采用微生物控藻技术控制水华和赤潮受到国内外的广泛关注[6-7]。目前报道的溶藻微生物大多分离自发生水华或赤潮的海洋或湖泊[8-12]。而土壤中的微生物种类多,数量大,农田土壤土质肥沃,具备了微生物所需的营养、空气和水分,是抗生素生产菌的常见分离来源[13]。此外,Yamamoto等[14]从富营养湖泊底泥中成功分离出了溶藻放线菌;Jia等[15]从林地土壤中分离得到了可抑制微囊藻的Trichaptumabietinum;梁锏文等[16]从发生水华的池塘边土壤中分离到了高效溶藻的弗氏链霉菌(Streptomycesfradiae)。但目前未见文献报道何种来源的环境样品中更容易分离得到溶藻微生物。本研究比较了从水库底泥、湖泊底泥、农田土壤、林地土壤中筛选分离抑制铜绿微囊藻(Microcystisaeruginosa)的溶藻微生物的分离效率,并对分离得到的溶藻微生物进行了分类鉴定和溶藻能力测试。
1 材料与方法
1.1 材料
1.1.1 藻种 铜绿微囊藻(M.aeruginosa,FACHB-905),来源于中国科学院水生生物研究所淡水藻种库。藻种活化后置于光照培养箱中培养,培养条件为温度 25 ℃,光照强度 2 000 lx,光暗周期为12 h∶12 h 条件下培养,每天定时振荡3~4 次。
1.1.2 菌种来源 收集湖北省内3个水库(枣阳市华阳河水库、十堰市郧西县土门水库、枣阳市东郊水库)和4个湖泊(神龙架林区大九湖、武汉市关桥湖、武汉市后湖、武汉市鲁湖)的表层底泥、湖北工业大学周边18块农田(包括大蒜地、小麦地、小白菜地、大白菜地、上海青地、草莓地、油菜地、韭菜地、芭蕉地、蚕豆地、茼蒿地、棉花地、萝卜地、芋头地、生菜地、桃树地、番薯地、芹菜地)和11个林地(梅花树地、竹林地、杉树地、雪松地、柳树地、棕榈地、槐树地、樱花树地、梧桐树地、石楠树地、桂花树地)的表层土样,分别取2 g泥/土样加入20 mL生理盐水中,加玻璃珠震荡摇匀。
1.1.3 培养基 铜绿微囊藻培养基:BG11培养基[17-18];微生物培养基:高氏1号培养基[19]。
1.2 方法
1.2.1 分离纯化微生物 采用平板划线法从1.1.2所述的36个环境样品中分离微生物。
1.2.2 溶藻能力测试 将纯化后的菌落接种至高氏1号液体培养基中,25 ℃、150 r/min振荡培养3 d,按1∶10的体积比接种至对数期的藻液中,观察藻液是否出现黄化。为排除高氏1号培养基对藻类生长的影响,对照组为将高氏1号液体培养基按1∶10的体积比添加至藻液中,阴性对照组为无任何添加的藻液。实验组、对照组和阴性对照组均设置3次重复,接种菌液后第5天取样镜检计数藻细胞数。溶藻效率(%)=((Nck-N5)/ Nck)×100%,N5为第5天实验组的藻细胞数,Nck为第5天对照组的藻细胞数。
1.2.3 溶藻微生物的鉴定 根据《一般细菌常用鉴定方法》[20],用牙签挑取培养48 h的菌落定容至100 μL的蒸馏水中作为模板,按照如下体系进行PCR扩增: 0.2 μL TakaraTaq(15 U/μL);2 μL 10×Buffer(提取缓冲液);1.6 μL dNTP Mixture (2.5 mmol/L);5.8 μL Template(模板);0.2 μL上游引物(27F);0.2 μL下游引物(1492R);10 μL超纯水。反应条件:94 ℃预变性5 min;94 ℃变性45 s;56 ℃退火1 min;72 ℃延伸1.5 min;共30个循环。PCR产物由生工生物工程(上海)有限公司进行测序,要求双向测通,将拼接后的测序结果利用Blastn进行比对。
1.2.4 统计分析 试验均采用3次重复,数据分析采用SPSS进行,均值比较采用单因素方差分析;制图采用GraphPad Prism 5(误差量用SD表示,n=3)。
2 结果与分析
2.1 溶藻菌株的来源分析
本研究从不同来源的样品中共分离了7 600株菌,其中5株能够有效溶解铜绿微囊藻,见表1。
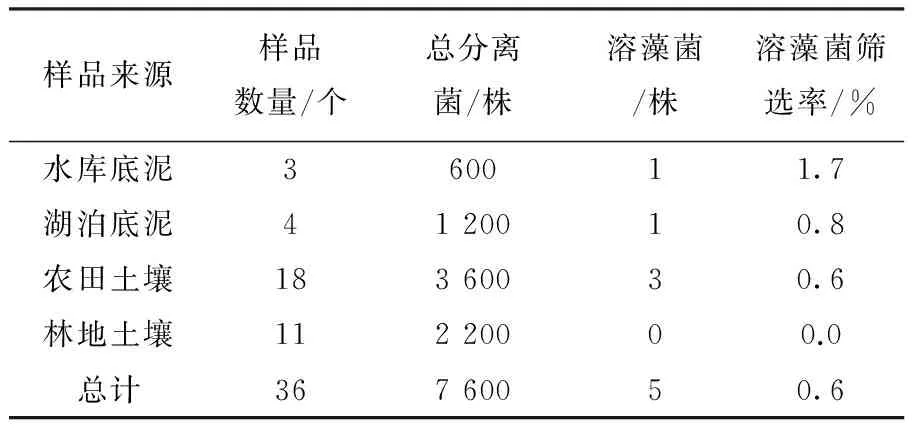
表1 溶藻菌的分离来源
由表1可见,水库底泥中溶藻菌的筛选率较高,农田土壤中的筛选率处于平均水平,而林地土壤中的筛选率则非常低。此外,溶藻菌的平均筛选率低于千分之一,说明采用常规方法分离溶藻菌势必需要消耗大量的人力物力。
2.2 菌株的鉴定结果
分离筛选得到的5株溶藻菌的16S rRNA测序结果见表2。由表2可见,80%的溶藻菌为假单胞菌,其分离来源既可以来自底泥,也可以来自农田土壤;20%的溶藻菌为黄杆菌,其分离来源仅为农田土壤。此外,由于本研究分离得到的5株溶藻菌中仅1株菌(ALPLH4)来源于发生蓝藻水华的水体中,其余4株则来源于农田或非蓝藻水华水体,说明溶藻菌的分布与水华并无直接关联,这可能与多数微囊藻溶藻菌的溶藻方式为分泌胞外溶藻物质溶藻[14-16](而非寄生溶藻)有关。
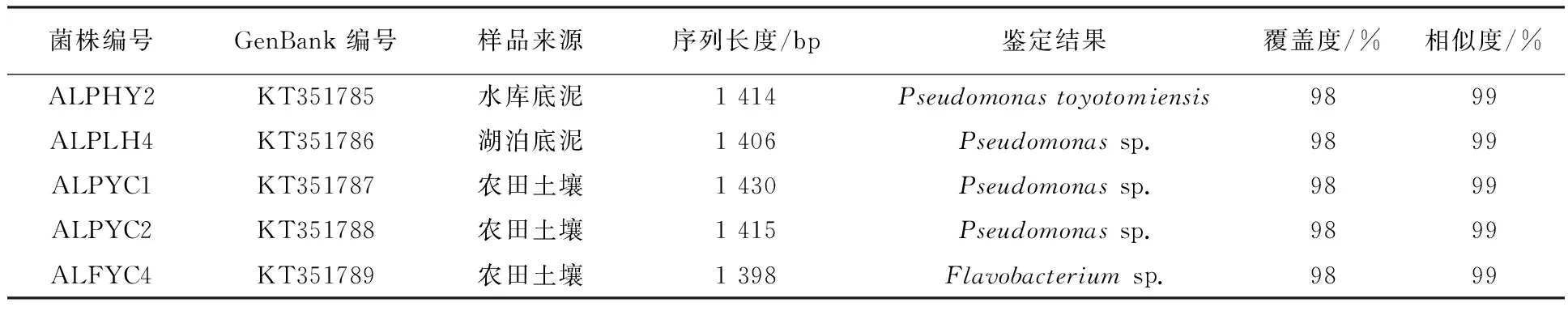
表2 5株菌16S rRNA序列的Blastn比对结果
2.3 溶藻能力测试
由图1可见,通过比较第0天和第5天的数据,发现对照组和阴性对照组的藻细胞数明显增加,说明高氏1号培养基本身对铜绿微囊藻的影响不大,单因素方差分析也表明第5天的对照组与阴性对照组之间无显著性差异(P>0.05);而加入溶藻菌培养液后,各试验组的藻细胞数的含量则明显降低,第5天的溶藻效率的波动范围为62%~95%,单因素方差分析也表明,第5天时各实验组的藻细胞密度均显著低于第5天的阴性对照组(P<0.05)。而对比各实验组第5天的藻细胞密度与第0天的阴性对照组,发现除ALPYC2组外均显著下降(P<0.05),说明ALPYC2只具备抑制微囊藻生长的能力,而其余4株菌则具有溶藻能力,其平均溶藻效率高达89.7%。

图1 5株菌的溶藻能力Fig.1 Algicidal ability of the 5 strains
3 讨 论
溶藻微生物一般从富营养化的海洋、湖泊、池塘或土壤等样品中分离[2,21-27]。本研究从4种不同来源的36个样品中分离到7 600株细菌,从中筛选得到5株溶藻菌(其中4株菌为假单胞菌),其中3株来自农田土壤,其余2株则分别来自湖泊底泥和水库底泥,这些菌的溶藻效率的波动范围为62%~95%。焦一滢等[28]从湖泊附近土壤中分离得到1株具有溶藻能力的真菌,溶藻效率为82%,张文艺等从太湖支浜底泥中筛选1株芽胞杆菌对铜绿微囊藻的去除率达到97.18%[29],这些溶藻菌的分离来源及溶藻效果与本研究结果类似,由此可见从湖泊底泥、水库底泥和农田土壤中更易分离得到具有较强溶藻能力的微生物。此外,考虑到溶藻菌的分离概率低于千分之一,有必要研发高通量的溶藻菌筛选方法以提高筛选效率。
相关研究表明,常见的溶解铜绿微囊藻的微生物多数来源于富营养化的水体[30-38],其次是土壤[15,28,39],从水培植物的种植系统[7]、富营养化湖泊底泥[40]、盐田水域[11]也能筛选得到溶藻微生物,其中,具有溶藻能力的假单胞菌报道较多,说明其较容易分离得到,这与本研究的结果相吻合。
综上所述,本研究采用高氏1号作为分离培养基,从湖泊底泥、水库底泥和农田土壤中均分离得到能够有效溶解铜绿微囊藻的假单胞菌,但采用传统方法筛选溶藻微生物的成功率极低,需要开发高通量的溶藻微生物筛选技术。
[1] 吴刚, 席宇, 赵以军. 溶藻细菌研究的最新进展[J]. 环境科学研究, 2002, 15(5):43-46.
[2] Imamura N, Motoike I. An efficient screening approach for anti-Microcystis compounds based on knowledge of aquatic microbial ecosystem[J]. JournaI of Antibiotics, 2001, 54(7):527-582.
[3] Shilo M. Lysis of blue-green algae by myxobacter[J]. Journal of bacteriology, 1970, 104(1):453-461.
[4] Caiola M G, Pellegrini S. Lysis ofMicrocystisaeruginosabyBdellovibrio-like bacteria[J]. Journal of Phycology, 1984, 20(1):471-475.
[5] Sun O, Lee J, Kato N, et al. Involvement of an extracellular protease in algicidal activity of the marine bacteriumPseudoalteromonassp. strain A28[J]. Applied and Environmental Microbiology, 2000, 66(10):4334-4339.
[6] 张勇, 席宇, 吴刚. 溶藻细菌杀藻物质的研究进展[J]. 微生物学通报, 2004, 31(1):127-131.
[7] Gustafsson S, Hultberg M, Figueroa R, et al. On the control of hab species using low biosurfactant concentrations[J]. Harmful Algae, 2009, 8(6):857-863.
[8] Park H, Sasaki Y, Maruyama T, et al. Degradation of the cyanobacterial hepatotoxin Microcystin by a new bacterium isolated from a hypertrophic lake[J].Environmental Toxicology, 2001, 16(4):337-343.
[9] Valeria AM, Ricardo EJ, P Stephan, et al. Degradation of microcystin-rr bySphingomonassp. Cba4 isolated from San Roque Reservoir(córdoba-Argentina)[J].Biodegradation, 2006, 17(5):55-447.
[10]Shi R, Huang H, Qi Z, et al. Algicidal activity against skeletonema costatum by marine bacteria isolated from a high frequency harmful algal blooms area in Southern Chinese Coast[J]. World Journal of Microbiology and Biotechnology, 2013, 29(1):153-162.
[11]Chen W, Sheu F, Sheu S. Novel l-amino acid oxidase with algicidal activity against toxic cyanobacteriumMicrocystisaeruginosasynthesized by a bacteriumAquimarinasp. [J]. Enzyme and Microbial Technology, 2011, 49(4):372-379.
[12]Wang B, Yang X, Lu J, et al. A marine bacterium producing protein with algicidal activity againstalexandriumtamarense[J]. Harmful Algae, 2012, 13(1):83-88.
[13]王家玲. 环境微生物学[M]. 北京:高等教育出版社, 1988:55-56.
[14]Yamamoto Y, Kouchiwa T. Distribution and identification of actinomycetes lysing cyanobacteria in a eutrophic lake[J]. Journal of Applied Phycology, 1998, 10(4):391-397.
[15]Jia Y, Wang Q, Chen Z, et al. Inhibition of phytoplankton species by co-culture with a fungus[J]. Ecological Engineering, 2010, 36(10):1389-1391.
[16]梁锏文, 林炜铁. 溶藻放线菌的分离鉴定及其溶藻特性[J]. 环境科学与技术, 2009, 32(9):74-78.
[17]Shirai M, Matumaru K, Ohotake A, et al. Development of a solid medium for growth and isolation of axenicMicrocystisstrains (cyanobacteria)[J]. Applied and Environmental Microbiology, 1989, 55(10):2569-2571.
[18]Thiel T, Bramble J, Rogers S. Optimum conditions for growth of cyanobacteria on solid media[J]. FEMS Microbiology Letters, 1989, 61(1):27-31.
[19]肖慈琼, 姜红, 程凯, 等. 溶藻放线菌AN02的筛选及其培养条件的优化[J]. 微生物学杂志, 2007, 27(4):11-14.
[20]中国科学院微生物研究所细菌分类组. 一般细菌常用鉴定方法[M]. 北京:科学出版社, 1978.
[21]Keawtawee T. Isolation and characterization of noctiluca-killing bacteria from a shrimp aquaculture pond in Thailand[J]. Fisheries Science, 2011, 77(4):657-664.
[22]Kato J, Amie J, Murata Y. Development of a genetic transformation system for an alga-lysing bacterium[J]. Apply Environment Microbiology, 1998, 64(6):2061-2064.
[23]Yamamoto Y, Suzuki KD. Ultrastructural studies on lysis of blue-green algae by a bacterium[J]. Journal of General and Applied Microbiology, 1977, 23(3):285-295.
[24]刘晶, 潘伟斌, 秦玉洁, 等. 两株溶藻细菌的分离鉴定及其溶藻特性[J]. 环境科学与技术, 2007,(2):17-19.
[25]汪辉, 刘兆普, 魏微, 等. 一株溶藻菌的分离、鉴定及其溶藻物质的研究[J]. 中国环境科学, 2008,(5):461-465.
[26]彭超, 吴刚, 席宇, 等. 3株溶藻细菌的分离鉴定及其溶藻效应[J]. 环境科学研究, 2003,(1):37-40.
[27]Lovejoy C, Bowman J P, Hallegraeff G M. Algicidal effects of a novel marine Pseudoalteromonas isolate (classProteobacteria, gamma subdivision) on harmful algal bloom species of the generaChattonella,Gymnodinium, andHeterosigma[J]. Apply Environment Microbiology, 1998, 64(8):2806-2813.
[28]焦一滢, 赵以军, 许敏, 等. 一株溶铜绿微囊藻真菌的分离与鉴定[J]. 环境科学与技术, 2010, 33(9):51-54.
[29]张文艺, 李仁霞, 陈雪珍, 等. 太湖支浜底泥中筛选溶藻细菌及去除铜绿微囊藻的方法[P].中国专利:2014-01-08.
[30]Ren H, Zhang P, Liu C, et al. The potential use of bacterium strain R219 for controlling of the bloom-forming cyanobacteria in freshwater lake[J]. World Journal of Microbiology and Biotechnology, 2010, 26(3):465-472.
[31]Zhang H, Yu Z, Huang Q, et al. Isolation, identification and characterization of phytoplankton-lytic bacterium Ch-22 againstMicrocystisaeruginosa[J]. Limnologica-Ecology and Management of Inland Waters, 2011, 41(1):70-77.
[32]陈庆丽, 景澄茗, 付韵馨, 等. 寒区水体中溶藻铜绿假单胞菌的分离和性质研究[J]. 环境科学学报, 2015, 35(3):692-698.
[33]赵传鹏, 浦跃朴, 尹立红, 等. 溶微囊藻菌的分离与溶藻作用[J]. 东南大学学报(自然科学版), 2005, 35(4):602-606.
[34]Shi S, Liu Y, Shen Y, et al. Lysis ofAphanizomenonflos-aquae(cyanobacterium) by a bacteriumBacilluscereus[J]. Biological Control, 2006, 39(3):345-351.
[35]Lee Y, Ahn C Y, Kim H S, et al. Cyanobactericidal effect ofRhodococcussp. isolated from eutrophic lake onMicrocystissp. [J]. Biotechnology Letters, 2010, 32(11):1673-1678.
[36]Lee Y, Ahn C Y, Kim H S, et al. The algicidal characteristics of one algae-lysing FDT5 bacterium onMicrocystisaeruginosa[J]. Geomicrobiology Journal, 2009, 26(7):516-521.
[37]Kim B H, Sang M, Hwang S J, et al. In situ bacterial mitigation of the toxic cyanobacteriumMicrocystisaeruginosa:implications for biological bloom control[J]. Limnol. Oceanogr. Methods, 2008, 6:513-522.
[38]Kong Y, Xu X, Zhu L. Cyanobactericidal effect ofStreptomycessp. HJC-D1 onMicrocystisauruginosa[J]. PLoS ONE, 2013, 8(2):1-8.
[39]Hua X, Li J, Li J, et al. Selective inhibition of the cyanobacterium,Microcystis, by aStreptomycessp. [J]. Biotechnology Letters, 2009, 31(10):1531-1535.
[40]Choi H, Kim B, Kim J, et al. Streptomyces neyagawaensis as a control for the hazardous biomass ofMicrocystisaeruginosa(cyanobacteria) in eutrophic freshwaters[J]. Biological Control, 2005, 33(3):335-343.
Isolation and Identification of Algae-Lysing Microbes from Different Resources and Comparison of Their Algicidal Efficiency
ZHANG Deng-lan, ZHAO Yi-jun, WU Gang, CHENG Kai
(KeyLab.ofEco-Remediat′nofLakes&Rivers&AlgalUtilizat′nofHubeiProvince,Coll.ofRes. &Environm′tEngin.,HubeiUni.ofTechnol.,Wuhan430068)
In order to probe deeply into which type of natural habitat is easier to isolate algae-lysing microorganisms, 36 samples were collected from reservoir sediments, lake sediments, farmland soil or woodland soil, and 7 600 microorganism strains were separated from this samples adopting Gause 1 medium. 5 algae-lysing strains againstMicrocystisaeruginosawere finally screened, among them 4 strains arePseudomonassp. and 1 strain isFlavobacteriumsp..The algae-lysing efficiency of the 5 strains ranged from 62% to 95%. The results showed that when using Gause 1 medium to isolate algae-lysing microorganisms, lake and/or reservoir sediments, and followed by farmland soil, were the best isolation sources, while woodland soil is not easy to screen. The results also indicated thatPseudomonassp. is the easiest algae-lysing microorganism to screen from.
Algae-lysing microorganism;Microcystisaeruginosa;Pseudomonas;Flavobacterium
湖北省科技支撑计划项目(2014BCB037);武汉市科技攻关项目(2014060101010061)
章登岚 女,硕士研究生。主要研究方向为溶藻微生物。Tel: 027-59750635,E-mail:zdl_2966@qq.com
* 通讯作者。男,教授,博士,硕士生导师。主要研究方向为环境微生物学。Tel: 027-59750635,E-mail:chengkaicn@163.com
2016-06-02;
2016-07-28
Q93-331; X172
A
1005-7021(2017)03-0100-05
10.3969/j.issn.1005-7021.2017.03.016

