2型糖尿病患者血尿酸水平与肾损害及血浆致动脉硬化指数的相关性
马 瑞,高 雷,寇惠娟*,高登峰,张 岩,李万静
(1西安交通大学第二附属医院心内科,西安 710004;2西安交通大学第二附属医院内分泌科;*通讯作者,E-mail:khjsarah@163.com)
2型糖尿病患者血尿酸水平与肾损害及血浆致动脉硬化指数的相关性
马 瑞1,高 雷2,寇惠娟1*,高登峰1,张 岩1,李万静1
(1西安交通大学第二附属医院心内科,西安 710004;2西安交通大学第二附属医院内分泌科;*通讯作者,E-mail:khjsarah@163.com)
目的 研究2型糖尿病患者高尿酸血症与肾损害及血浆致动脉硬化指数的相关性。 方法 纳入217例2型糖尿病患者,根据血尿酸水平分为高尿酸组(男性尿酸浓度≥420 μmol/L或女性≥360 μmol/L)和正常尿酸组(男性尿酸浓度<420 μmol/L或女性<360 μmol/L)。测定两组患者的空腹血糖、糖化血红蛋白、血脂、血尿素氮、血肌酐、尿微量白蛋白及胱抑素C浓度。计算血浆动脉硬化指数及肾小球滤过率。应用SPSS13.0统计软件进行分析。 结果 2型糖尿病伴高尿酸血症患者的血肌酐、微量蛋白尿及胱抑素C水平明显高于血尿酸正常的2型糖尿病患者,而肾小球滤过率明显低于尿酸正常患者,组间差异具有统计学意义(P<0.05)。高尿酸血症组甘油三酯水平及血浆致动脉硬化指数高于尿酸正常组,差异具有统计学意义(P<0.05)。2型糖尿病患者血尿酸水平随血浆致动脉硬化指数四分位数的增加而逐渐升高,组间比较差异具有统计学意义(F=8.57,P=0.000);2型糖尿病患者空腹血糖水平随血浆致动脉硬化指数四分位数增加而逐渐升高,但差异无统计学意义(F=1.93,P=0.125)。2型糖尿病患者血浆致动脉硬化指数与血尿酸水平及空腹血糖水平呈正相关(P<0.001)。 结论 2型糖尿病合并高尿酸血症会造成不同程度的肾脏损害;血浆致动脉硬化指数有助于识别此类患者罹患动脉硬化的风险。
2型糖尿病; 血尿酸; 肾损害; 血浆致动脉硬化指数
尿酸(uric acid,UA)是人体嘌呤代谢的终产物,体内嘌呤经过肝脏分解代谢,主要通过肾脏随尿液排出体外。高尿酸血症继“高血压、高血糖、高血脂”后成为严重危害健康的第四高。近年来许多的临床研究认为血尿酸水平与原发性高血压、肾损害、代谢综合征等相关,是冠心病、脑卒中的独立危险因素[1-4],亦有越来越多的研究发现其在糖尿病肾病的发生发展中起重要作用[5]。一些研究表明尿酸可增加糖尿病肾病患者的蛋白尿、也使eGFR下降的风险增加[6,7]。动脉粥样硬化是各种心脑血管疾病的病理基础。血浆致动脉硬化指数(atherogenic index of plasma,AIP)是近几年提出的预测脂质代谢紊乱的敏感指标,也是预测动脉粥样硬化的良好血浆标记物[8]。本研究旨在探讨伴或不伴高尿酸血症的2型糖尿病患者肾脏功能损害情况,并分析血尿酸浓度与糖尿病患者AIP的相关性,观察伴有高尿酸血症的2型糖尿病患者动脉粥样硬化发生的可能风险。
1 资料与方法
1.1 一般资料
选择2017-01~2017-03在西安交通大学第二附属医院内分泌科住院的2型糖尿病患者217例,其中男性158人,女性59人,年龄(51.66±11.81)岁。所有入组的2型糖尿病患者均未服用血管紧张素转化酶抑制剂(ACEI)或者血管紧张素受体拮抗剂(ARB)或者利尿剂类药物。糖尿病诊断标准符合2010年美国糖尿病协会(ADA)诊断标准[9],排除严重肝功能不全、严重感染、恶性肿瘤、非糖尿病所致肾功能不全等。
1.2 研究方法
1.2.1 一般资料收集 采集受试者的年龄、性别、身高、体质量、糖尿病病程、入院血压等资料。计算体质量指数(body mass index,BMI)。BMI(kg/m2)=体质量/身高2。
标本的采集与测定:采集受试者入院晨起空腹静脉血5 ml和清洁中段尿10 ml,全自动生化仪检测患者空腹血糖(fasting blood-glucose)、糖化血红蛋白(glycosylated hemoglobin)、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、胱抑素C(cystatin C,CysC)、血尿酸(uric acid,UA)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high lipoprotein cholesterol, HDL-C)及低密度脂蛋白胆固醇(low lipoprotein cholesterol,LDL-C)水平;免疫散射比浊法测定患者的尿微量白蛋白(microalbuminuria,MA)水平。以上检测均由西安交通大学第二附属医院检验专业人员完成。
1.2.2 研究对象 分组根据性别及空腹血尿酸水平分为高尿酸组(high uric acid)或者尿酸正常组(normal uric acid);空腹血尿酸浓度≥420 μmol/L(男性)或≥360 μmol/L(女性)作为高尿酸血症的诊断标准。
1.2.3 计算肾小球滤过率 根据Cockroff-Gault公式计算肾小球滤过率(estimated glomerular filtration rate,eGFR)。eGFR=(140-年龄)×体质量(kg)×0.85(女性)[×1(男性)]/[0.818×血肌酐(mg/dl)]。
1.2.4 计算血浆致动脉硬化指数 血浆致动脉硬化指数(atherogenic index of plasma,AIP)是反映LDL-C颗粒直径的一个间接指标。其计算公式为AIP=lg(TG/HDL-C)。
1.3 统计学分析

2 结果
2.1 两组一般临床资料比较
2型糖尿病伴HUA组患者55例,2型糖尿病伴NUA组患者162例。2型糖尿病伴HUA组及2型糖尿病NUA组的性别比例及合并高血压比例比较,差异无统计学意义(见表1);两组年龄、病程、BMI、空腹血糖、糖化血红蛋白、入院时收缩压及舒张压水平比较,差异无统计学意义(P>0.05);两组尿酸水平比较差异有统计学意义(P<0.05,见表1)。
表1两组一般临床资料比较
Table1Comparisonofgeneralclinicaldatabetweenthetwogroups

项目HUA组(n=55)NUA组(n=162)χ2/t/ZP男性36 122 2014016合并高血压23 53 1495022年龄(岁) 573±1356 5644±11190468065病程(年) 857(2,13) 85(3,12)-1846094BMI(kg/m2)2457(232,284)2456(2321,2440)-1240021空腹血糖(mmol/L) 907(647,999) 974(690,1151)-1147025糖化血红蛋白(%) 778(63,95) 81(68,92)-1125026血尿酸(μmol/L)45485±448029804±6304170250000收缩压(mmHg)13635±191613513±16370455065舒张压(mmHg) 8247±1234 8207±12830204084
2.2 两组肾脏损害标志物比较
HUA组2型糖尿病患者的Scr、Cys-C、eGFR及MA水平均高于NUA组(P<0.05,见表2),但两组BUN水平比较差异无统计学意义(P>0.05)。
2.3 两组血脂浓度及血浆致动脉硬化指数比较
2型糖尿病患者HUA及NUA两组血脂水平比较,结果显示HUA组TG、API水平均高于NUA组(P<0.05,见表3),但TC、HDL、LDL组间比较无统计学差异(P>0.05)。
表2两组肾脏损害标记物比较[M(P25,P75)]
Table2Comparisonofrenaldamagemarkerlevelsbetweenthetwogroups[M(P25,P75)]

组别nBUN(mmol/L)Scr(μmol/L)eGFR(ml/min)Cyc⁃c(mg/L)MA(mg/L)HUA组55559(395,653)7994(5767,9167)9669(7197,11834)113(081,122) 39000(108,15200)NUA组162516(412,59)6283(5336,7164)12176(10267,13778)089(072,097) 16560(108,7290)Z-0723-3790-4706-4789-1895P0470000000000000042
表3两组血脂水平及AIP比较[M(P25,P75)]
Table3Comparisonoflipidlevelandatherogenicindexofplasmabetweenthetwogroups[M(P25,P75)]

项目TC(mmol/L)TG(mmol/L)HDL⁃C(mmol/L)LDL⁃C(mmol/L)AIPHUA组519(433,575)272(161,308)117(082,114)333(276,376) 035(016,049)NUA组467(390,541)209(087,117)104(087,117)314(241,386) 021(-006,043)Z-1705-3491-1044-0640-3031P00900000300520002
2.4 按AIP分层分析结果
按AIP四分位数将人群分为4组,分别为Q1组(AIP<0.029 1),Q2组(AIP在0.029 1-0.223 4之间),Q3组(AIP在0.223 4-0.442 6之间),Q4组(AIP>0.442 6)。2型糖尿病患者血尿酸水平及血糖水平随AIP分层的变化见表4。对分层后的数据进行方差分析发现:①各组UA浓度随着AIP四分位数的增加而逐渐升高,各组之间差异存在统计学意义(df=3,F=8.57,P=0.000);②各组空腹血糖水平随着AIP四分位数的增加而逐渐升高,然而各组之间差异无统计学意义(df=3,F=1.93,P=0.125)。
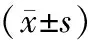


分组AIP分组nUA(μmol/L)空腹血糖(mmol/L)Q1组<002915329357±7516807±273Q2组00291-022345533018±8747912±309Q3组02234-044265435855±91851029±148Q4组>044265536889±88601075±334
2.5 相关性分析
对AIP与空腹血糖、糖化血红蛋白、血尿酸、BUN、eGFR、Cycs、MA之间的相关性进行Spearman相关性分析,结果显示AIP与空腹血糖(r=0.284,P=0.000)、血尿酸(r=0.269,P=0.000)呈正相关。
3 讨论
尿酸是人体嘌呤代谢的终产物,主要经肾脏排泄,其生成与排泄呈动态平衡,一旦该平衡被打破,势必造成尿酸在体内的蓄积。然而尿酸在血浆中的溶解度有限,达到6.8 mg/dl后即饱和形成尿酸盐结晶,可在关节和肾脏沉积,诱发痛风性关节炎及尿酸肾结石。
近年来越来越多的临床研究发现尿酸与糖尿病、心血管疾病(动脉粥样硬化、左心室肥厚、高血压)及肾功能不全等疾病密切相关。其机制可能与活化RAAS系统,诱导血管内皮功能受损,引起氧化应激反应及炎症反应有关[10,11]。有一项纳入20 000余名研究对象的流行病学队列研究报道,轻度尿酸浓度增高(7.0-8.9 mg/dl)即可使慢性肾脏病发生的风险提高2倍,而高尿酸组(大于9.0 mg/dl)可使人群患慢性肾脏病的风险提高3倍[12]。
本研究首先比较HUA及NUA两组2型糖尿病患者年龄、病程、合并高血压情况、空腹血糖、糖化血红蛋白、体质量指数及入院时血压,发现组间比较无统计学差异。接着通过比较HUA和NUA两组2型糖尿病患者的肾脏损害标记物,证实2型糖尿病合并高尿酸血症患者的Scr、Cys-C及MA水平显著高于血尿酸正常组,而eGFR显著低于血尿酸正常组,提示2型糖尿病伴高尿酸患者会不同程度地加重肾功能受损。其原因首先与尿酸水平升高形成尿酸盐结晶沉积在肾脏对肾功能形成直接损害有关,其次高尿酸血症会造成血管内皮功能障碍、血管平滑肌细胞增生、IL-1、IL-6、TNF-α合成增多、损伤内皮细胞、刺激炎症及免疫应答等介导肾损伤,促进肾功能不全的发生和进展[13]。同时有研究表明尿酸还可激活toll样受体途径刺激内皮细胞释放警戒素介导内皮功能障碍。其亦可以通过促进MAPK和COX-2 mRNA的表达,从而刺激血管平滑肌细胞增殖,激活RASS引起肾入球小动脉增厚、肾血管收缩,导致系统性及肾小球性肾损害,进而引发糖尿病肾病及肾功能不全。
近年来,一些研究发现高尿酸血症患者中常伴有高的甘油三酯(TG)和较低的高密度脂蛋白(HDL-C)。Rathmann等[14]在对4 053例年龄在18-30岁的成人冠状动脉危险因素研究中发现,TG与UA呈正相关。AIP是Dobiasova等[8]于2004年提出的预测脂质代谢紊乱的敏感指标,能够间接反映LDL-C直径的大小,有研究指出随着AIP的增加小而密的低密度脂蛋白(sLDL-C)的比例会逐渐增高,而sLDL-C是LDL-C中具有更强的致动脉硬化的作用的亚型,提示AIP是良好的预测动脉硬化的血浆标记物。有研究提示AIP能准确方便地预测2型糖尿病患者大血管病变发生的危险性[15]。本研究发现HUA和NUA两组血脂及AIP比较,HUA组TC、TG、HDL-C、LDL-C及AIP水平均高于NUA组,且两组间TG及AIP水平比较,差异具有统计学意义(P<0.05)。以AIP四分位数将研究对象分为四组,亦发现各组血尿酸水平随着AIP的增加而逐渐升高,组间比较差异具有统计学意义。多因素相关性分析也证实2型糖尿病患者中尿酸水平、空腹血糖水平与AIP呈显著性正相关,提示2型糖尿病患者的血尿酸水平及血糖水平与AIP密切相关,合并高尿酸血症的2型糖尿病患者动脉硬化及代谢紊乱的发生风险有增加的趋势。因此,动态观察有助于早期识别合并高尿酸血症的2型糖尿病患者罹患动脉粥样硬化的风险。
总之,在2型糖尿病患者中,HUA组与NUA组相比,肾脏损害标记物明显升高,提示血尿酸浓度升高会造成不同程度的肾脏功能损害;2型糖尿病患者的血尿酸水平及空腹血糖水平与AIP密切相关,随着AIP增加血尿酸浓度及空腹血糖水平逐渐升高,提示动态观察2型糖尿病患者AIP有助于早期识别其罹患动脉粥样硬化的风险。本研究也存在一些不足,本研究未纳入正常健康人群作为对照组,而且本研究系小样本量临床病例对照回顾性研究,对2型糖尿病合并高尿酸血症患者的肾脏损害情况及AIP进行了相关性研究,但并未对其发生机制进行深入探讨,这些不足之处将会在后期的研究工作中进一步改进和完善。
[1] 赵娟,张卓莉.高尿酸血症与肾损害[J].中国医学前沿杂志:电子版,2014,6(10):8-10.
[2] 屈桂茹.高尿酸血症在2型糖尿病早期肾脏损害中的作用[J].临床医学工程,2014,21(12):1567-1568.
[3] Kanbay A, Inonu, H,Solak Y,etal. Uric acid as a potential mediator of cardiovascular morbidity in obstructive sleep apnea syndrome[J]. Eur J Intern Med, 2014,25(5): 471-476.
[4] Turak O, Afsar B, Ozcan F,etal. Relationship between elevated morning blood pressure surge, uric acid, and cardiovascular outcomes in hypertensive patients[J]. J Clin Hypertens, 2014, 16(7): 530-535.
[5] Ficociello LH, Rosolowsky ET,Niewczas MA,etal. High-normal serum uric acid increase s risk of early progressive renal function loss in type 1 diabetes results of a 6 year follow up[J]. Diabetes Care, 2010, 33(6): 1337-1343.
[6] Jalal DI, RivardCJ,Johnson RJ,etal. Serum uric acid levels predict the development of albuminuria over 6 years in patients with type 1 diabetes: findings from the Coronary Artery Calcification in type 1 diabetes study [J]. Nephrol Dialysis Transplant, 2010, 25(6): 1865-1869.
[7] Zoppini G, Targher G, Chonchol M,etal. Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function[J].Diabetes Care, 2012, 35(1): 99-104.
[8] Dobiasova M. Atherogenic index of plasma [log(triglycerides/HDL-cholesterol)]: theoretical and practical implications[J]. Clin Chem,2004, 50(7): 1113-1115.
[9] Association AD. Standards of medical care in diabetes-2010[J]. Diabetes Care, 2010, 33(suppl1): S11-S61.
[10] Corry DB, EslamiP, Yamamoto K,etal. Uric acid stimulates vascular smooth mescle cell proliferation and oxidative tress via the vascular renin-angiotensin system[J]. J Hypertens, 2008, 26(2): 269-275.
[11] Filiopoulos V, Hadjiyannakos D,Vlassopoulos D. New insights into uric acid effects on the progression and prognosis of chronic kidney disease[J].Ren Fail, 2012, 34(4): 510-520.
[12] Obermayr RP, Temml C, Gutjahr G,etal. Elevated uric acid increase the risk for kidney disease[J]. J Am Soc Nephrol, 2008,19(12): 2407-2413.
[13] 邹筱芳,巫冠中.尿酸肾损伤的分子机制研究进展[J].安徽医药,2015,19(1):5-9.
[14] Rathmann W, Funkhouser E, Dyer AR,etal. Relations of hyperuricemia with the various components of the insulin resistance syndrome in young black and white adults: the CARDIA study[J]. Ann Epidemiol, 1998, 8(4): 250-261.
[15] 黄绍鹏,周全,陈小燕.血浆致动脉硬化指数与2型糖尿病患者大血管病变的相关性分析[J].中国现代药物应用,2015,9(14):13-15.
Relationshipofblooduricacidwithrenaldamageandatherogenicindexofplasmainpatientswithtype2diabetesmellitus
MA Rui1,GAO Lei2,KOU Huijuan1*,GAO Dengfeng1,ZHANG Yan1,LI Wanjing1
(1DepartmentofCardiology,SecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China;2DepartmentofEndocrine,SecondAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:khjsarah@163.com)
ObjectiveTo explore the relationship of hyperuricemia(HUA) with renal damage and atherogenic index of plasma(AIP) in patients with type 2 diabetes mellitus.MethodsTotally 217 patients with type 2 diabetes mellitus were divided into two groups according to the concentration of blood uric acid: high uric acid group(male≥420 μmol/L or female≥360 μmol/L) and normal uric acid group(NUA)(male<420 μmol/L or female <360 μmol/L). The concentrations of fasting plasma glucose, glycosylated hemoglobin, blood lipid, blood urea nitrogen(BUN), serum creatinine(Scr), microalbuminuria(MAU) and cystatin C(Cys-C) were recorded. All the results were dynamically monitored by automatic biochemical analyzer. Atherogenic index of plasma was calculated by the formula (AIP=lgTG/HDL-C). Estimated glomerular filtration rate(eGFR) was calculated by the Cockroff-Gault formula. All the data were analyzed by SPSS software.Results①The concentrations of Scr, MAU and Cys-C were higher in HUA group than in NUA group(P<0.05),and the level of eGFR was significantly lower in HUA group than in NUA group(P<0.05).②The concentration of triglyceride(TG) and the level of AIP was significantly higher in HUA group than in NUA group(P<0.05).③The concentration of blood uric acid elevated with the increase of the quartile of AIP(F=8.57,P=0.000), and the concentration of fasting plasma glucose increased with the increase of the quartile of AIP (F=1.93,P=0.125).④The AIP was correlated with the plasma uric acid and fasting plasma glucose (P<0.001).ConclusionType 2 diabetes mellitus patients with HUA have more serious renal damage. Dynamic observation on AIP might be helpful to identify the risk of developing atherosclerosis in type 2 diabetes mellitus patients with HUA.
type 2 diabetes mellitus; uric acid; renal damage; atherogenic index of plasma
R587
A
1007-6611(2017)09-0891-04
10.13753/j.issn.1007-6611.2017.09.005
中央高校基本科研业务费资助项目(0817-1191320079);西安交通大学第二附属医院第四批教改基金资助项目(18)
马瑞,女,1984-01生,硕士,主治医师,E-mail:mr0103@163.com
2017-05-31

