绵茵陈药材中绿原酸提取工艺优化*
伍 彬,江尚飞,邱妍川,杨宗发
(重庆医药高等专科学校,重庆 401331)
绵茵陈为菊科多年生草本植物滨蒿 Artemisia scoparia Waldst.et Kit.或茵陈蒿 Artemisia capillaris Thunb.的干燥地上部分,春季幼苗高6~10 cm时采收,或秋季花蕾长成至花初开时采割,除去杂质和老茎,晒干。春季采收的习称为“绵茵陈”,秋季采收的称为“花茵陈”,习称“茵陈蒿”。其药用历史悠久,味苦、辛,性微寒,归脾、胃、肝、胆经,主治湿热黄疸、胆囊炎、小便不利、风痒疮疥、湿疮瘙痒、湿温初起。目前,从金银花和杜仲中提取绿原酸的工艺研究较广泛,技术较成熟,但随着金银花和杜仲市场价格的攀升,生产成本日趋上升,因此,绿原酸的提取需要新思路[1-5]。本研究中通过正交试验考察了乙醇体积分数、提取温度、提取时间、固液比、提取次数等因素对绵茵陈绿原酸提取率的影响[6-8],并优选出绵茵陈中绿原酸的最佳提取工艺。现报道如下。
1 仪器与试药
1.1 仪器
SB-120DT型超声波清洗机(宁波新芝生物科技股份有限公司);JCE-3K型高精度计数桌秤(台湾钰恒股份有限公司);PC4010型高效液相色谱仪(美国兰博公司),包括二元高压泵、Mode 201紫外检测器、Kromasil C18色谱柱;AUX220型双量程分析天平(日本岛津公司);SE-80型超声波清洗机(宁波新芝生物科技股份有限公司);ZN-100型高速中药粉碎机(长沙市岳麓区中南制药机械厂)。
1.2 试药
绵茵陈药材(500 g,原产地重庆,重庆慧远药业有限公司,批号150401);绿原酸对照品(中国食品药品检定研究院,批号151558-201207);无水乙醇及其他试剂均为分析纯。
2 方法与结果
2.1 绿原酸含量测定
2.1.1 色谱条件与系统适用性试验
色谱柱:YMC-Pack Pro C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈 - 水(10 ∶90);检测波长:345 nm;流速:1.0 mL /min;柱温:30 ℃ ;进样量:10 μL。理论板数按绿原酸峰计均不低于5 000,绿原酸与相邻峰分离度均大于1.5。色谱图见图1。
2.1.2 溶液制备
对照品溶液:称取绿原酸对照品21.50 mg,精密称定,置100 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,作为对照品贮备液,精密量取5 mL,置25 mL容量瓶中,加甲醇至刻度,摇匀,即得(含绿原酸 43 μg /mL)。

图1 绵茵陈高效液相色谱图
供试品溶液:取绵茵陈药材,40℃恒温干燥1.5 h后,粉碎,过40目筛,精确称取5 g,用溶剂浸提,过滤,提取液用旋转蒸发仪蒸发浓缩,定容至100 mL容量瓶中。精密吸取10 mL,挥干溶剂,残渣用甲醇分次溶解,转移至25 mL容量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.1.3 方法学考察
精密度试验:精密吸取同一对照品溶液10 μL,注入液相色谱仪,连续进样6次,测定绿原酸峰面积。结果的RSD为0.30%(n=6),表明仪器精密度良好。
线性关系考察:分别精密量取绿原酸对照品贮备液0.5,1.0,2.0,5.0,10.0,15.0,20.0 mL,分别置 50 mL容量瓶中,用甲醇稀释至刻度。分别取10 μL注入液相色谱仪,记录色谱图,测定其峰面积,并以峰面积值(Y)对进样质量浓度(X)进行线性回归,得回归方程Y=13.955 X+7.944 8,r=0.999 3(n=7)。结果表明,绿原酸质量浓度在 2.15 ~86.00 μg/mL 范围内与峰面积线性关系良好。
稳定性试验:精密吸取同一对照品溶液和供试品溶液,分别于 0,2,4,6,8,12,24 h 时连续进样 3 次,各 10 μL,测定绿原酸峰面积。结果的 RSD分别为 0.40%和0.80%(n=7),表明溶液在24 h内基本稳定。
重复性试验:按拟订含量测定方法,取同一批号药材,同时制备6份供试品溶液,精密吸取10 μL注入液相色谱仪,计算绿原酸质量分数。结果的 RSD为1.30%(n=6),表明方法重复性良好。
加样回收试验:取已知含量的供试品6份,分别精密加入一定量的绿原酸对照品,照供试品溶液制备方法制备溶液,精密吸取 10 μL,注入色谱仪中,测定峰面积,计算回收率。结果见表1。
2.2 提取工艺单因素考察
提取溶剂:准确称取3份样品,分别以纯水、40%乙醇、70%乙醇为提取溶剂,固液比(粗粉∶溶剂)为 1∶30(g/mL),浸渍24 h,用2.1.2项下方法制备供试品溶液并进样,测定绿原酸收率,考察不同溶剂与收率的关系。结果见图2。可见,乙醇提取时收率明显升高,故初步确定提取溶剂为乙醇。

表1 绿原酸加样回收试验结果(n=6)

图2 提取溶剂对绿原酸收率的影响
提取方法:准确称取3份样品,选择70%乙醇为提取溶剂,固液比(粗粉 ∶溶剂)为 1 ∶30(g/mL),提取 2 次,用2.1.2项下方法制备供试品溶液并进样,比较超声法(110 kHz,30 ℃ ,每次 30 min),渗漉法(浸泡 24 h,流速为 2 mL /min,直至无色),回流法(1.5 h /次)的提取效果,考察不同提取方法与收率的关系。结果见图3。可见,从左到右收率依次为 0.186,1.608,1.234 mg /g,超声提取收率最大,绵茵陈以超声提取为佳。

图3 提取方法对绿原酸收率的影响
乙醇体积分数:准确称取5份样品,在温度为30℃、提取时间为30 min、提取次数为2次、固液比(粗粉∶溶剂)为 1 ∶30(g/mL)的条件下,考察乙醇体积分数与收率的关系。结果见图4。随着乙醇体积分数的升高,绿原酸收率上升,当乙醇体积分数达到60%时提取率达到最大值,继续升高乙醇体积分数,提取率反而下降,故确定乙醇体积分数为60%。

图4 乙醇体积分数对绿原酸收率的影响
提取温度:准确称取5份样品,在乙醇体积分数为60%、提取时间为30 min、提取次数为2次、固液比(粗粉 ∶溶剂)为 1 ∶30(g/mL)的条件下,考察提取温度对收率的影响。结果见图5。绿原酸的收率起初随温度的升高而增加,35℃时收率达到最高,为 5.280 mg/g,以后收率逐渐下降。可能是由于温度的升高加速了绿原酸的分解,因此乙醇提取绿原酸温度以35℃为最佳。

图5 提取温度对绿原酸收率的影响
提取时间:准确称取5份样品,在乙醇体积分数为60% 、温度为 35 ℃、固液比为 1 ∶30(g/mL)、提取次数为2次的条件下,考察超声时间对收率的影响。结果见图6。随着超声时间的延长,绿原酸收率呈正增长趋势,时间越长收率越高,但趋势越来越缓,因此提取时间以30 min为宜。

图6 提取时间对绿原酸收率的影响
提取固液比:准确称取5份样品,在乙醇体积分数为60%、温度为35℃、提取时间为30 min、提取次数为2次的条件下,考察固液比对收率的影响。结果见图7。随着固液比的增加,绿原酸的收率明显增加。因为增加提取溶剂用量能增加固液接触面积,提高溶质扩散速率,从而提高提取率。当固液比提高到1∶30以后,收率增加幅度降低。综合考虑收率和乙醇回收,故固液比选用1∶30较合理。

图7 提取固液比对绿原酸收率的影响
提取次数:准确称取3份样品,在乙醇体积分数为60%、温度为 35 ℃、提取时间为 30 min、固液比为 1 ∶30(g/mL)的条件下,考察提取次数对收率的影响。结果见图8。提取次数越多,提取率越高,但单次提取效率越低,且杂质也相对增加,因此提取2次效果较好。

图8 提取次数对绿原酸收率的影响
2.3 提取工艺正交试验优选
考虑到4种因素的相互作用及提取液浓缩、杂质含量的问题,试验选择乙醇作为提取溶剂,以乙醇体积分数(因素 A)、提取时间(因素 B)、提取温度(因素 C)、固液比(因素D)进行4因素3水平的 L9(34)正交试验。结果见表2至表4。因素A和因素C对结果影响显著;因素B和因素D对提取影响不显著。结合单因素试验,综合考虑提取液浓缩等因素,确定超声辅助提取绵茵陈粗粉绿原酸的最佳工艺参数为A2B2C3D1,即乙醇体积分数60%,提取时间 30 min,提取温度 35 ℃ ,固液比 1 ∶20(g/mL),提取2次,绵茵陈绿原酸收率为109.9 mg(每20 g药材),即试验5中条件为最佳试验条件。

表2 提取工艺正交试验因素水平表

表3 提取工艺正交设计试验结果(n=9)
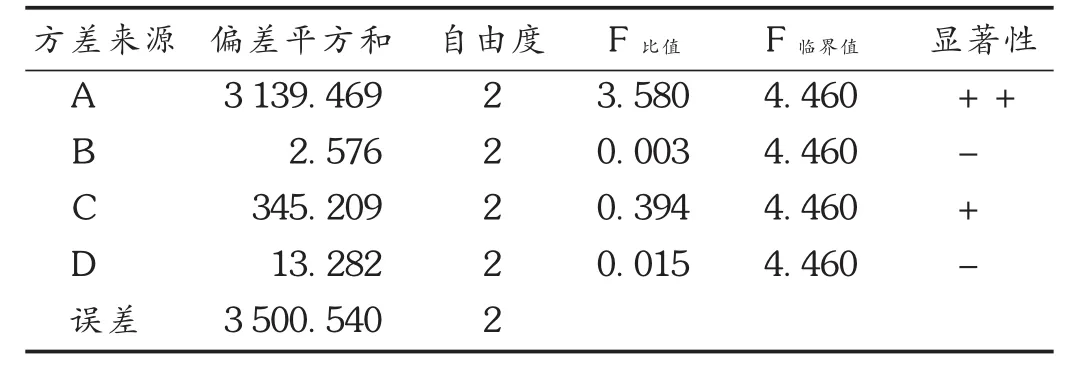
表4 方差分析结果
3 讨论
采用高效液相色谱法测定绿原酸含量已多见报道,但文献中色谱条件的流动相中加入了缓冲盐,其流动相组成为 0.2 mol/L 磷酸二氢钠缓冲液 - 甲醇(75 ∶25),调pH至3.0,由于缓冲盐对液相系统及色谱柱损伤较大,故本研究中未采用。另见文献报道,流动相组成为[甲醇 -3%醋酸水溶液(15∶85)],其中醋酸比例较高,且峰形拖尾。因此,本研究中从色谱柱的筛选着手,首先尝试使用较常用的 Zorbax SB-C18柱(250 mm×4.6 mm,5 μm,美国安捷伦公司)为色谱柱,以乙腈 - 水(10 ∶90)为流动相,检测波长为 345 nm,流速为 1.0 mL/min,柱温为30℃,进样量为10 μL,但主峰拖尾,可能原因为该款色谱柱填料并未封端,残存的硅醇基与待测物发生氢键作用造成拖尾。经过筛选,色谱柱选用了日本YMC -Pack Pro C18柱(250 mm ×4.6 mm,5 μm),该色谱柱在传统ODS柱基础上采用更高纯度硅胶基质及更先进端基封尾技术,与传统ODS柱相比,具有更好的耐久性及批次重复性,对绿原酸具有更好的分离效果,且主峰峰形良好。因此,本研究中最终采用文中的色谱条件,其组成简单,重复性好,适于分析茵陈中的绿原酸[9-13]。
本研究中选择超声法、渗漉法、回流法3种常见中药提取方法对有效成分进行提取,比较了不同溶剂、不同提取温度与提取时间、不同提取固液比等对绿原酸收率的影响。在考察单次提取时间与提取次数时发现,提取30 min与更长时间,提取2次与3次的绿原酸收率几乎相同,考虑到提取时间越长、次数越多,杂质含量越高,最终确定以较短时间、较少次数进行绿原酸的提取;在乙醇体积分数考察时发现,随着乙醇体积分数的升高,绿原酸收率也随之升高,但乙醇体积分数超过60%时,收率反而下降,可能与由于高体积分数乙醇使得一些大分子物质和绿原酸产生共沉淀现象,造成绿原酸的损失有关[14-15]。
结合正交试验结果,从便于控制、成本低、周期短三方面考虑,最终确定最佳工艺条件为乙醇体积分数60%,单次提取时间30 min,提取2次,提取温度35℃,固液比1∶20(g/mL),在此条件下绵茵陈绿原酸的收率为 109.9 mg(每 20 g 药材)。
[1]洪 敏,吴祥瑞,华永庆,等.绵茵陈与茵陈蒿保肝作用比较研究[J].中药药理与临床,2009,25(6):73 - 75.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:1701-1706.
[3]陈倩倩,李 清,毕开顺.绵茵陈、穿心莲不同配伍比例水提取物的体外抗菌活性研究[J].中国民族民间医药,2013,22(5):29 - 30.
[4]陶玉杰.绵茵陈与花茵陈的现代药理对比及临床应用[J].中国现代药物应用,2017,19(11):193 -194.
[5]刘 颖,郭明晔,白根本.绿原酸的研究进展[J].中药材,2012,35(7):1180 - 1185.
[6]江 滨,王风云,曾元儿,等.绵茵陈药材提取液中绿原酸稳定性影响因素考察[J].中草药,2007,29(3):359 - 362.
[7]宋小军,张永欣,张 颖,等.绵茵陈药材中绿原酸定性定量方法研究[J].中国中药杂志,2002,27(4):347 - 349.
[8]刘筱琴,刘碧林,曾祥燕,等.绵茵陈中绿原酸的提取方法研究进展[J].广东化工,2013,40(21):118.
[9]徐建国,田呈瑞,胡 青,等.绵茵陈中绿原酸的提取工艺研究[J].中国农学通报,2007,23(9):162 - 165.
[10]陈金玉,尹蓉莉,陈海亭,等.单因素和正交试验结合优化当乌分散片中乌药的提取工艺[J].中国实验方剂学杂志,2011,17(6):33 - 35.
[11]李万林,侯 韬.金银花中绿原酸的微波辅助提取工艺条件研究[J].中草药添加剂新研究,2013(5):35 - 38.
[12]刘 影,于治国,袁 璐,等.茵陈药材中绿原酸的含量测定[J].西北药学杂志,2006,21(5):207 - 209.
[13]刘丽清,李美艳,王爱武.绵茵陈中绿原酸的提取工艺及纯化工艺优选[J].西部中医药,2016,29(11):18 -20.
[14]王新红,李雪梅,蔡 晨,等.离子液体提取山楂绿原酸的工艺优化[J].农业工程学报,2014,30(10):270 -276.
[15]潘郁萍,刘 哲,王 楠,等.高效液相色谱法测定复方双花利咽合剂中绿原酸的含量[J].中国科技信息,2013(2):44 -45.

