卡氏肺孢子菌肺炎大鼠中的LAMP检测方法及1,3-β-D葡聚糖变化的研究*
帕提古丽·那吾尔,刘媛媛,乌兰·同巴依尔,牛晓琳,朱 辉
(新疆医科大学第一附属医院消毒配送中心次供应室一部,新疆乌鲁木齐 830054)
肺孢子菌肺炎(PCP)是获得性免疫缺陷综合征(AIDS)患者最常见的机会性感染疾病,也是该类患者致死的重要原因[1]。PCP是由卡式肺孢子菌(PC)感染引发的一种疾病。目前临床上诊断PCP的主要方法是病原学检测、免疫学诊断和分子学诊断[2]。病原学检测是最常用的方法,被称为“金标准”,此方法特异度高,但是较繁琐、检出率低。免疫学诊断具有特异度好,检出率高的优点,但是成本较高[3]。分子学诊断方法主要是聚合酶链式反应(PCR),特异度好,但是需要专门的试剂和贵重仪器。环介导恒温扩增法(LAMP)指在等温环境下,30~60 min内进行核酸扩增,扩增过程中出现焦磷酸镁沉淀,肉眼可判断结果[4]。LAMP法灵敏度高,最低检测限为10个拷贝。张楠等[5]发现LAMP方法特异度高,灵敏度高于PCR方法,反应时间较短,临床使用时不需要特殊仪器,操作较简单。1,3-β-D葡聚糖(BDG)是真菌细胞壁的主要成分之一。研究发现BDG与深部真菌感染关系密切[6]。本研究通过构建卡式PCP大鼠模型,建立LAMP法检测模型大鼠体内PC,同时测定BDG,旨在探讨LAMP检测方法在卡式PCP大鼠中的可行性及BDG水平的变化。
1 材料与方法
1.1材料
1.1.1实验动物 Wister大鼠,SPF级,雌性,200~220 g左右,购自上海斯莱克动物中心。生产许可证为SCXK(沪)2017-0005,实验动物许可证为SYXK2015-009。
1.1.2主要试剂 地塞米松磷酸钠注射液(金耀,天津金耀药业有限公司,国药准字H2020514);四环素片(华南,广东华南药业集团有限公司,国药准字H44020690);无内毒素质粒小提中量试剂盒[天根,货号DP118,天根生化科技(北京)有限公司];PMD18-T Vector试剂盒[宝生物,货号6011,宝生物工程(大连)有限公司];Bst DNA聚合酶(KALANG,货号KL-D7887,上海康朗生物科技有限公司);琼脂糖(Spain,货号A8201,北京索莱宝生物科技有限公司);大鼠1,3-β-D葡聚糖ELISA试剂盒购自基尔顿生物科技(上海)有限公司;SYBR GreenⅠ核酸染料购自上海美季生物技术有限公司;引物由英潍捷基(上海)贸易有限公司合成。
1.1.3主要仪器 DNA电泳仪购自孚光精仪(中国)有限公司;DKT200-2恒温金属浴购自广州华韵生物科技有限公司;台式高速离心机购自北京泰泽瑞达科技有限公司;KEFS-1高速组织匀浆机购自上海艾黎化学科技有限公司。
1.2方法
1.2.1PCP模型构建 40只Wister大鼠分成肺炎感染组和对照组,每组各20只。对肺炎感染组大鼠进行腹腔注射地塞米松磷酸钠注射液3.5 mg/只,2次/周,期间为防止细菌感染,给予肺感染大鼠含四环素的饮水(1 g/L),对照组大鼠腹腔注射同等剂量无菌生理盐水,连续注射8周,8周后停止注射。期间随时观察两组大鼠的活动、饮水和饮食情况,记录大鼠存活数,每2周称量体质量。停止地塞米松磷酸钠注射液后,取肺炎感染组大鼠右肺中叶制成肺印片进行GMS染色,油镜下观察并发现肺组织中存在典型的肺孢子菌包囊,则认为PCP模型构建成功。
1.2.2实验样本的采集 构建模型前,每组各取6只大鼠称重,使用乙醚进行麻醉后心脏取血1 mL,离心后取血清备用。解剖各组大鼠,取肝脏、肠系膜淋巴结及完整的肺组织并称重,计算肺重/体质量比。参照相关文献[7]的方法,对大鼠进行支气管肺泡灌洗,采用离心管收集灌洗液,离心收集上清备用。到第8周时两组各处死10只大鼠,麻醉后心脏取1 mL血,离心后取血清备用。解剖大鼠取肝脏、肠系膜淋巴结及完整的肺并称重,计算肺重/体质量比。收集灌洗液,方法同上。
1.2.3引物设计 从 GeneBank获得卡式肺孢子菌核内核糖体小亚基16s rRNA的基因序列(X12708),使用DNA man软件与人肺孢子菌(AB266392)、念株菌属(E15168)、酵母菌属(Z75578)和小鼠肺孢子菌(AY532651)等的16s rRNA进行比对,选择一段保守性好的基因片段。利用Primer5软件设计16s rRNA 特异度 LAMP引物。见表1。
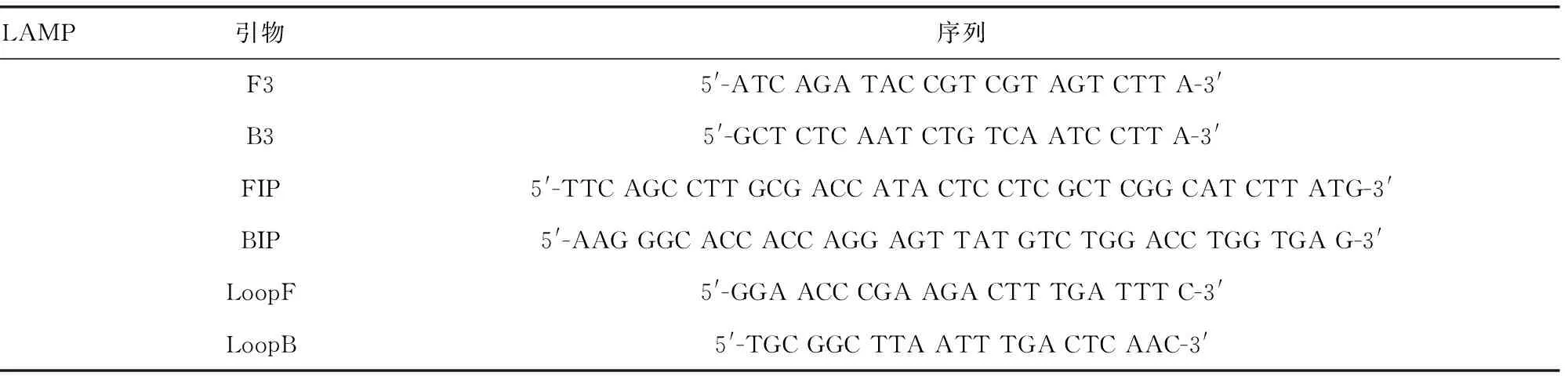
表1 LAMP 引物及碱基序列
1.2.4质粒构建 使用引物F3、B3进行PCR扩增,PCR产物与PMD18-T载体连接后转化至感受态细胞中,提取重组质粒PMD18-T-16s rRNA。
1.2.5LAMP反应体系 本实验采用25 μL反应体系,包括10×buffer 2.5 μL,dNTPs 2 μL,MgCl23.2 μL,LoopF和LoopB引物各0.16 μL,FIP和BIP引物各0.32 μL,F3和B3引物各0.04 μL,BST DNA 聚合酶0.8 μL,将反应混合物混匀后,再分别加入模板(质粒模板或者组织DNA)2 μL,SYBR GREENⅠ0.5 μL,加双蒸水至25 μL,混匀后点离,放置于63 ℃恒温水浴1 h。取5 μL进行2%琼脂糖凝胶电泳,观察电泳和颜色变化结果。
1.2.6酶联免疫吸附试验(ELISA)法检测血清和肺灌洗液中BDG 严格按照1,3-β-D葡聚糖ELISA试剂盒说明书步骤进行检测。
2 结 果
2.1两组大鼠的一般情况比较 构建大鼠过程中发现肺炎感染组大鼠出现饮食饮水减少、反应变迟钝、斑块状脱毛、眼球颜色变暗、眼睛和鼻子炎性分泌物增多等现象。注射地塞米松8周后,肺炎感染组大鼠死亡4只,死亡率为28.57%。与对照组比较,肺炎感染组大鼠体质量从第6周开始明显下降,持续到第8周,差异具有统计学意义(P<0.05)。见图1。
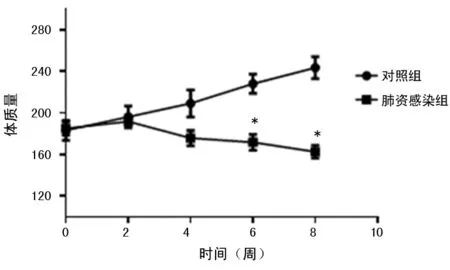
注:与对照组比较,*P<0.05
图1两组大鼠的体质量比较
2.2两组大鼠肺重及肺重/体质量比比较 注射地塞米松前两组大鼠肺重和肺重/体质量比差异无统计学意义(P>0.05)。与注射地塞米松前比较,注射地塞米松8周后肺炎感染组肺重和肺重/体质量比明显上升,且观察组注射地塞米松8周后肺重和肺重/体质量比高于对照组,差异有统计学意义(P<0.05),具体结果见表2。
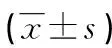
表2 两组大鼠肺重及肺重/体质量比比较
注:与对照组比较,*P<0.05;与同组注射地塞米松前比较,#P<0.05

表3 两组大鼠各组织卡式肺孢子菌LAMP检测结果[n/n(%)]
注:与对照组比较,*P<0.05;与肺组织比较,#P<0.05
2.3两组大鼠各组织卡式肺孢子菌LAMP检测结果 注射地塞米松前,对两组大鼠(n=6)肺组织、肝组织和肠系膜淋巴结进行LAMP检测,荧光为棕黄色,判定PC感染为阴性。注射地塞米松8周后,对照组大鼠3种组织LAMP荧光为棕黄色,判定PC感染为阴性;肺炎感染组大鼠均有组织DNA LAMP荧光为绿色,判定PC感染为阳性,其中肝组织和肠系膜淋巴结PC检出率低于肺组织,差异有统计学意义(P<0.05),与对照组比较,肺炎感染组肺组织检出率升高,差异有统计学意义(P<0.05),肝和肠系膜淋巴结检出率比较,差异无统计学意义(P>0.05),具体结果见表3。
2.4两组大鼠外周血和肺灌洗液BDG水平比较 注射地塞米松前两组大鼠外周血和灌洗液的BDG水平差异无统计学意义(P>0.05)。注射地塞米松8周后肺炎感染组外周血和肺灌洗液BDG水平表达均上升,均高于对照组,且肺灌洗液BDG水平高于外周血,差异有统计学意义(P<0.05),具体结果见表4。
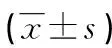
表4 两组大鼠外周血和肺灌洗液BDG水平比较
注:与对照组比较,*P<0.05;与注射地塞米松前比较,#P<0.05;与外周血比较,△P<0.05
3 讨 论
肺炎主要是病原体所引发的疾病,如:真菌、细菌、支原体、衣原体和病毒等[8]。PC属于机会性致病真菌的一种,可导致PCP的发生。近些年来随着艾滋病、肿瘤和自身免疫性疾病患者人数的增加,PCP的致死率也逐年增加[9]。研究报道,PCP与慢性阻塞性肺病(COPD)发生存在关系[10]。目前临床上PC的检测方法主要为病原学检查,该方法具有良好的特异度,但是耗费时间较长[11]。LAMP是一种等温核酸扩增方法,敏感性高。研究发现,LAMP灵敏度、特异度和检出率与巢氏PCR和实时定量荧光PCR无明显差异[12]。因此将LAMP检测方法运用于PCP检测,对于该疾病的早期诊断和预后都具有重要的意义。
本研究采用腹腔注射地塞米松的方法构建PCP模型,建模过程中发现肺炎感染组大鼠出现饮食饮水减少、反应变迟钝、斑块状脱毛、眼球颜色变暗、眼睛和鼻子炎性分泌物增多等现象。注射地塞米松8周后,肺炎感染组大鼠死亡4只,死亡率为28.57%。与对照组比较,肺炎感染组大鼠体质量从第6周开始明显下降,持续到第8周,差异有统计学意义(P<0.05)。结果提示了模型大鼠病情随建模时间延长而加重,也侧面验证了模型构建成功。孙艳等[13]也发现卡氏PCP模型大鼠随着建模时间病情会加重,出现体质量减轻、反应迟钝等情况。目前国外已经开展LAMP检测肺孢子菌,但是国内还在构建LAMP检测方法阶段[14]。本研究在PCP大鼠模型上运用LAMP技术检测到PC感染,检出率为100%,而对照组各组织均未检测到PC感染。结果提示此方法具有高特异度,结果可靠,不存在假阳性。值得一提的是,PCP组10只大鼠肺组织均检测到PC感染,各有1只肝脏组织和肠系黏膜组织也检测到PC感染,其原因可能是PC在PCP疾病后期发生了转移扩散,这需要后期大量实验验证。
BDG检测主要用于系统性念珠菌病和肺曲霉病的检测,在PC的检测中应用较少[15-16]。本研究结果显示,注射地塞米松前两组大鼠外周血和灌洗液的BDG水平差异无统计学意义(P>0.05)。注射地塞米松8周后肺炎感染组外周血和肺灌洗液BDG水平表达均上升,均高于对照组,且肺灌洗液BDG水平高于外周血(P<0.05)。结果提示了BGD与PCP有一定相关性,可作为PCP的早期辅助诊断指标。吴欢欢等[17]也发现BGD与PCP具有一定相关性,是可靠的PCP辅助诊断的指标。肺灌洗液中BGD高于血清BGD,原因是肺部是PC的易感部位,且肺泡中含有大量吞噬细胞,吞噬病原菌后可释放更多BDG[18]。
4 结 论
本研究成功建立PCP大鼠PC基因的LAMP检测方法,可将此方法与临床常用的PCP诊断方法结合并进行优化,对简捷高效的新型诊断技术开发具有一定的潜在价值。同时,本研究发现BGD与PCP有一定相关性,可作为PCP的早期辅助诊断指标。

