黏液乳头型室管膜瘤1例并文献复习*
张晓莹,程凤凤,于 静,房爱菊,姜艳红,杨香山
(山东省立第三医院病理科,山东济南 250000)
黏液乳头型室管膜瘤(MPE)是一种室管膜肿瘤[1],好发于儿童和年轻人,发病率较低,男性发病率高于女性;多发生在脊髓的圆锥、马尾、中丝部位,约70%的MPE发生于L2椎体水平附近[2],成人多发生于脊髓,儿童则多发于颅内[3]。手术全切术后大部分预后较好,但可局部进展或复发,复发率高达41%。本研究收集了山东省立第三医院病理科2017年确诊的1例MPE,并对该病例的影像学及病理学结果进行分析、总结,旨在临床、影像及病理方面对该病进行更深入的认识。
1 临床及影像学资料
1.1临床资料 老年男性,尿色清,夜尿增多,排尿欠通畅,神志清晰,强迫坐位及侧卧位,双层髋关节可见大小约3 cm×2.5 cm皮肤压痕,皮肤及黏膜无黄染,未查见肿大浅表淋巴结,既往曾因胃溃疡、胃穿孔行部分胃切除手术。无传染病史,无重大外伤史。无家族遗传性疾病史。体格检查:双肱二、三头肌反射(++),双跟膝腱反射(++),双巴氏征(-),脑膜刺激征(-)。超声及胸部DR示颈动脉斑块形成和主动脉硬化。实验室检查结果:血常规白细胞计数及红细胞计数正常,血红蛋白比正常值稍低,尿常规、肝功、凝血、总蛋白、胆红素均正常,同型半胱氨酸(HCY)升高至24.1 μmol/L(正常值0~15 μmol/L);肿瘤标志物:癌胚抗原(CEA)升高至6.40 ng/mL(正常值0~5 ng/mL),甲胎球蛋白(AFP)、游离前列腺抗原(sPSA)、总前列腺抗原(tPSA)、β-绒毛膜促性腺激素(HCG)均正常。
1.2影像学资料 磁共振成像(MRI)检查显示,T11水平以下的椎管内可见弥漫且不规则的长T1长短T2异常信号,上缘与脊髓关系密切,病变下缘至S2水平,边界尚清,其内信号不均质,局部椎管扩大,腰骶椎多个椎体局部骨质受压吸收改变,腰椎诸椎间盘变性并向周围轻度膨出。注入磁共振造影剂(GD-DTPA)后,椎管内可见明显不均强化,以T12、L1水平节段最为明显。见图1。
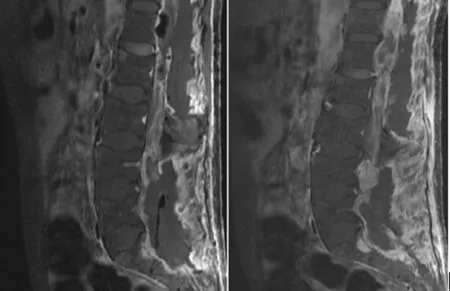
图1 矢状位强化MRI示,MPE位于T11- S2水平的椎管内,为高信号的包块阴影
2 病理特点
2.1巨检所见 灰红灰白色不规则组织一堆,总体积7.5 cm×6.5 cm×3.3 cm,大部分呈实性,伴部分黏液,质较软。
2.2病理检测 送检组织经10%中性福尔马林固定,经常规脱水,石蜡包埋,4 μm厚度切片,HE染色,光镜观察。HE及免疫组化切片经2位经验丰富的病理主任医师阅片并诊断。免疫组化染色采用SP法,所用抗体GFAP、S-100、Syn、CK、vimentin、 Ki-67均购自福州迈新公司,并设立阳性及阴性对照,所有操作均按照试剂盒的说明进行。所有切片均用新鲜配置的DAB显色,GFAP、Syn、CK、vimentin染色定位于细胞质,S-100染色定位于细胞质/核、Ki-67定位于细胞核。细胞质/核内出现棕黄色颗粒为阳性染色,根据阳性细胞的数量、比例和染色强度判读免疫组化的结果。
2.3镜检所见 光镜示,瘤细胞一般呈立方形或长梭形,被覆于乳头结构的外周,多呈单层,也可呈多层,无明显异型性,乳头大小不一,呈特征性的菊形团或假菊形团排列。血管间质为轴心,局灶可见微囊结构,乳头中心血管和纤维结缔组织明显黏液变性,黏液聚集在瘤细胞和血管之间[4-6]。瘤细胞的细胞浆嗜伊红,伴空泡形成,细胞核圆形,染色质均匀,无病理性分裂像和核仁(见图2A、B)。
2.4免疫组化 肿瘤细胞表达GFAP、S-100,且GFAP表达弥漫、均匀强阳性,Syn、CK、vimentin均为阴性,Ki-67阳性指数小于2%(见图2 C-F)。
2.5病理诊断 经2名高级职称诊断医师共同调片诊断为(胸11至骶2椎管内)MPE(WHO I级)。
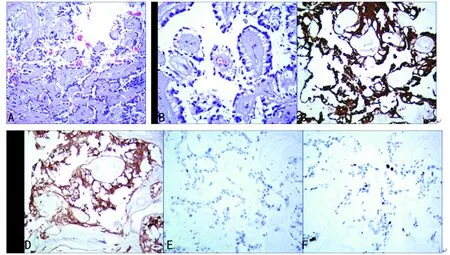
注:A.肿瘤形成大小不一的乳头状结构,基质中可见粘液样物(HE 100×);B.瘤细胞呈放射状排列于血管周围(HE 200×);C.GFAP瘤细胞强阳性(200×);D.S-100瘤细胞阳性(200×);E.CK瘤细胞阴性(200×);F.Ki-67瘤细胞小于2%(200×)
图2黏液乳头型室管膜瘤的HE及免疫组化图片
3 治疗及随访
患者于2017年10月行手术切除肿瘤。术后3个月经电话随访,患者术后卧床1个月,大小便基本恢复正常,术后40 d病情突然加重,再次大小便失禁,言语不清,未再就诊复查,现已去世。
4 讨 论
4.1临床特点 室管膜肿瘤是一组起源于脑室内衬的室管膜细胞和脊髓中央导水管的残余室管膜细胞的肿瘤,WHO[7]将室管膜肿瘤分为:(1)室管膜瘤:亚型包括乳头型、透明细胞型、伸长细胞型(WHO Ⅱ型)3型;(2)间变型室管膜瘤(WHO Ⅲ型);(3)黏液乳头型(WHO Ⅰ型);(4)室管膜下瘤(WHO Ⅰ型)。MPE是其一种特殊亚型,约占9%~13%。1932年,KERNOHAN[8]首次描述了该肿瘤的形态学特点和特殊部位,病变多位于腰椎。WIPPOLD等[9]报道的20例MPE中,14例位于L2椎体,发生率占70%。MPE的发生部位与临床表现有很大关系,多以腰背部疼痛和(或)坐骨神经痛最常见,有时会放射至下肢,可出现下肢无力、肢体运动感觉和大小便障碍,膀胱功能失调,个别病例伴有性功能减退。
4.2影像学特点 MRI增强扫描可见MPE呈类圆形、长条形、腊肠形、分叶形,肿瘤一般呈显著不均匀强化,界限清,位于圆锥区肿瘤内见囊性改变和出血信号,增强后可明显强化。MPE在T1上呈等信号,在T2加权MRI上表现为高信号,在T2加权扫描上具有异质性成像特征,这些不均匀性表表示肿瘤内出血和钙化。肿瘤可呈膨胀性生长,压迫并破坏周围骨质,常血供丰富伴囊性变,可以伴组织坏死。肿瘤长度一般以椎体数计算,研究发现,MPE的长度一般为1.5~4.6个椎体数[10],该病例为9个椎体数,肿瘤较大,范围较广,比较罕见。
4.3病理学特点 组织学:瘤细胞围绕血管及黏液样基质形成的轴心排列成乳头、放射状和假菊形团结构,也可见微囊、管状、筛状结构。肿瘤细胞的异型性很小,核分裂像几乎不见。血管周围伴黏液变,伴出血及胶原化。免疫表型:GFAP、S-100和波形蛋白强阳性,NSE、EMA、Vimentin、CD99 、CEA部分病例可阳性,Syn、CgA、CK阴性,Ki-67阳性指数多较低,约为(2.6±2.6)%。研究发现,室管膜瘤中GFAP均有表达,但在高级别的室管膜瘤中,GFAP弱表达,vimentin强表达,在低级别的室管膜瘤中,GFAP表达明显增强,vimentin表达明显减弱[11]。许多先前的研究已经分析了Ki-67表达和室管膜瘤的预后的关系,Ki-67与室管膜瘤的分级之间存在显着相关性,室管膜瘤Ⅲ级与Ⅰ级和Ⅱ级肿瘤相比Ki-67表达显著增高,Ki-67可以作为判断室管膜瘤预后的重要因素并可归入室管膜瘤的分级方案[12]。
在对27例MPE的研究中发现,血小板衍生生长因子受体α(PDGFRα)、基质金属蛋白酶-2(MMP2)和基质金属蛋白酶-14(MMP14)在MPE中高表达,可以作为其新的诊断标志物,且PDGFRα可能成为治疗复发性MPE的潜在靶基因[13]。此外,TP53肿瘤抑制基因位于17p13.1上,在人类肿瘤中经常发生突变。TP53在神经系统肿瘤的发病机制中起着重要的作用,但据BETTEGOWDA[14]报道,TP53在室管膜瘤中的表达结果并不一致,有研究结果显示,TP53在MPE中的表达率为26%,也有研究结果显示TP53在MPE中的表达率为37.5%,这可能与发病的地域性或计数标准不同有关。
电镜:瘤细胞镶嵌排列,单层或多层细胞排列形成微菊形团,细胞表面可见大量纤毛和微绒毛,其内可见微管。
分子遗传学:最新研究发现,脊髓室管膜瘤可能与NF2基因突变、NEFL过表达、Merlin蛋白缺失和染色体9q扩增有关,而乳头状室管膜瘤与NEFL和HOXB13过表达相关。虽然MEN1、TP53和PTEN突变在室管膜瘤中较少被发现,但它们可能与不良预后有关,如复发或转移,其意义有待明确。
4.4鉴别诊断 需与MPE相鉴别的肿瘤包括:其他亚型的室管膜瘤、脊索瘤、副神经节瘤、神经鞘瘤、神经纤维瘤、髓母细胞瘤和转移的乳头状腺癌等。其他亚型的室管膜瘤一般好发于颈髓,常伴囊变、出血,肿瘤两端的常囊性变,有典型的“帽征”,囊性变区无明显强化。其他肿瘤可依据影像学表现、病理检查和免疫组化标记进行鉴别诊断。其中,免疫组化是其中的一个重要手段,比如SOX10在MPE中几乎均为阴性,而在间变型室管膜瘤中SOX10阳性率为53%、室管膜下瘤为83%,具有明显的差异性[15],因此,SOX10可用于与其他类型的室管膜瘤的鉴别诊断。
4.5治疗及预后 MPE生长缓慢,生物学行为表现多为良性,复发和转移少见,偶尔可见蛛网膜下腔播散和远处转移。国外数据统计资料显示,儿童人群中室管膜瘤10 年生存率约为64%,成人则为70%[16],与其他类型的低级别室管膜瘤相比,MPE的转移时间缩短了3.6倍,尤其是儿童人群的室管膜瘤的早期阶段转移和复发的风险较高,复发时间较短,手术后需要特别关注。
目前,MPE有效的治疗方法是早期手术完整切除,肿瘤全切或部分切除的存活时间大于10年,而放疗和化疗的益处有限且尚不明确,此外晚期患者的复发比例也相对增加。研究发现,MPE的预后与组织病理学、部位、手术方式相关,此外还与年龄、手术范围、增生和凋亡相关。国内外研究均发现肿瘤的切除范围和程度是该病的一个明确的预后因素,一项多中心研究发现,MPE的5年无复发、生存率分别为90%,在完全切除的情况下,复发率显著降低,患者的生存率明显提高,但手术可能会增加脑脊液播散和远处转移的可能性[17]。
研究发现,转移性室管膜瘤血浆或脑脊液中的GFAP和CEA水平均可升高,且CEA水平与肿瘤的活动密切相关,故检测血浆或脑脊液中GFAP和CEA对于原发性和转移性室管膜瘤的早期发现、鉴别诊断、治疗以及预后判断具有一定的意义。本病例病灶较大,范围较广,结合影像学表现及病理检查明确诊断,肿瘤术中大部分切除,术后未行放疗和化疗。该患者实验室检查结果中HCY升高可能与其动脉斑块及动脉硬化有关,此外,血浆CEA水平稍高,可能与其预后差相关,但患者基础疾病较多,CEA的意义尚不明确。
MPE的诊断依靠影像学和病理学,病理免疫标记物和血浆相关指标的检测有助于明确诊断和预后判断,并有待建立规范的诊断标准。

