改性氧化石墨烯的制备及药物控释性能研究
张伟丽
(商丘职业技术学院, 河南 商丘 476100)
引 言
随着纳米技术与医药领域的不断发展与进步,纳米药物载体系统已广泛用于各类抗癌药物的负载与控释中,它能有效避免药物直接进入人体时带来的多药耐药性及高剂量给药的毒性,降低药物对人体的毒副作用.近年来,纳米胶束、无机纳米粒子、纳米水凝胶等各种形式的纳米药物载体系统都在药物控释领域焕发着生机与活力[1].其中,最为瞩目的是聚合物/无机粒子复合型纳米水凝胶,它同时具备特殊聚合物的环境响应性与无机粒子的高效负载能力.
氧化石墨烯(GO),作为石墨烯的一种衍生物,既具备石墨烯大表面积与强光热转换能力的优势[2],又具备多种亲水官能团与pH敏感性.因此,它能同时负载亲水与亲油性药物,且能在癌细胞周围偏酸性的环境中产生响应,实现药物的靶向释放.但作为一种无机粒子,GO的胶体稳定性差,在生理环境中极易发生团聚现象[3],许多科研工作者为突破这一瓶颈做出了许多努力.Sabine课题组以聚(乙二醇)二甲基丙烯酸酯为基质,将还原氧化石墨烯(rGO)插层其中,使其能稳定存在,且利用rGO的光热效应实现药物的远程光控释放[4].Cao课题组则利用Au/SiO2纳米粒子包覆rGO层状物,他们所建立的这一体系不仅使rGO稳定存在,并且有效提高了材料的光热稳定性与光热转化效率[5].尽管GO稳定存在的载药系统多种多样,他们也具备各自的环境响应性,但有关全面利用癌细胞自身环境的特殊性而建立的载药系统则不多见.因此,基于癌细胞周围环境的高温(42℃)、弱酸性(pH 5.0)及还原性的特点[6],本文以N-异丙基丙烯酰胺(NIPAM)为温敏性单体,N,N'-双(丙烯酰)胱胺(BAC)为还原性交联剂,采用原位聚合法聚合,使GO包裹于聚合物的网状结构中,制备出稳定的温度/pH/还原三重敏感的聚(N-异丙基丙烯酰胺)/氧化石墨烯(PG)纳米凝胶,实现药物的靶向释放.
1 实验
1.1 PNIPAM纳米凝胶与PG纳米凝胶的制备
将3.26 mL氧化石墨烯水溶液(0.5 mg/mL)、单体NIPAM(0.0648 mmol/L)、交联剂BAC(0.0016 mmol/L)及乳化剂十二烷基硫酸钠(SDS,0.0073 mmol/L)溶于50 mL超纯水中,并置于三口烧瓶中搅拌半小时,同时进行加热,当升温至60℃时,向其中通入氮气,随后,搅拌中加入引发剂过硫酸钾(KPS,0.0200 mmol/L)及促进剂NaHSO3(0.0259 mmol/L).再持续搅拌6 h使其充分聚合.随后采用透析法,将得到的产物在超纯水环境中透析3天.最终将得到的PG纳米凝胶冷冻干燥,以备后续实验使用.采用同样的方法,在不加入GO的情况下,可制备PNIPAM纳米凝胶.
1.2 载药纳米凝胶GD、PD与PGD的制备
将50 mg GO、PNIPAM与PG纳米凝胶分别溶于5 mL超纯水中,在搅拌下,向其中分别加入1 mL 抗癌药物阿霉素水溶液(DOX,2 mg/mL).随后,搅拌12 h进行药物负载.负载后,采用透析法除去游离DOX,并将富含游离DOX的溶液收集起来,进行紫外光谱分析,通过光谱上490 nm处的吸收峰强度计算出游离DOX的含量,从而得到纳米凝胶的载药率(LC %)与包封率(EE %).最后,将透析好的载药凝胶(GO/DOX (GD)、PNIPAM/DOX (PD)、PG/DOX (PGD))冷冻干燥,以备后续实验使用.
1.3 药物释放行为研究
采用透析法研究药物释放行为.将2 mg载药凝胶溶于1 mL超纯水中,并置于透析袋中.将透析袋放入30 mL生理缓冲溶液(PBS)中,使透析在不同酸碱环境(7.4、6.5或5.0)、不同温度(25、37或42 °C)及不同浓度(0、2或5 mM)的谷胱甘肽(GSH,还原剂)溶液中进行.在不同时间间隔时,取出3 mL透析液,用作紫外光谱分析,同时补充3 mL新鲜的PBS溶液.DOX随时间的释放量(Cumulative release (Cr))可通过下列公式计算:
Cr = 100 *Wt/Wtot
其中Wt与Wtot分别表示经过t时间溶液中释放出的DOX总量与用于释放研究的载药凝胶中DOX的负载总量.
1.4 结构与性能分析
通过傅里叶变换红外光谱仪(FT-IR, Spectrum one, Perkin-Elmer)与X射线衍射仪(Bruker D8, Bruker)对制备的PNIPAM、GO与PG的结构与组成进行表征,用激光粒度分析仪(ZS90, Malvern)对PG与GO的尺寸进行分析,通过粒度分析与拍摄的溶液分散性照片对PG与GO水溶液的稳定性进行分析比较,用紫外-可见光谱仪(UV-Vis, Lambda 35 CA, Perkin-Elmer)分析评价PNIPAM、GO与PG的载药与释药性能.
2 结果与讨论
2.1 结构与组成分析
图1(a)给出了PNIPAM、GO与PG的红外光图谱.GO的红外谱线上显示出多处GO的特征吸收峰.波长3380 cm-1、1628 cm-1与1728 cm-1处分别为GO的羟基、碳碳双键以及碳氧双键的伸缩振动吸收峰.通过比较PG与GO的红外谱线可知,PG的红外谱线较GO的红外谱线出现了一些新的吸收峰,波长3000 cm-1-2800 cm-1、1546 cm-1与1384 cm-1,1366 cm-1处分别为甲基、氨基与异丙基的伸缩振动吸收峰,这些基团均为PNIPAM的特征基团.图1(b)给出了PNIPAM、GO与PG的X射线衍射图谱.GO的X射线衍射谱线上, 2θ=10.73°处为GO的晶体衍射峰[7].在PNIPAM的谱线上则看不到晶体衍射峰,由于PNIPAM为无定型结构,因此谱线上仅出现了两个宽峰,它们的强度较低.合成后的PG谱线形状与PNIPAM相似,其谱线上已没有晶体衍射峰,仅有两个强度更弱的衍射峰.通过红外图谱分析与X射线衍射分析可知,利用原位聚合法,已成功制备PG纳米凝胶.
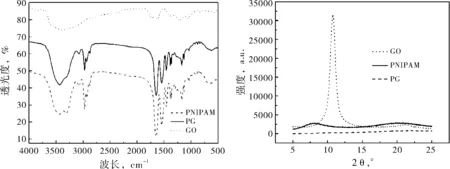
(a) PNIPAM、GO与PG的红外光谱图 (b) X射线衍射图谱
图1PNIPAM、GO与PG的结构及组成
2.2 稳定性分析
在生理环境中,载体必须稳定存在才能运输药物,发挥传递药物的作用.图2(a)给出了在生理缓冲溶液中,GO与PG的水力半径随时间的变化情况.从粒径图中可以看到,随着时间的变化(0-10 h),PG纳米粒子的水力半径非常稳定,始终保持在130 nm左右,说明PG纳米粒子能稳定存在于生理环境中.而GO在生理缓冲溶液中则极不稳定,0 h、1 h、5 h及10 h时,其水力半径分别为8000 nm、6500 nm、3800 nm及4000 nm左右,说明GO在生理环境中无法稳定存在,容易发生聚沉现象.为了更直观的比较PG与GO的生理稳定性,图2(b)给出了不同时间下,PG与GO在生理缓冲溶液中的分散性照片.通过图片对比,可明显发现0 h时,GO溶液较为均匀,没有沉降现象,但随着时间的推移,GO溶液不再稳定,1 h、5 h及10 h时均出现了明显沉降,且时间愈长,GO溶液的上清液愈澄清,沉降层愈致密.而在PG的分散性照片中,随着时间的推移,PG纳米水凝胶的分散液均呈现均一、稳定的状态.因此,水力半径的分析结果与分散性照片的对比情况表现出一致性,说明PG跟不稳定的GO溶液相比更适合作为药物载体,它良好的生理稳定性有助于其在机体中的代谢与循环.
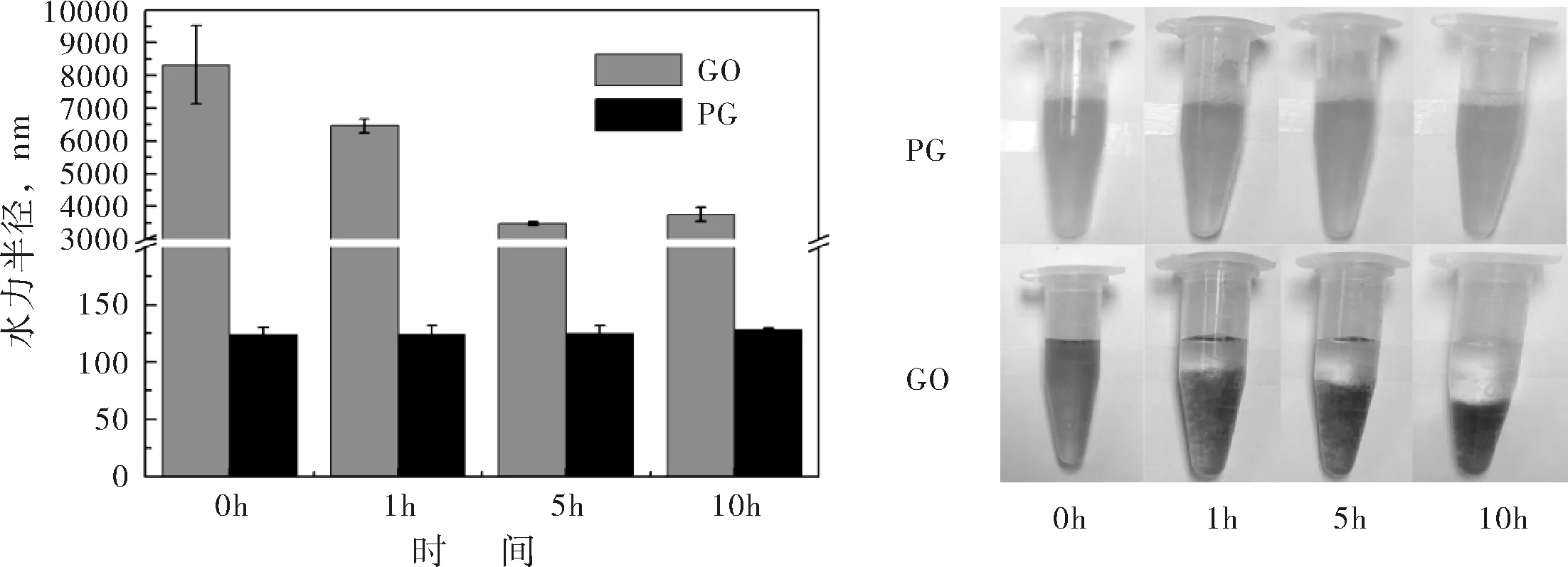
(a) GO与PG(pH 7.4)的水力半径 (b) GO与PG的分散性照片
图2GO与PG的稳定性分析
2.3 载药性能分析
表1列出了载药前后纳米水凝胶的水力半径与Zeta电位值.载药前,25 ℃时GO水溶液的水力半径为368±5 nm,37 ℃时水力半径为379±4 nm,温度的升高并未引起GO尺寸的变化,说明GO对温度无响应性.而PNIPAM与PG粒子的尺寸均随温度升高而减小,说明这两种粒子均能对温度产生响应.且37℃时PG纳米粒子的水力半径为93±1 nm,尺寸小于100 nm,负载药物后可通过血管的渗透保留而长期参与血液循环,降低给药量.载药后,尽管GO的载药率(3.3 %)与包封率(85 %)均较高,但GD的尺寸增大到微米级,说明GO在负载DOX的过程中非常不稳定,与DOX作用,发生聚沉现象,不适合作为药物载体使用.而载药后的PD与PGD纳米粒子的尺寸均保持在纳米级,且为100 nm左右,并呈现出良好的温度响应性.PGD的包封率(63 %)与载药率(2.5 %)较PD(38%,1.5%)高,说明PGD对药物的装载能力强,是一种较理想的药物载体.
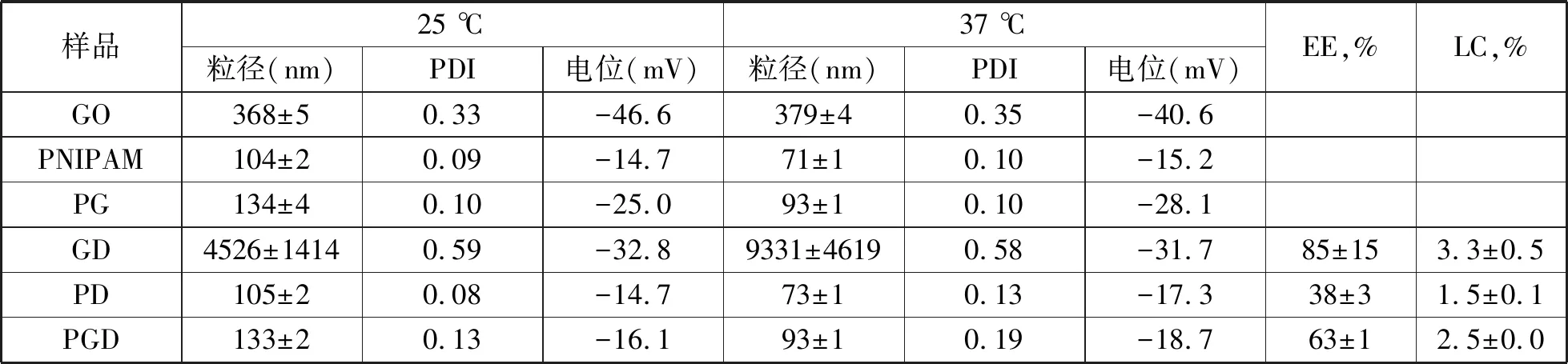
表1 纳米水凝胶的尺寸与载药性能表征
2.4 药物释放性能分析
图3(a)给出了相同环境中PGD、PD、GD及游离DOX的释放情况.由时间-释放量曲线可知,GD中DOX的释放非常缓慢,8 h时其释放量仅为6.57 %,此结果与载药性能结果相符,GO负载DOX的过程中极不稳定,易与DOX结合而聚沉,沉降后形成的GD将DOX紧紧包裹于其中,使DOX无法有效释放出来.与之相对的,未被任何载体负载的游离DOX则释放很快,4 h时其释放量便达到99.97 %,近乎完全释放.因此,不使用任何包覆手段,直接静脉注射游离药物来治疗癌症是不可取的,游离药物会在血液循环的过程中对正常组织细胞产生毒副作用,且无法达到病灶.比较PD与PGD的时间-释放量曲线可知,PGD对DOX 的释放较PD更快,且相较游离DOX,PGD具有一定的缓释能力.8 h时,PGD的释放量为78.99 %,而PD的释放量为67.12 %.因此,相较纯聚合物载体PNIPAM,无机粒子与聚合物的杂化载体PG更适合进行药物的递送,既能保证递送过程中药物不会渗漏,又能保证抵达病灶后药物能快速释放出来.
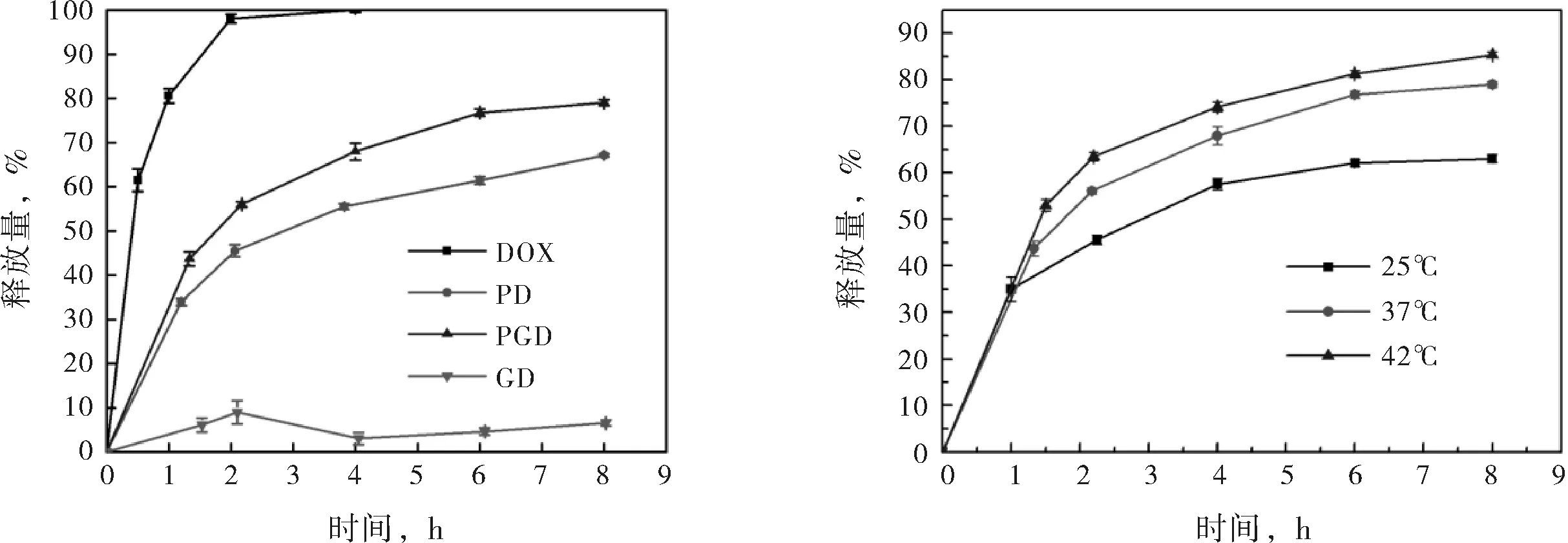
(a) DOX、PD、GD及PGD的时间-释放量曲线(37 ℃,pH 7.4) (b) PGD的时间-释放量曲线(25、37或42 ℃)
图3纳米凝胶的对比释放性能
图3(b)给出了PGD纳米水凝胶在不同温度下的时间-释放量曲线.对比不同温度下的释放情况可知,随着环境温度的升高,PGD粒子对DOX的释放加快,25 ℃、37 ℃及42 ℃时,PGD的8 h释放量分别为63.06%、78.99 %及85.36 %.说明温度升高促进DOX的释放,此结果与不同温度下的粒度分析相符.PNIPAM与PG均为温度敏感性载体,负载药物后依然能对温度产生响应,当温度升高至超过PNIPAM的最低临界溶解温度时,纳米粒子将收缩,负载于其中的药物会被挤出,从而释放出来.PG载体的这种温敏特性恰好适应于癌细胞的特殊环境,癌细胞增殖快,代谢快,其周围的温度(42 ℃)高于正常细胞(37 ℃),因此,使用这种药物载体可实现药物的靶向递送与释放,可提高药效,减小副作用.
图4(a)给出了PGD在不同还原环境中的时间-释放量曲线.对比不同还原环境中的PGD释放情况可知,随着环境中还原性物质浓度的增大,PGD对DOX的释放速度加快,0、2及5 mM GSH时,PGD的10 h释放量分别为71.77 %、86.36 %及90.15 %.结果说明PGD具有还原响应性,当环境中还原物质(GSH)的浓度越高时,PGD对DOX的释放越快.由于聚合过程中使用的交联剂为BAC,它是一种含S-S键的物质,而S-S键极易被还原性物质还原而断裂,形成-S-,因此经S-S键交联的PGD纳米粒子在还原环境中将解交联,粒子形态坍塌,包裹其中的药物易被释放出来.癌细胞由于代谢迅速,还原性代谢产物累积在其周围,导致癌细胞的周围呈还原性.使用PG作为药物载体时,它能靶向癌细胞,并且仅在癌细胞周围迅速释放药物,确保药物不在正常组织处渗漏,减小了毒副作用,同时增大了药效.
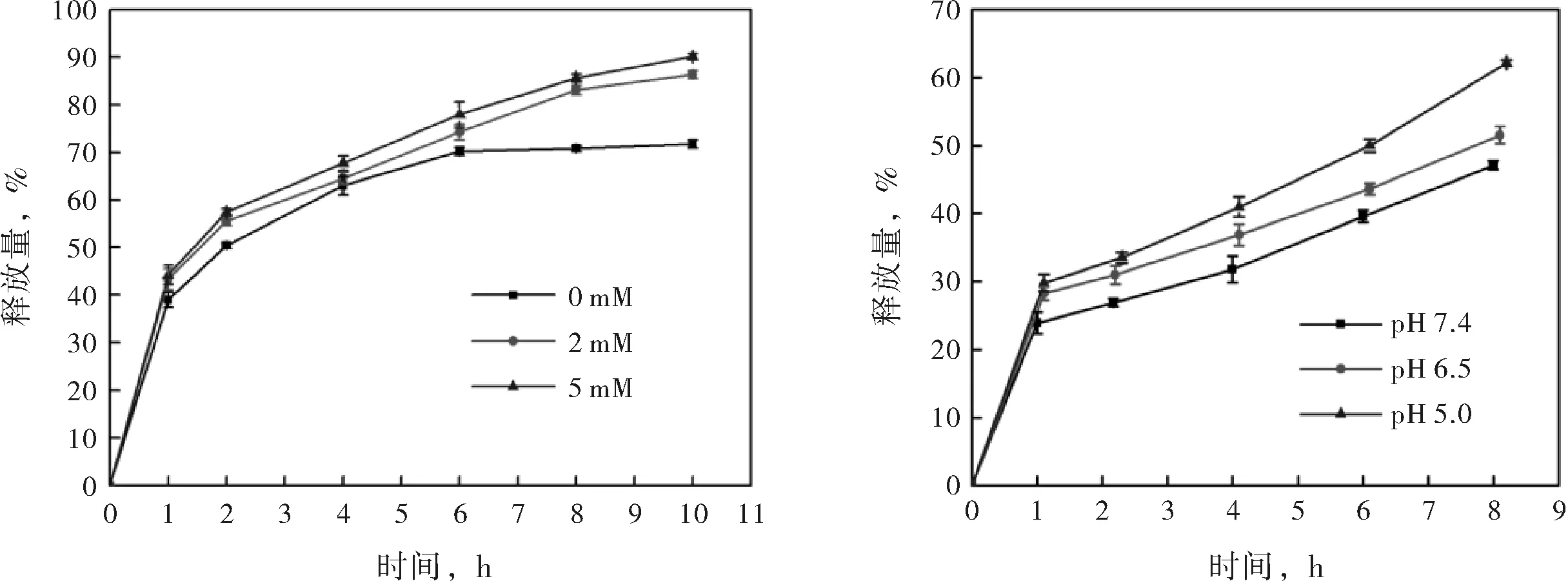
a) PGD的时间-释放量曲线(0、2或5 mM GSH) b) PGD的时间-释放量曲线(pH 7.4、pH 6.5或pH 5.0)
图4PGD敏感释放性能
图4(b)给出了PGD在不同pH下的时间-释放量曲线.对比不同酸碱度环境中的PGD释放情况可知,随着环境酸性的增强,PGD对DOX的释放速度加快,pH 7.4、pH 6.5及pH 5.0时,PGD的8 h释放量分别为47.09 %、51.54 %及62.14 %.结果说明PGD具有pH响应性,当释药环境呈酸性时更有利于药物的释放.PG纳米粒子带负电(见表1),DOX带正电,他们通过静电相互作用结合,实现药物的负载,当环境呈微酸性时,PG纳米粒子将被质子化,电负性降低,导致PG与DOX间的相互作用力减弱,DOX从PG纳米粒子中游离出来,实现释放.PGD的pH响应行为同样适合癌细胞的微环境,相较中性的正常环境,癌细胞周围的环境呈微酸性,因此,使用PG作为药物载体时,在正常组织中,PGD不易释放DOX,待递送至癌细胞处,PGD将对酸性环境产生响应,从而迅速释放出DOX.
3 结 论
1)采用原位聚合法,将无机粒子GO与温敏性聚合物PNIPAM结合制备的PG纳米水凝胶可稳定存在于生理环境中,实现对药物的稳定负载.
2)PGD的载药率(2.5 %)与包封率(63 %)均高于PD(38%,1.5%),因此PG在有效负载药物方面较PNIPAM更具优势.
3)PGD在不同环境中的释放量不同,表现出多重响应性控释行为:环境温度升高时(25 ℃-42 ℃),PGD的8 h释放量由63.06 %增长至85.36 %;环境酸性增强时(pH 7.4-pH 5.0),PGD的8 h释放量由47.09 %增长至62.14 %;环境中GSH浓度增大时(0-5 mM),PGD的10 h释放量由71.77 %增长至90.15 %.癌细胞周围环境呈高温、微酸性与还原性,因此使用PG作为药物载体可实现药物的靶向递送与释放.

