E3泛素连接酶1对SOX2蛋白稳定性的影响
郭 平, 孙潇智, 刘玉杰, 李资益, 杨 婧, 管恒毓, 廖 兵
(上海交通大学基础医学院组织胚胎学与遗传发育学系,上海 200025)
人胚胎干细胞(human embryonic stem cell,hESC)是将着床前的人囊胚的内细胞团细胞在体外培养建立的细胞系[1]。由于hESC拥有无限自我更新的特点和分化为所有成体细胞类型的发育潜能,能为再生医学的研究和应用提供理想的细胞模型与无限的种子细胞来源,所以多年来一直是干细胞领域的研究热点。基于hESC广阔的应用前景,将其用于临床治疗前必须明确其调控自我更新和多能性维持及分化的分子网络。hESC的特征维系涉及转录因子、信号通路和表观遗传修饰等的共同调节[2-3]。其中核心转录因子——性别决定区Y-box蛋白2(sex-determining region Y-box protein 2,SOX2)在hESC细胞分化决定过程中发挥着关键作用[4]。SOX2的变化将影响八聚体结合转录因子4(octamer-binding transcription factor 4,OCT4)、NANOG等其他转录因子的水平,进而影响维持hESC自我更新和多能性相关基因的表达与抑制[5]。目前,SOX2蛋白水平的调控机制尚未被完全阐明。因此,深入研究SOX2表达的调控机制无论对hESC的基础研究还是临床应用都具有重要意义。
蛋白质翻译后修饰在调控蛋白质的结构与功能方面发挥着重要作用,通过改变蛋白质的功能特性或空间结构影响各项生物学过程。蛋白质翻译后修饰的方式多达几十种,其中泛素化修饰是细胞内广泛且重要的修饰方式之一。蛋白质的泛素化修饰是由E1泛素活化酶、E2泛素结合酶和E3泛素连接酶(WW domain containing E3 ubiquitin protein ligase,WWP)催化的酶促级联反应过程,通过建立泛素蛋白与底物蛋白的共价键连接,影响底物蛋白的亚细胞定位、活性和稳定性等[6]。有研究结果显示,在hESC中,WWP2能催化OCT4蛋白的泛素化修饰,并介导其经26S蛋白酶体途径的降解,调控OCT4蛋白处于合适的水平,从而维持hESC的自我更新[7]。为进一步揭示(2-WW-HECT家族WWP1和WWP2对核心转录因子OCT4、SOX2、NANOG蛋白水平的可能作用,本研究拟通过HEK 293FT细胞的共表达实验,探讨WWP1对SOX2蛋白的调控作用。
1 材料和方法
1.1 主要材料
1.1.1 质粒 OCT4过表达质粒(pCMVOCT4)、HA-SOX2过表达质粒(pCDNA-HASOX2)、空白质粒(pPyCAG-flag)、Flag-WWP1过表达质粒(pPyCAG-flag-WWP1)、Flag-WWP2过表达质粒(pPyCAG-flag-WWP2)、WWP1融合蛋白表达质粒(pGEX-4T-1-WWP1)、WWP1-C890A突变质粒(pGEX-4T-1-WWP1-C890A)、SOX2融合蛋白表达质粒[pET-30a(+)-SOX2]均由本实验室自行构建。NANOG过表达质粒(pSin-EF2-NANOG-Puro)购自美国Addgene公司。
1.1.3 抗体 SOX2抗体(批号AF2018,美国R&D公司)、OCT4抗体(批号sc-2079,美国Santa Cruiz公司)、NANOG抗体(批号3369-1,美国EPITOMICS公司)、α-微管蛋白(α-TUBULIN)抗体(批号T5168,美国Sigma公司)、Flag标签(Flag-tag)抗体(批号F3165,美国Sigma公司)、多组氨酸标签(Histag)抗体(批号GT359,美国Sigma公司)、泛素(Ubiquitin)抗体(批号3936,美国Cell Signaling公司)、辣根过氧化物酶偶联二抗(羊抗人IgG抗体、鼠抗人IgG抗体、兔抗人IgG抗体,美国Cell Signaling公司)。
1.1.4 主要试剂 非干扰型蛋白浓度测定试剂盒、甘氨酸、三羟甲基氨基甲烷[Tris(hydroxymethyl)methyl aminomethane,Tris]、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、氯化钠、吐温-20、甲醇、5'-三磷酸腺苷(adenosine 5'-triphosphate,ATP)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、甘油、NP-40溶液均购自生工生物工程(上海)股份有限公司。1×磷酸盐缓冲液、0.25%胰酶、Opti-MEM减血清培养基、胎牛血清、100×非必需氨基酸、100×丙酮酸钠均购自美国Gibco公司。E1泛素活化酶、E2泛素结合酶、His-Tagged-Ub均购自德国Merck公司。聚乙烯亚胺(poly ethylenimine,PEI)、DMEM高糖培养基均购自美国Sigma公司。Glutathione Sepharose 4B购自美国Amersham公司,Ni-NTA His-Bind resin购自德国Novagen公司。
1.1.5 免疫印迹法试剂配制 10×电泳缓冲液(甘氨酸144 g,Tris 30.3 g,SDS 10 g,加水定容至1 L),10×TBS-T[Tris 1 mol/L(pH值7.6)200 mL,氯化钠80 g,吐温-20 1%,加水定容至1 L];1×转膜缓冲液(甲醇 200 mL,甘氨酸14.4 g,Tris 3.1 g,加水定容至1 L)。
1.2 方法
1.2.1 细胞培养 将HEK 293FT细胞在37 ℃、5% CO2、100%湿度条件下培养,密度>80%后以0.25%胰酶消化传代。
1.2.2 质粒转染 使用PEI进行质粒转染,转染前1天用0.25%胰酶消化细胞重新铺板。计算质粒用量和PEI工作液(1 μg/μL)用量,确保PEI工作液体积与待转质粒质量的比例为1∶3,将其加入Opti-MEM减血清培养基中,室温静置30 min后将混合液加入对应细胞中。转染12 h后更换新培养液,换液后继续培养36 h收取细胞。
1.2.3 免疫印迹法 细胞总蛋白提取、蛋白浓度测定及免疫印迹法操作步骤参照文献[7]。
1.2.4 谷胱甘肽S转移酶(glutathione S-transferase,GST)融合蛋白表达与纯化将含目的基因的pGEX-4T-1质粒转化感受态菌BL-21(DE3),挑单克隆培养,添加异丙基硫代半乳糖苷至终浓度0.2 mmol/L,37 ℃培养2 h,诱导融合蛋白表达。冰浴超声波裂菌直至溶液澄清,加入Glutathione Sepharose 4B结合GST融合蛋白(4 ℃,转动孵育60 min)。洗涤3次后加200 μL洗脱缓冲液(4 ℃,转动洗脱30 min),离心取上清。将诱导前菌液、诱导后菌液、裂菌后离心所得沉淀、洗脱样本进行SDS-PAGE电泳,考马斯亮蓝染色检测融合蛋白的制备情况。
目前,可完全降解的塑料主要以淀粉、纤维素、糖和有机酸的一种或几种为基本原料,经过物理、化学或生物学方法加工而成的。受原材料成本、膜材料价格以及推广应用的影响,农用地膜仍然较多采用纤维素或淀粉为基本原料,包括淀粉基地膜和纸地膜等。其中,纸地膜以造纸工艺为基础,以植物纤维为基本原料,在植物纸浆的基础上,通过添加湿强剂、防腐剂和透明剂等化学助剂,采用常规造纸工艺抄制出原纸,然后对其进行加工处理,使纸张具有农用地膜所要求的机械强度和透光、透水、保温、增温、保墒性或其他增肥和除草功能[2-4]。
1.2.5 His融合蛋白表达与纯化 将含目的基因的pET-30a(+)质粒转化感受态菌BL-21(DE3)37 ℃培养过夜。挑单克隆接培养,添加异丙基硫代半乳糖苷至终浓度为1 mmol/L,37 ℃培养4 h诱导His融合蛋白表达。冰浴超声波裂菌直至溶液澄清,加入His-Bind resin结合His融合蛋白(4 ℃,转动孵育60 min)。洗涤3次后加洗脱缓冲液(4 ℃,转动洗脱30 min),将His融合蛋白从beads洗脱。洗脱产物分装后于-80 ℃分批次冻存待用。洗脱样本采用SDSPAGE进行电泳与考马斯亮蓝染色检测融合蛋白的纯化情况。
1.2.6 GST pull-down实验、免疫共沉淀(coimmunoprecipitation,Co-IP)实验、体外蛋白质泛素化修饰 参照文献[8]的实验步骤进行GST pull-down实验、Co-IP实验、体外蛋白质泛素化修饰。
1.2.7 HEK 293FT细胞质粒共表达实验 通过质粒转染在HEK 293FT细胞中分别共表达OCT4、SOX2、NANOG和WWP1或WWP2。WWP1或WWP2的过表达质粒用量分别为0、0.2、0.4、0.8 μg,OCT4、SOX2、NANOG过表达质粒的用量均为0.1 μg。通过免疫印迹法检测WWP1或WWP2过表达对OCT4、SOX2、NANOG蛋白水平的影响。根据蛋白条带信号强度计算各蛋白的相对表达量。
1.2.8 SOX2蛋白合成抑制实验 在HEK 293FT细胞中单独过表达SOX2或与WWP1组成共表达体系,使用放线菌酮(cyclohexmide,CHX)处理细胞,抑制蛋白质合成。通过免疫印迹法检测SOX2在CHX处理8、16、24 h和未处理细胞中的蛋白水平。根据蛋白条带信号强度计算各蛋白相对表达量并绘制SOX2蛋白的半衰期曲线。
1.2.9 SOX2蛋白降解抑制实验 在HEK 293FT细胞中共表达SOX2与WWP1,转染36 h后分别向细胞培养液中加入不同浓度蛋白酶体抑制剂MG132(25、50 μmol/L)或溶酶体抑制剂氯喹(100、200 μmol/L),对照组不加MG132或氯喹,4 h后收取细胞,采用免疫印迹法检测。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析。所有实验均重复3次。呈正态分布的数据以±s表示,多组间比较采用方差分析,2个组之间比较采用非配对Student'st检验。以P<0.05为差异有统计学意义。
2 结果
2.1 WWP1或WWP2对OCT4、SOX2、NANOG蛋白水平的影响
将WWP1或WWP2分别与OCT4、SOX2、NANOG组成共表达体系,并采用免疫印迹法检测各蛋白的相对表达量。结果显示,在WWP1与OCT4、WWP1与SOX2及WWP2与OCT4共表达体系中WWP1或WWP2均呈剂量依赖性地下调对应的共表达蛋白OCT4或SOX2水平,且以WWP1与SOX2共表达体系中SOX2蛋白的表达下降最为明显(相对表达量为0.1)。在其他共表达体系中,WWP1和WWP2对对应的共表达蛋白均无明显的下调作用。见图1。

图1 WWP1和WWP2对OCT4、SOX2、NANOG蛋白相对表达量的影响
2.2 HEK 293FT细胞中过表达WWP1对SOX2蛋白稳定性的影响
以单独过表达SOX2为对照体系,在未处理细胞样本(0 h)中,WWP1与SOX2共表达体系中的SOX2蛋白水平低于对照体系(P<0.05);使用CHX处理8、16、24 h后,WWP1与SOX2共表达体系中的SOX2蛋白水平与对照体系之间差异无统计学意义(P>0.05)。SOX2蛋白半衰期曲线分析结果显示,随着CHX处理时间的延长,SOX2蛋白水平逐渐下降。与对照体系比较,WWP1与SOX2共表达体系中的SOX2蛋白水平在CHX处理24 h后下降速度加快(P<0.05)。见图2。

图2 CHX处理不同时间对照体系及WPP1与SOX2共表达体系中SOX2蛋白的变化
2.3 MG132和氯喹对SOX2蛋白降解的抑制作用添加25或50 μmol/L MG132后,WWP1与
SOX2共表达体系中SOX2蛋白水平随WWP1水平的升高而逐渐降低。添加100或200 μmol/L氯喹后,随着WWP1水平的升高,WWP1与SOX2共表达体系中的SOX2蛋白水平未出现明显变化。见图3。
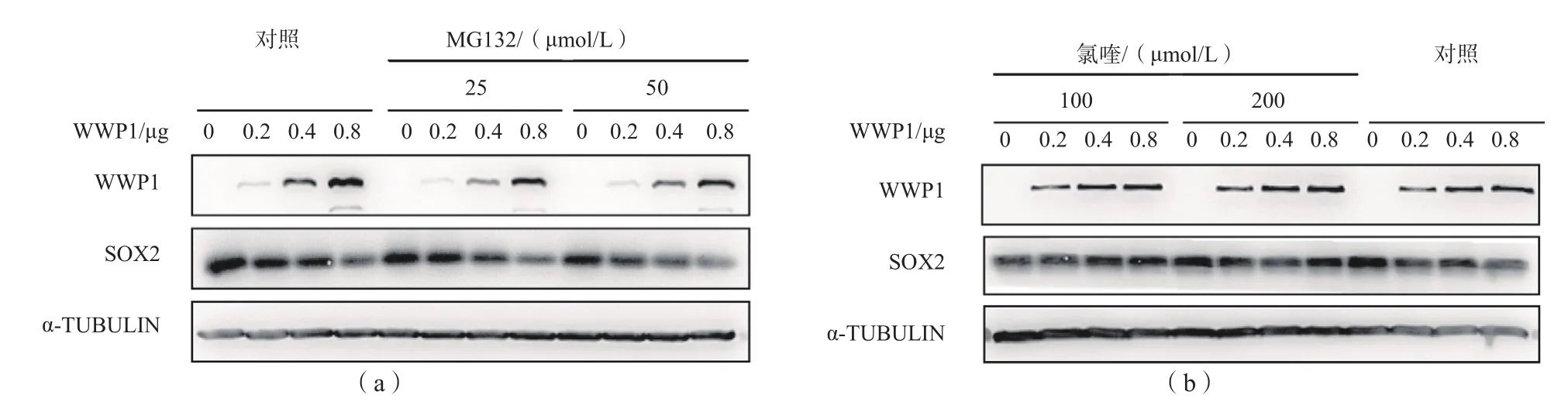
图3 不同浓度MG132和氯喹对SOX2蛋白降解的抑制作用
2.4 重组融合蛋白的表达与纯化结果
结果显示,在相对分子质量150 000附近出现GST-WWP1和GST-WWP1-C890A重组融合蛋白的特异性条带。在相对分子质量45 000附近出现His-SOX2重组融合蛋白特异性条带。见图4。

图4 GST-WWP1、GST-WWP1-C890A 和His-SOX2重组融合蛋白考马斯亮蓝染色结果
2.5 GST pull-down实验检测WWP1与SOX2的直接相互作用
GST pull-down实验结果显示,Glutathione sepharose 4B可沉淀GST-WWP1(免疫印迹法阳性),且GST-WWP1与His-SOX2结合后阳性条带更为明显,而Glutathione sepharose 4B与His-SOX2(对照)仅有微弱的非特异性结合条带。见图5。表明GST-WWP1与His-SOX2在体外条件下能够发生直接的相互作用。

图5 GST pull-down实验和免疫印迹法检测WWP1与SOX2相互作用的结果
2.6 Co-IP实验检测外源性WWP1与SOX2在HEK 293FT细胞中的相互作用
免疫印迹法结果显示,全细胞裂解液(whole cell lysis,WCL)样本中可检测到Flag-WWP1和HA-SOX2的过表达,在Flag抗体-免疫共沉淀蛋白复合物中可同时检测到Flag-WWP1与HA-SOX2蛋白。在单独过表达HA-SOX2的细胞CO-IP实验样本中,SOX2蛋白的表达量较低;与单独过表达HA-SOX2的对照组相比较,在Flag-WWP1与HA-SOX2共表达体系中,免疫共沉淀蛋白复合物的HA-SOX2蛋白表达量较高。见图6。
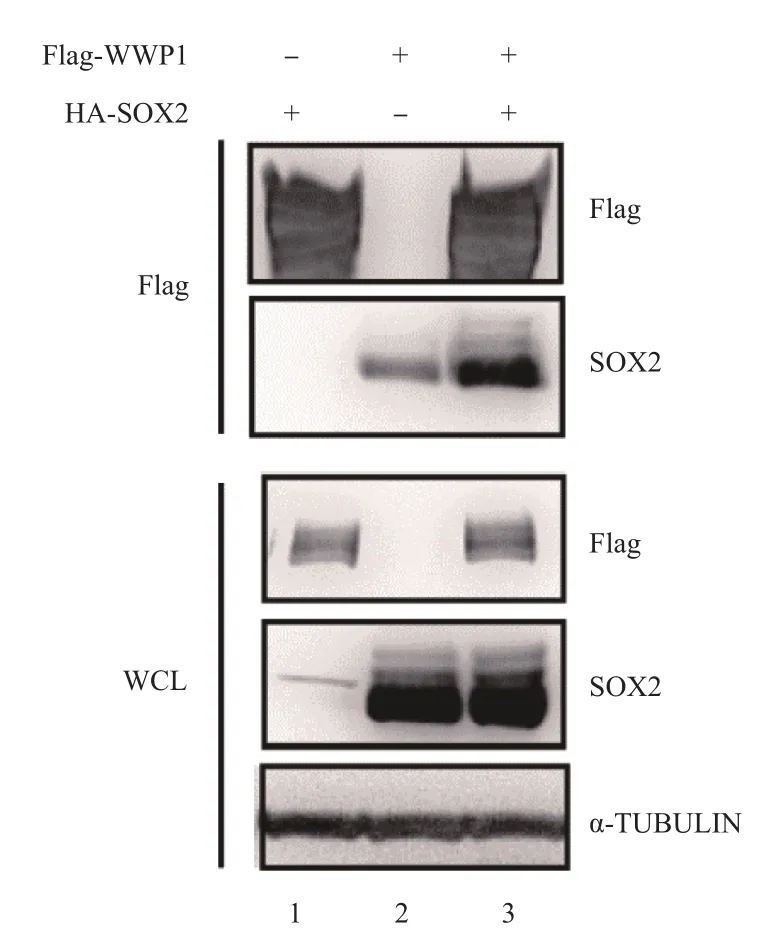
图6 Co-IP实验和免疫印迹法检测WWP1与SOX2的相互作用
2.7 体外模拟WWP1催化蛋白质泛素化修饰结果
免疫印迹法结果显示,当使用泛素抗体进行检测时会出现高相对分子质量的条带(图7上半部分第3~5泳道),在不加His-Ub的情况下这些条带消失(图7上半部分第1泳道),说明蛋白泛素化修饰反应成功。
在不加入GST-WWP1的情况下,泛素化蛋白条带消失(图7上半部分第2泳道)。当突变WWP1蛋白关键酶活位点[第890位半胱氨酸突变为丙氨酸(C890A)]时,泛素化修饰条带消失(图7上半部分第6泳道)。在不加入His-SOX2的情况下,泛素化修饰条带仍会出现(图7上半部分第3泳道)。使用SOX2抗体进行检测,发现加入高剂量GST-WWP1后出现高相对分子质量条带(图7下半部分第5泳道);当突变WWP1蛋白关键酶活位点后,这些条带减弱(图7下半部分第6泳道)。

图7 体外泛素化修饰反应与免疫印迹法检测WWP1催化的蛋白质泛素化修饰
3 讨论
细胞内蛋白质泛素化修饰通过对蛋白质的活性、定位、稳定性以及相互作用的调控参与包括DNA修复[9]、转录调控[10]、囊泡运输[11]、细胞凋亡[12]等在内的细胞生理活动,其最重要的功能之一是通过蛋白酶体途径或溶酶体途径降解蛋白质,以维持细胞生理功能及细胞稳态。在hESC中,WWP2通过调控OCT4蛋白水平维持hESC的自我更新[8],但在未分化的小鼠胚胎干细胞(mouse embryonic stem cell,mESC)中敲低WWP2并不影响OCT4蛋白的泛素化修饰水平和总蛋白量,而当mESC处于分化状态时WWP2又可促进OCT4泛素化修饰后经由26S蛋白酶体的降解,从而迅速下调OCT4蛋白的水平,保障细胞分化的顺利进行[7]。目前已对C2-WW-HECT家族WWP2调控核心转录因子OCT4翻译后修饰的部分机制有了一定认识,但对WWP2同家族的WWP1能否影响OCT4、SOX2、NANOG蛋白的水平仍不清楚。为此,本研究在HEK 293细胞中过表达人源WWP1或WWP2以及核心转录因子OCT4、SOX2、NANOG,发现WWP1呈剂量依赖方式下调SOX2蛋白的水平,半衰期曲线显示共表达WWP1可导致SOX2蛋白的稳定性下降。考虑到WWP1是一种WWP,因此推测WWP1可能通过泛素化修饰下调SOX2蛋白的稳定性和表达水平,在hESC中调控SOX2蛋白处于合适的水平,从而维持hESC的自我更新。
本研究通过体外泛素化实验证明WWP1是SOX2的WWP。在不加GST-WWP1的反应中,泛素化反应信号条带消失,提示WWP1可能是催化蛋白泛素化修饰的WWP。当突变WWP1蛋白关键酶活位点第890位半胱氨酸为丙氨酸(C890A)时,以上泛素化修饰信号条带消失,进一步证明WWP1的WWP功能,同时也表明C890作为WWP1发挥泛素连接酶活性的关键位点催化了SOX2的泛素化修饰。本研究结果还显示,在不加His-SOX2的反应中仍能检测到泛素化修饰条带,说明WWP1可能发生了自我泛素化修饰。为了区分泛素化修饰WWP1与SOX2,本研究使用SOX2抗体进行检测,发现高剂量GSTWWP1组出现高相对分子质量的条带,而突变WWP1酶活位点后条带显著减弱,提示SOX2可能发生了多聚泛素化修饰。
当使用26S蛋白酶体抑制剂MG132或泛素溶酶体抑制剂氯喹处理过表达WWP1和SOX2的HEK 293FT细胞时,MG132并不能抑制WWP1对SOX2的降解,而氯喹可以在一定程度上抑制SOX2蛋白的降解,提示WWP1催化的泛素化修饰可能介导SOX2蛋白经泛素-溶酶体途径降解。在hESC中,细胞内蛋白质的降解主要通过泛素-蛋白酶体降解途径,而溶酶体对hESC蛋白质稳态与细胞命运影响的研究相对较少。有研究结果显示,在早期分化过程中,mESC和hESC均有自噬溶酶体激活的现象[13-14]。在诱导hESC向神经外胚层分化时,自噬溶酶体与核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)相互作用促进该分化事件的进行[15]。CHO等[16]证实泛素蛋白酶体途径与泛素溶酶体途径可以共同调节核心转录因子的蛋白水平。LV等[17]的研究结果显示,表皮生长因子受体可通过抑制SOX2的溶酶体降解来提高口腔癌细胞的干细胞特性。但调控SOX2经由泛素-溶酶体途径降解的WWP一直未被发现。本研究结果显示,WWP1可促进SOX2蛋白经泛素-溶酶体途径降解,为揭示泛素-溶酶体蛋白降解系统在hESC中的作用机制提供了新的证据。但泛素-溶酶体蛋白降解系统主要降解细胞质中的蛋白质,而核蛋白SOX2是如何被该系统降解还有待进一步深入研究。本研究结果有助于阐明hESC中SOX2蛋白水平的调控机制,为揭示核心转录因子决定hESC细胞命运的调控网络提供新的线索。
综上所述,WWP1是SOX2特异的WWP,介导SOX2蛋白经泛素-溶酶体途径降解,进而下调SOX2蛋白的表达。

