自噬在吉西他滨抑制巨噬细胞免疫中的作用及机制研究
潘姝,姜珊珊,原永芳
(上海交通大学医学院附属第九人民医院,上海 200011)
吉西他滨(gemcitabine,Gem)是胰腺癌的一线用药[1]。除了细胞毒性,吉西他滨还具有免疫调节作用。如吉西他滨可选择性作用于调节性T细胞、B淋巴细胞等[2]。然而,吉西他滨对巨噬细胞的作用尚未见报道。
基于巨噬细胞的免疫疗法相比放疗、化疗及手术疗法具有更好的疗效及耐受性[3]。巨噬细胞约占实体瘤免疫细胞总量的5%~40%,是种类最丰富的免疫细胞[4]。研究表明,M1型巨噬细胞在肿瘤免疫治疗中发挥重要的作用[5]。巨噬细胞通过内吞、分泌肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、IL-6、IL-1及产生NO及活性氧来发挥抗肿瘤作用[6]。本研究拟探讨吉西他滨对M1型巨噬细胞功能的影响,并对其机制进行研究。
1 材料与方法
1.1 实验材料、试剂
1.1.1 细胞及培养 小鼠巨噬细胞Ana-1购自中国科学院上海生物化学与生物学研究所细胞库。细胞培养于含10%(φ)FBS及1%青霉素链霉素的RPMI-1640培养基中,细胞放置于含5%(φ)CO2的37℃恒温培养箱中。
1.1.2 材料与试剂 盐酸吉西他滨购自上海源叶生物科技有限公司;细胞周期检测试剂盒及Griess试剂购自碧云天生物科技研究所;IFN-γ购自塞业生物科技有限公司;LPS购自Sigma-Aldrich公司;TNF-α和IL-6检测试剂盒购自上海船夫生物技术有限公司;ROS检测试剂盒购自凯基生物技术股份有限公司;FcRγ组织剂(FCGR2/CD32和FCGR/CD16)和PE-conjugated I-A/I-E抗体购自BD公司;LC3-Ⅱ和β-actin购自Cell Signaling Technology公司;山羊抗兔免疫球蛋白G二抗购自上海明睿生物技术有限公司。
1.2 方法
1.2.1 细胞吞噬实验 将巨噬细胞Ana-1培养在共聚焦皿里,300 IU/mL的IFN-γ和100 ng/mL的LPS及100 ng/mL吉西他滨在37℃环境下共同处理24 h。100 mg/L酵母聚糖孵育2 h,激光共聚焦下观察巨噬细胞的吞噬情况。
1.2.2 细胞周期分析 细胞经药物处理后,收集细胞,预冷PBS洗2次,70%(φ)乙醇4℃下固定过夜,PBS洗2次,根据试剂盒说明书加入PI染色液,37℃避光孵育20 min后,流式细胞仪检测细胞周期分布情况。
1.2.3 透射电子显微镜分析 将处于对数生长期的细胞以5×103/孔的密度种于6孔板中,用适当浓度药物处理一定时间,收集细胞,用含2%戊二醛的培养基固定15 min,1 500 r/min离心,弃去培养基,小心加入1 mL固定液固定过夜,0.1 mol/L PBS缓冲液洗涤3次,用乙醇梯度脱水,60℃放置48 h,在透射电子显微镜下观察其超微结构。
1.2.4 激光共聚焦显微镜观察 Ana-1细胞以1×105个/mL的密度种于6孔板中,经药物处理后,无血清培养基洗2遍后用染料Hoechst 33342(蓝色荧光),自噬检测试剂Cyto-ID®(绿色荧光)及ROS检测试剂Mito Sox(红色荧光)避光孵育15 min,在激光共聚焦显微镜下观察。
1.2.5 细胞上清液NO水平检测 将巨噬细胞Ana-1接种于96孔板中,药物处理后,根据NO检测试剂盒说明书,用培养基将标准品稀释成一定的浓度梯度(0、1、5、10、20、40、60、100μmol/L),在96孔板中加入50μL标准品及细胞上清液,再加入50μL Griess Reagent I和50μL Griess ReagentⅡ,酶标仪在540 nm波长下检测吸光度(A)值。
1.2.6 ROS表达水平检测 将巨噬细胞Ana-1接种至黑色96孔培养板中,药物处理后,去除细胞培养液,加入50μL的10μmol/L DCFH-DA,37℃细胞孵育20 min,用无血清细胞培养液洗涤细胞3次,应用荧光酶标仪检测吸光度值。
1.2.7 Elisa检测上清液免疫因子表达水平 将巨噬细胞Ana-1接种至24孔板中,药物处理后,吸取100μL细胞上清液或标准品加入Elisa反应板中,标准品按照以下浓度绘制标准曲线(500、250、125、62.5、31.2、15.6、7.8、0 pg/mL)。每孔加入50μL生物素化抗体工作液,封板条封住反应孔,孵育120 min,洗涤4次,除空白孔外,每孔加入100μL显色液,黑暗条件下孵育20 min,随后加入100μL终止液,用酶标仪在450 nm波长下测定吸光度值。
1.2.8 MHC-Ⅱ表达水平检测 巨噬细胞Ana-1经药物处理后用200μL培养基重悬,加入4μL FcRγ阻滞剂(FCGR2/CD32和FCGR3/CD16),37℃孵育5 min,随后加入4μL PE-conjugated I-A/I-E抗体,37℃孵育30 min,流式细胞仪检测MHC-Ⅱ表达水平。
1.2.9 Western blot检测凋亡相关蛋白表达水平 将对数期细胞以5×103/孔的密度种于6孔板中,药物作用特定时间后,收集细胞,用预冷的0.01 mol/L磷酸缓冲液(pH=7.4)洗涤2次,用RIPA裂解液重悬并裂解细胞,冰上放置30 min待细胞充分裂解,4℃下12 000 r/min离心5 min收集上清液。每孔上样等量蛋白并进行聚丙烯酰胺凝胶电泳分离,随后将凝胶上的蛋白转移至PVDF膜并用含5%牛血清蛋白的TBST进行封闭1.5 h,一抗孵育过夜后用辣根过氧化物酶标记的二抗室温孵育1 h,TBST清洗3次后ECL化学发光显色试剂盒进行显色,观察凋亡相关蛋白的表达情况。
1.3 统计学处理
应用GraphPad Prism 7软件进行统计分析与作图,实验数据用平均值±标准差(x±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 吉西他滨对巨噬细胞功能的影响
Ana-1小鼠巨噬细胞被IFN-γ/LPS诱导成M1型巨噬细胞[7],观察吉西他滨对M1型巨噬细胞周期及吞噬作用的影响。如图1A~图1B所示,与对照组相比,吉西他滨能够抑制M1型巨噬细胞周期S期阻滞。激光共聚焦显微镜观察吉西他滨对巨噬细胞吞噬作用的影响。如图1C所示,IFN-γ/LPS诱导的巨噬细胞具有较强的吞噬作用,联合吉西他滨后,吞噬作用被抑制。结果表明吉西他滨能够抑制M1型巨噬细胞的功能。
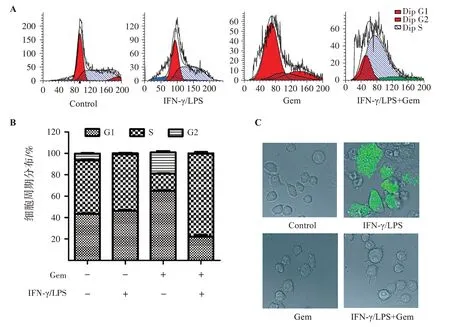
图1 吉西他滨抑制Ana-1细胞周期和吞噬Figure 1 Gemcitabine inhibits cell cycle and phagocytosis of ANA-1 cells
2.2 吉西他滨对Ana-1细胞自由基的作用
Ana-1细胞中的DNA用Hoechst33324(蓝色荧光)标记,ROS用Mito Sox(红色荧光标记)。结果如图2A所示,IFN-γ和LPS联合处理的巨噬细胞红色荧光明显增强,而IFN-γ和LPS联合吉西他滨处理的巨噬细胞,红色荧光明显减弱。随后,DCFH-DA标记ROS,荧光酶标仪下检测ROS荧光强度。结果如图2B所示,IFN-γ和LPS联合吉西他滨后,Ana-1细胞的ROS水平显著降低(P<0.05)。随后,检测吉西他滨对Ana-1细胞产生NO的影响。结果如图2C所示,IFN-γ和LPS诱导的NO水平约为对照组的2.5倍,而IFN-γ和LPS联合吉西他滨诱导产生的NO水平约为对照组的1.5倍。表明吉西他滨能抑制活化的局势细胞产生NO(P<0.01)。
ELISA检测TNF-α和IL-6在巨噬细胞中的表达。结果如图2D~图2E所示,IFN-γ和LPS诱导Ana-1产生TNF-α和IL-6分别为对照组的3.5和5.2倍。而IFN-γ和LPS联合吉西他滨,Ana-1产生TNF-α和IL-6分别为对照组的2和2.6倍,说明吉西他滨能够抑制活化的巨噬细胞产生TNF-α和IL-6。
MHC-Ⅱ参与特异性免疫应答,接下来研究了吉西他滨对巨噬细胞抗原提呈能力的影响。结果如图2F所示,IFN-γ和LPS诱导的Ana-1细胞MHC-Ⅱ表达水平最高,而IFN-γ和LPS联合吉西他滨抑制了MHC-Ⅱ的表达。结果表明吉西他滨能够抑制巨噬细胞抗原提呈能力。

图2 吉西他滨抑制Ana-1细胞自由基的产生Figure 2 Gemcitabine inhibits free radical production in ANA-1 cells
2.3 吉西他滨对Ana-1巨噬细胞自噬的影响
通过共聚焦显微镜和投射电镜观察巨噬细胞自噬体的产生。使用Hoechst 33342(蓝色荧光)标记活细胞核,Cyto ID(绿色荧光)标记自噬相关蛋白。结果如图3A所示,IFN-γ和LPS联合处理的巨噬细胞诱导的绿色荧光显著增强,而IFN-γ和LPS联合吉西他滨处理的巨噬细胞绿色荧光显著减弱。投射电镜下能够明显观察到IFN-γ和LPS联合处理的巨噬细胞有较多的自噬体结构,而IFN-γ和LPS联合吉西他滨处理的巨噬细胞自噬体结构明显减少(图3B)。最后,用Western blot法检测自噬相关蛋白LC3的表达情况。结果如图3C所示,IFN-γ和LPS联合处理的巨噬细胞LC3-Ⅱ蛋白表达水平显著升高,而IFN-γ和LPS联合吉西他滨处理的巨噬细胞LC3-Ⅱ表达水平下降。表明,吉西他滨能够抑制活化的巨噬细胞自噬。

图3 吉西他滨抑制巨噬细胞自噬Figure 3 Gemcitabine inhibits autophagy in ANA-1 cells
2.4 激活Ana-1细胞自噬逆转吉西他滨免疫抑制
分别用自噬抑制剂3-MA和自噬诱导剂海藻糖(Tre)分别处理活化的巨噬细胞,观察巨噬细胞免疫应答水平。结果如图4A所示,激活细胞自噬,逆转了吉西他滨对活化的巨噬细胞抑制。而抑制自噬,巨噬细胞的吞噬功能仍处于较低水平。考察巨噬细胞相关细胞因子的表达水平,结果如图4B~图4D所示,与IFN-γ和LPS联合吉西他滨处理的巨噬细胞相比,激活细胞自噬后,IFN-γ和LPS联合吉西他滨处理组的TNF-α、IL-6和MHC-Ⅱ表达水平均显著升高,差异有统计学意义(P<0.01)。结果表明,激活巨噬细胞自噬,能够逆转吉西他滨对活化的巨噬细胞的免疫抑制。
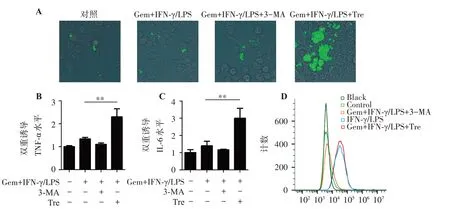
图4 激活抑制巨噬细胞自噬逆转免疫抑制Figure 4 Activation of autophagy reverses immune inhibition in Ana-1 cells
3 讨论
吉西他滨是一种嘧啶类抗肿瘤药物,用于多种实体瘤的化学疗法,如胰腺癌和转移性乳腺癌[8]。然而,吉西他滨的药物抵抗始终是影响治疗成功与否的阻碍。研究表明,一个有效的免疫体系对化疗药物的抗肿瘤疗效具有促进作用,而在肿瘤微环境中,抑制免疫可以促进药物抵抗[9]。
在肿瘤微环境中,T细胞和巨噬细胞均可启动或抑制对肿瘤细胞的免疫进攻[10]。化学疗法所产生的免疫增强和免疫抑制作用依赖于药物种类、剂量、服药时间和肿瘤类型等[11]。研究发现,吉西他滨能通过调节微环境中的树突状细胞和T细胞增强抗肿瘤免疫。而另有研究,吉西他滨可通过激活髓性来源抑制性细胞(myeloid-derived suppressor cells,MDSC)的炎性通路而选择性的降低抗肿瘤效果[12];Sachin等[13]发现吉西他滨作用于胰腺癌细胞后,肿瘤细胞产生的IL-8能够促进巨噬细胞RAW264.7迁徙、侵袭和增长,同时诱导巨噬细胞向M2型转化进而促进肿瘤细胞发展。
吉西他滨对M1型巨噬细胞的功能及作用机制尚未见报道。本研究联合IFN-γ和LPS将Ana-1巨噬细胞诱导分化为M1型巨噬细胞,考察吉西他滨对其功能的影响。利用巨噬细胞对异物具有很强的吞噬功能的原理,观察巨噬细胞对荧光纳米粒的吞噬,结果发现,吉西他滨能够抑制M1巨噬细胞吞噬功能。炎症状态下,巨噬细胞应激产生自由基ROS和NO,帮助机体清除病原微生物和肿瘤细胞。吉西他滨显著降低了M1巨噬细胞ROS和NO表达水平。活化的巨噬细胞MHC-Ⅱ表达会上调,同时释放多种细胞因子,如IL-6和TNF-α。IL-6可参与调节免疫应答,而TNF-α参与炎症的发生和发展。流式细胞术和ELISA实验结果表明,吉西他滨抑制了M1巨噬细胞TNF-α和IL-6的释放并降低了MHC-Ⅱ的表达。以上结果表明吉西他滨能够抑制M1巨噬细胞功能。
自噬在调节机体免疫中发挥了重要作用[14]。本研究考察了吉西他滨对巨噬细胞自噬的影响。发现IFN-γ和LPS激活的M1巨噬细胞自噬体及相关蛋白LC3-Ⅱ表达显著升高,而联合吉西他滨处理组的M1巨噬细胞自噬体显著降低。说明吉西他滨能够抑制M1巨噬细胞自噬。为了研究自噬在巨噬细胞功能中的作用,分别用自噬诱导剂海藻糖(Tre)和自噬抑制剂3-MA激活和抑制细胞自噬,结果发现,联合自噬诱导剂可逆转吉西他滨对M1巨噬细胞的免疫抑制。表现为吞噬功能增强,细胞因子TNF-α、IL-6及MHC-Ⅱ表达增加。
本研究发现吉西他滨能抑制M1型巨噬细胞免疫功能,同时吉西他滨能够抑制巨噬细胞自噬。激活自噬,能逆转吉西他滨对M1型巨噬细胞的免疫抑制。本研究为吉西他滨在临床的应用提供了新的思路。

