马身猪CD63基因CDS区的克隆、表达及生物信息学分析
张雪莲,晋大鹏,刘 敏,吴怡琦,李文霞,秦本源, 蔡春波,高鹏飞,郭晓红,李步高,曹果清*
(1.山西农业大学 动物科学学院,山西 太谷 030801;2. 中国农业科学院 北京畜牧兽医研究所,北京 100193)
抗原分化簇63(cluster of differentiation 63, CD63)作为最具有特征性的血小板活化分子标志物[1],被发现于激活的血小板表面,命名为血小板糖蛋白40(platelet glycoprotein 40, Plt Gp40)[2]。随后研究发现,CD63是存在于人早期黑色素瘤细胞中的黑色素瘤抗原491(ME491)[3],还与溶酶体相关的膜表面糖蛋白3(lysosome-associated membrane glycoprotein 3, LAMP3)是同一种分子[4]。CD63作为四跨膜蛋白超家族(transmembrane 4 superfamily, TM4SF)成员,包含4个跨膜域与2个胞外域,具有相似的结构和功能。
CD63与细胞活化、黏附、变异、炎症反应、人免疫缺陷病毒(HIV)、生殖系统及肿瘤的侵袭、转移等多种生命过程相关[5-6]。CD63作为嗜碱性粒细胞的活化标志,广泛表达于活化的嗜碱性粒细胞膜表面;此外在其他活化细胞表面也有表达,包括血小板、内皮细胞、淋巴细胞、单核细胞、中性粒细胞、树突状细胞、巨噬细胞和组织肥大细胞等[7]。Miyamoto等[8]发现,在活化的小鼠巨噬细胞中,CD63 mRNA表达显著增加。CD63作为活化血小板表面的抗体,可介导血小板的活化过程,内皮细胞与中心粒细胞结合后,参与炎症反应及肿瘤转移等病理过程[9-10]。此外CD63在免疫应答方面也发挥了重要作用,在巨噬细胞(APC)和树突状细胞(DC)中,CD63可通过内体途径伴随主要组织相容性复合体II(Major Histocompatibility Complex II, MHC-II)分子呈递抗原并启动免疫应答,即CD63可以与细胞表面的MHC-II相互作用,形成的CD63-MHC-II类复合物重新分布在细胞表面以呈递给CD4阳性T细胞从而促进免疫应答的发生[11-12],并起到保护膜蛋白免于降解的作用[13-14];CD63通过协调核内体和自噬过程以调节细胞内潜伏期膜蛋白1(Latent membrane protein 1, LMP1)水平[15]。而当细胞受到病原菌刺激活化后,CD63从反面高尔基网(trans Golginetwork, TGN)转运至细胞表面,或者直接通过细胞内途径转运至内体和溶酶体,参与多种生理过程。刘艳杰等[16]研究表明,CD63在免疫应答和病原菌侵袭中发挥重要作用,这为进一步研究猪免疫应答分子调控网络提供了一定的理论基础。
马身猪是山西省地方猪种,具有产仔多、耐粗饲、繁殖力高、抗逆性强、肌内脂肪含量高、肉质品质好等优点。近几年关于马身猪的研究多集中在肉质[17-18]和脂肪沉积[19]方面,而对马身猪免疫方面的研究相对较少。此外CD63基因的研究主要集中在人、小鼠等试验动物上,有关猪CD63基因的研究未见报道。因此,本试验对马身猪CD63进行克隆及生物信息学分析,以期为进一步研究猪CD63生物学功能提供理论依据。
1 材料与方法
1.1 试验动物和样品采集
本研究所用试验动物为90日龄山西省地方猪种马身猪3头,均为公猪,28日龄断奶时去势,由山西省大同市种猪场提供。达目标日龄当天屠宰,屠宰后,分别取马身猪的心脏、肝脏、脾脏、肾脏、腰大肌、背部皮下脂肪等样品,放入已标记的冻存管中,迅速置于液氮中保存。
1.2 主要试剂与仪器
1.2.1 主要试剂 Green Taq Mix(Vazyme,南京);DL1 000 DNA Marker、RNAiso Plus regent、Prime Script RT reagent Kit with gDNA Eraser、SYBR Premix Ex Taq II等购于大连TaKaRa。
1.2.2 主要仪器 AB-9902 PCR仪(AB,美国);Universal Hood II 核酸蛋白成像仪(Bio-Rad,美国);ND-1000核酸蛋白测定仪(Nanodrop,美国);DYY-3电泳仪(六一仪器厂,北京);ABI 7500实时荧光定量PCR仪(ABI,美国)。
1.3 试验方法
1.3.1 总RNA提取和cDNA合成 采用TaKaRa RNAiso Plus试剂盒提取各组织的总RNA,提取方法参照试剂盒说明书。将提取的总RNA用核酸蛋白测定仪测定其纯度及浓度,OD260/OD280在1.8~2.0范围内的总RNA用于后续研究。采用PrimeScript RT reagent Kit with gDNA Eraser试剂盒将RNA反转录成cDNA。合成的cDNA置于-20 ℃冰箱保存备用。
1.3.2 引物的设计与合成 根据NCBI GenBank数据库中预测的猪CD63基因mRNA序列(登录号:XM_005663878.2),用NCBI Primer-BLAST和Oligo7软件分段设计扩增CD63基因CDS区的引物P1及P2,并设计荧光定量引物P3及内参基因18S rRNA的引物(表1),送上海生工股份有限公司合成。

表1 引物信息Table 1 Primer information
1.3.3CD63基因CDS区的扩增及克隆 以马身猪所有组织的混合cDNA作为模版,扩增猪CD63基因CDS区。PCR反应总体积为20 μL:Green Taq Mix 10 μL,cDNA 2 μL,P1或P2上下游引物(10 μmol·L-1)各0.5 μL,ddH2O补至20 μL。反应程序:95 ℃预变性5 min;95 ℃变性15 s,59 ℃退火15 s,72 ℃延伸30 s,35个循环;72 ℃延伸7 min。反应产物用1%的琼脂糖凝胶电泳进行检测,选择扩增效果好的PCR产物送华大基因公司测序。
1.3.4 不同组织CD63基因表达特性分析 以18S rRNA为内参基因,采用qRT-PCR技术对马身猪各组织CD63的表达谱进行分析。qRT-PCR反应总体积为20 μL:上、下游引物(10 μmol·L-1)各0.3 μL,cDNA 2 μL,2×SYBR Premix Ex Taq II 10 μL,RNAase Free ddH2O补至20 μL。反应程序参照SYBR Premix Ex Taq II说明书:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,45个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s制作熔解曲线。每个样本技术重复3次。
1.3.5 CD63的生物信息学分析 测序结果采用DNAMAN软件进行序列比对及拼接;运用NCBI在线软件(https://www.ncbi.nlm.nih.gov/orffinder/)和(https://www. ncbi.nlm.nih.gov/Structure/cdd/ wrpsb.cgi)分析CD63基因的开放阅读框并预测CD63蛋白保守结构域;应用PortScale(https://web.expasy.org/protscale/)和ProtParam(http://web.expasy.org/protparam/)软件对猪CD63的理化性质进行预测;采用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)在线预测磷酸化位点;应用NetNGlyc 1.0在线软件(http://www.cbs.dtu.dk/services/NetNGlyc/和http://www.cbs.dtu.dk/services/DictyOGlyc)分别预测其N-糖基化位点和O-糖基化位点;运用德泰生物在线软件(http://www.detaibio.com/tools/signal-peptide.html和http://www.detaibio. com/tools/transmembrane.html)对CD63的信号肽和跨膜结构域进行预测;同时应用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和PredictProtein(http://www.predictprotein.org/)对猪CD63蛋白质的二级结构进行预测;应用Phyre 2.0软件(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对猪CD63蛋白的三级结构进行预测;用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE _TYPE=BlastSearch&LINK_LOC=blasthome)软件比较猪、人、牛、摩弗伦羊、羊驼、野骆驼、家猫、抹香鲸、北大西洋小须鲸、长江江豚等12个物种CD63蛋白氨基酸序列的相似性;采用MEGA X软件构建上述物种基于CD63氨基酸序列的进化树。
1.4 数据分析
应用2-△△CT法分析qRT-PCR检测结果,结果以平均值±标准误表示。采用SPSS version 22.0软件的单因素方差分析方法比较CD63基因在不同组织间的表达差异,用Duncan's法进行多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 猪CD63基因CDS区的克隆及序列分析
NCBI数据库中猪CD63基因序列为预测序列,本试验中未能一次性成功扩增出该基因的完整CDS区序列,所以采用分段扩增,再进行拼接并结合与预测序列比对的方法,共获得长度为838 bp的片段,该序列已上传至NCBI数据库,GenBank登录号为MN082631。图1中各片段产物的大小与预期结果一致。运用NCBI上的开放阅读框查找器分析本研究获得的猪CD63基因序列,发现其含有一个长714 bp的ORF,共编码237个氨基酸(图2B)。
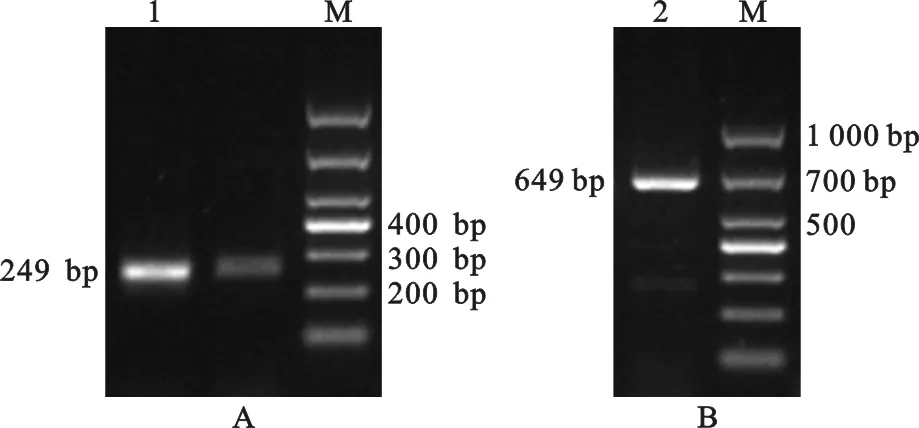
图1 引物P1(A)及P2(B)的扩增结果 1,2. PCR产物;M. DL1 000 DNA MarkerFig. 1 Amplification results of primer P1 (A) and P2 (B) 1,2. PCR products;M. DL 1 000 DNA Marker

图2 序列拼接结果(A)及预测的蛋白质序列(B)Fig. 2 Sequence assembly result (A) and the predicted protein sequence (B)
2.2 猪CD63基因在不同组织中的表达谱
由图3可以看出,CD63在各组织中均有表达,且在不同组织间表达量具有差异,在脂肪组织中表达量最高,其次是肝脏、肌肉、脾脏和心脏等组织,在肾脏中表达量最低。
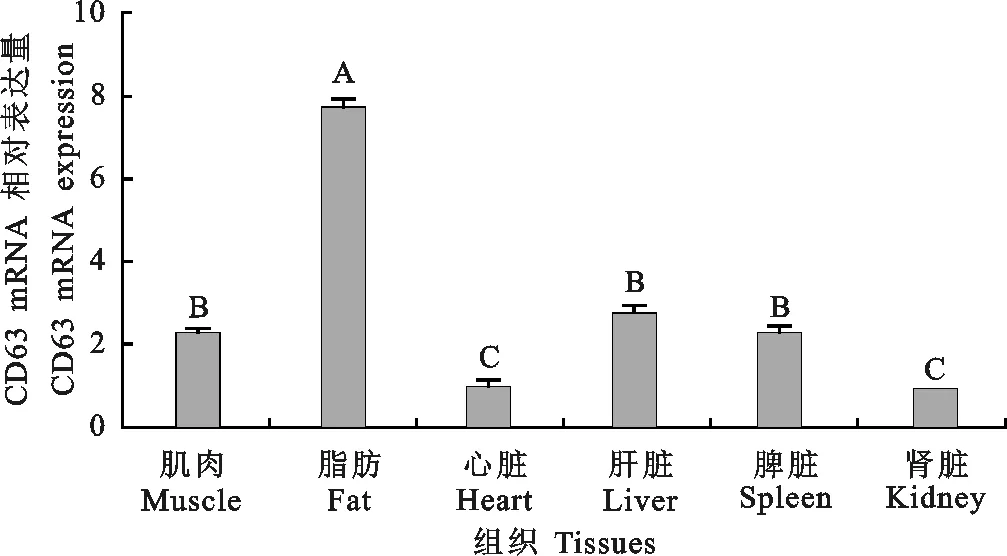
图3 马身猪不同组织CD63基因的表达量 不同大写字母表示差异极显著(P<0.01)Fig. 3 Expression patterns of CD63 in different tissues of Mashen pig Different uppercase letters indicate highly significant difference(P<0.01)
2.3 猪CD63的生物信息学分析
2.3.1 CD63理化性质分析 用ProtParam软件对CD63的理化性质进行了预测,结果表明CD63由237个氨基酸组成,其分子式为C1171H1855N297O315S22,相对分子质量为25 839.73,理论等电点(PI)为7.40,说明猪CD63由中性氨基酸组成;其中Val(12.7%)、Ala(10.5%)、Leu(10.5%)、Gly(7.2%)、Cys(6.3%)和Phe(5.9%)为主要氨基酸;CD63蛋白带负电荷的残基数(Asp+Glu)为17,带正电荷的残基数(Arg+Lys)为18;其消光系数(mol·L-1·cm-1·γ=280 nm)为26 315,不稳定系数为24.07,并预测其在哺乳动物红细胞中的半衰期为30 h,说明CD63蛋白较稳定;脂肪族氨基酸指数为113.08,平均亲水性为0.716。疏水性分析结果显示,CD63蛋白的最小疏水性指数为-2.744(Position:128),最大疏水性指数为3.267(Position:56),为疏水性蛋白(图4)。
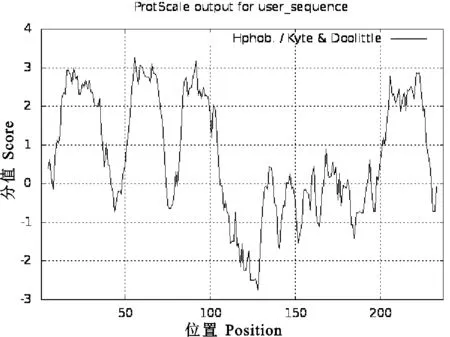
图4 猪CD63蛋白疏水性分析Fig. 4 Hydrophobicity analysis of pig CD63 protein
信号肽和跨膜区域(图5)及保守结构域(图6)预测结果表明,CD63氨基酸序列不含信号肽,但是含有4次跨膜结构(13~35,50~72,85~107,205~227),N-和C-末端都位于膜的细胞内侧,其功能域预测与结构域预测相一致。CD63糖基化位点预测结果显示(图7),CD63有3个可能的N-糖基化位点,发生在“Asn-X-Ser/Thr”(X是除脯氨酸外的任一氨基酸,Asn为天冬酰胺,Ser为丝氨酸,Thr为苏氨酸)的Asn残基上,其中2个位点位于第3个与第4个跨膜结构域之间的胞外区内,另一个在第1个与第2个跨膜结构域之间的胞外区内,但没有发现O-连糖基化位点。磷酸化预测结果显示(图8),Ser磷酸化位点有6个,分别位于第51、91、160、167、196和232位;Thr磷酸化位点有4个,分别位于第44、48、75和152位;Tyr磷酸化位点有1个,位于第80位。
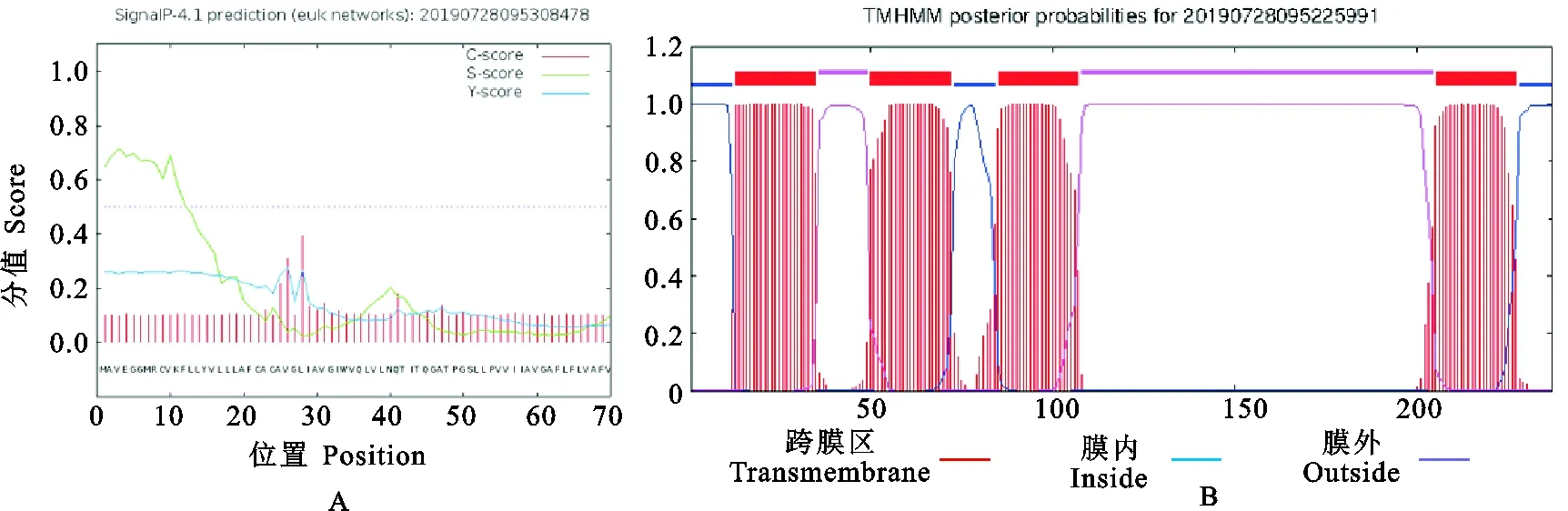
图5 猪CD63蛋白的信号肽(A)和跨膜结构域(B)预测Fig. 5 Prediction of signal peptide (A) and transmembrane domain (B) of pig CD63 protein
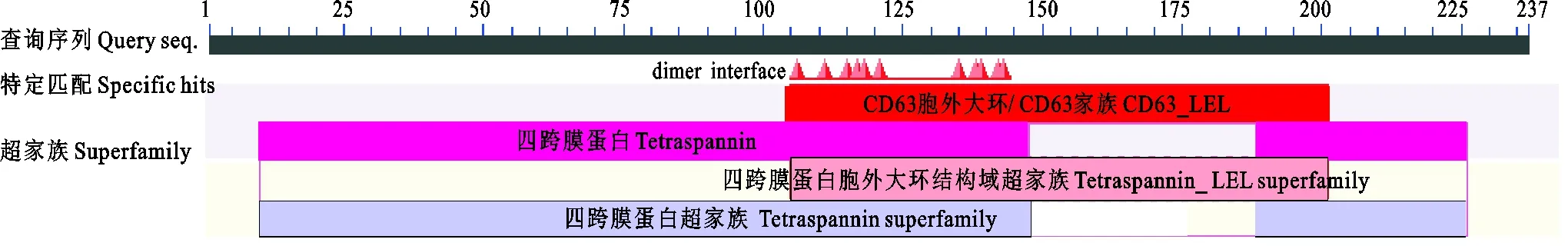
图6 猪CD63蛋白保守结构域分析Fig. 6 Conservative domain analysis of pig CD63 protein
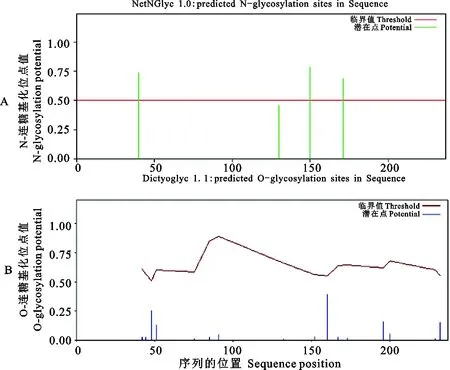
图7 猪CD63蛋白N-连糖基化位点和O-连糖基化位点预测Fig. 7 Prediction of N-linked glycosylation site and O-linked glycosylation site of pig CD63 protein
2.3.2 猪CD63蛋白高级结构预测 同时应用PredictProtein和SOPMA软件对猪CD63蛋白质的二级结构进行预测,结果如图9所示。CD63的二级结构主要由α-螺旋(h)、延伸(e)、β-折叠(t)和无规则卷曲(c)组成,分别占58.23%、11.39%、5.49%和24.89%;采用Phyre2.0软件预测CD63蛋白三级结构(图10),发现猪CD63均存在α-螺旋、β-折叠和disordred区域。
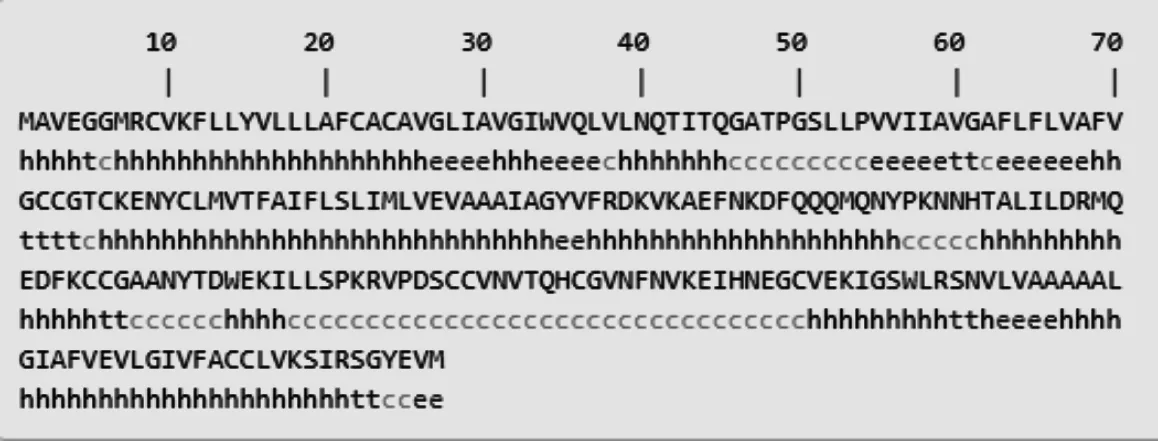
图9 猪CD63蛋白二级结构预测Fig. 9 Prediction of secondary structure of porcine CD63 protein sequences
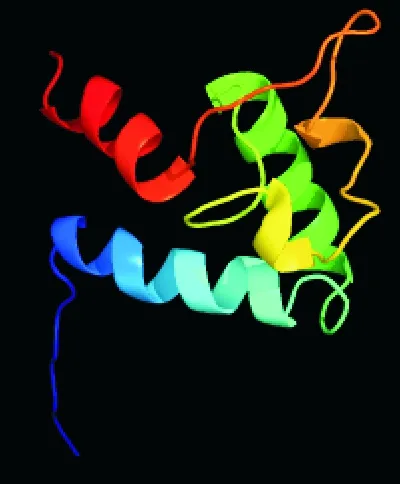
图10 猪CD63蛋白三级结构预测Fig. 10 Prediction of tertiary structure of porcine CD63 protein
2.3.3 不同物种CD63氨基酸序列进化树的构建 本研究获得的马身猪CD63氨基酸与野猪序列一致,用NCBI BLAST比较包括野猪、人、牛、长江江豚、摩弗伦羊等在内的12个物种CD63氨基酸序列的相似性,结果表明猪的CD63与野骆驼的相似性最高,达90.72%;其次是羊驼、长江江豚、抹香鲸,相似性均达到90.30%。采用MAGE X软件的邻接法构建这12个物种的进化树,如图11所示,猪CD63与骆驼科的野骆驼和羊驼聚为一个分支,与鲸类和长江江豚较近,与其他5个物种的亲缘关系比较远,说明猪CD63可能与骆驼科间具有相似的功能。
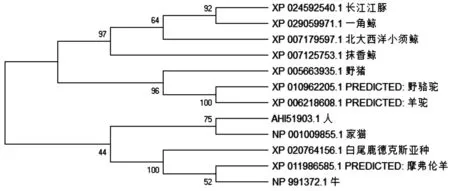
图11 12个物种CD63蛋白系统进化树Fig. 11 CD63 protein system phylogenetic tree of 12 species
3 讨 论
CD63作为四跨膜蛋白家族的表面膜蛋白之一,可通过4个跨膜结构域穿过质膜,表明这些结构域可能参与某些细胞类型的信号转导[20]。CD63已被定性为多种细胞类型的激活或分化标记,并且已知在细胞膜中与β1整合素、主要组织相容性复合抗原和其他四跨膜蛋白紧密结合[21-23]。本研究中对猪CD63理化性质和结构预测,与前人结果一致[16]。马身猪的CD63是一种比较稳定的典型的4次跨膜蛋白,两个胞外域分别与对应的配体结合,其N末端和C末端均位于细胞内,与骨架蛋白及胞内信号分子结合参与信号转导。本研究中CD63蛋白消光系数为26 315,理论等电点(PI)为7.40,不稳定系数为24.07,最小疏水性指数为-2.744(Position:128),最大疏水性指数为3.267(Position:56),属于中性稳定疏水蛋白,与在七鳃鳗中的研究结果相同[24]。通过相似性比对发现,猪CD63与野骆驼的相似性最高,达90.72%,其次是羊驼、长江江豚、抹香鲸等,相似性均达到90.30%。系统发育树表明,相较于哺乳动物来说,猪的CD63与骆驼科的羊驼和野骆驼亲缘关系最近,其次是与鲸类和长江江豚的遗传距离较近,符合物种进化规律。
CD63在免疫应答中发挥重要作用,除了CD63-MHC-II类复合物,在白细胞募集、吞噬及过敏等免疫反应中均具有重要地位。内皮细胞表面的CD63能与P型选择素相互作用调控白细胞的募集过程[25]。作为攻击入侵病原体的主要细胞介导的防御机制,吞噬作用在哺乳动物的先天免疫反应中起重要作用。CD63在细胞内吞和吞噬作用中起关键作用,有报道称在人类树突状细胞中,CD63内化的同时伴随着酿酒酵母的吞噬[26];Yu等[27]揭示了CD63在促进血细胞介导的吞噬作用中的确切作用。在过敏反应中,CD63可在特异性免疫球蛋白IgE介导的肥大细胞脱粒中起重要作用。Kraft等[28]研究表明,可将CD63作为过敏反应的重要组分,发现敲除CD63基因可显著降低肥大细胞脱粒,从而减少体内的急性过敏反应。本研究中,CD63基因在马身猪的脂肪、肝脏、肌肉和脾脏的表达量较高,在心脏和肾脏中表达量较低,该结果与鲈鱼和斑点叉尾鮰的表达结果类似[16,29],均在肝脏和肌肉中表达较高。脂肪组织除了可以储存脂肪外,还具有免疫调节功能。作为免疫器官[30],脂肪组织中的T细胞是免疫代谢的关键因素[31],CD63基因在脂肪组织中高表达,是因为脂肪组织中已鉴定出多种免疫细胞,包括B细胞,T细胞,巨噬细胞和嗜中性粒细胞,而CD63在这些细胞表面均表达。马身猪的肌内脂肪含量较高[32],导致CD63在肌肉中的表达量也较高。此外肝脏可以选择性富集自然杀伤细胞和杀伤性T细胞[33],因此推测CD63基因在免疫器官脂肪组织、脾脏和肝脏中高表达,可能参与相关免疫调控,其作用机制有待进一步研究。
4 结 论
本研究成功获得了马身猪CD63基因的CDS区序列(MN082631),全长714 bp,编码237个氨基酸。生物信息学分析表明,CD63与骆驼科的羊驼和野骆驼同源性较高,为中性、亲水、稳定型四跨膜蛋白,二、三级结构预测显示,该蛋白主要以α-螺旋和无规卷曲为主。该基因在所有组织中均有表达,在脂肪组织中的表达量最高,其次是肝脏、肌肉和脾脏。本研究结果为深入探讨CD63基因的结构和功能提供了参考。

