双氢青蒿素通过ERK12和P38途径抑制缝合诱导的大鼠角膜新生血管形成
徐家窈 刘红山 郑海生 刘俐娜
(中山大学中山眼科中心海南眼科医院 海南省眼科学重点实验室,海南 海口 570311)
正常角膜透明,无血管,但在炎症、外伤、感染、缺氧等条件下,角膜缘血管网将增殖形成角膜新生血管(CNV)〔1〕。虽然CNV促进伤口愈合修复,减轻感染,但其结构和功能不完善,容易发生血浆渗漏,造成脂质沉着、角膜水肿及激发的角膜瘢痕化,这些会影响角膜透明度及后续治疗效果〔2〕,显然CNV弊大于利。生理情况下,促血管生成因子和抑血管生成因子在正常角膜组织中维持动态平衡,而当角膜处于病理情况下,二者平衡被打破,从而产生病理性CNV〔3〕。双氢青蒿素(DHA)是青蒿素的一种衍生物,为青蒿素、蒿甲醚、青蒿琥酯的体内活性形式,具有毒性弱,生物作用强的特点,同时DHA对肿瘤细胞增殖和新生血管形成也有良好抑制效果〔4〕,但是对CNV是否有抑制作用还未见报道,本研究旨在探讨DHA对CNV的抑制效果。
1 材料与方法
1.1主要试剂及仪器 DHA(美国Sigma公司);血管内皮生长因子(VEGF)、p-血管内皮生长因子受体(VEGFR)-2、p-细胞外调节蛋白激酶(ERK)1/2、p-P38、CD31抗体(美国Abc公司);4′,6-二脒基-2-苯基吲哚(DAPI)染色液(江苏碧云天生物科技有限公司);二喹啉甲酸(BCA)蛋白定量试剂盒(北京索莱宝);显微手术器械(上海医疗器械);荧光显微镜(日本 Nikon公司),眼科显微镜(日本Olympus公司);Trizol 核酸蛋白提取试剂(美国Invitrogen公司);病理切片机及包埋机(德国 Leica 公司)。
1.2模型制备 32只SD大鼠,体重150~180 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0002,单位使用许可证编号:SYXK(琼)2016-0021。所有大鼠使用裂隙灯显微镜仔细检查眼角膜,有任何缺陷或CNV的大鼠将被排除。用10%水合氯醛腹腔注射(4 ml/kg)全身麻醉,然后用5 g/L丁卡因进行眼表麻醉,在大鼠左眼距离角缘2 mm处颞侧使用10-0的手术缝线缝四根线,术后用0.3%氧氟沙星滴眼液,3次/d,持续3 d,以降低感染风险。
1.3实验分组 32只大鼠随机分为4组,分别为对照(NS)组、5 mg/L DHA组、10 mg/L DHA组和20 mg/L DHA组,每组8只。各浓度DHA组分别用指定浓度的DHA溶液(生理盐水稀释)进行局部治疗,4次/d,而对照组用生理盐水滴眼液治疗,每天用裂隙灯显微镜观察角膜变化,共7 d。第7天用图像处理软件Image-Pro Plus6.0处理图像,计算角膜中新生血管面积。
1.4免疫荧光染色法观察大鼠角膜p-ERK1/2、p-P38、CD31表达 第7天处死大鼠,取下角膜后于4%多聚甲醛中固定20 min,石蜡包埋切片,厚度5 μm,切片用二甲苯和乙醇脱蜡,经磷酸盐缓冲液(PBS)洗涤,0.25%胰酶孵育20 min,PBS洗涤,然后室温下10%山羊血清孵育30 min,p-ERK1/2、p-P38、CD31 抗体4℃下孵育过夜,使用Cy3标记山羊抗兔免疫球蛋白(IgG)的荧光二抗(1∶200)室温孵育1 h,洗涤玻片,采用DAPI孵育5 min后,立即置于荧光生物显微镜下照相,分析观察CNV。显微镜下观察p-ERK 1/2、p-P38和CD31蛋白阳性染色结果,利用光密度值进行半定量分析。
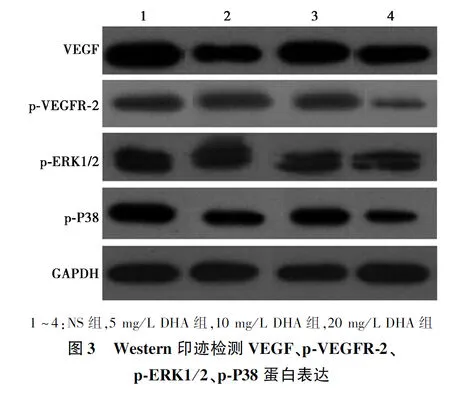
1.5Western印迹检测ERK1/2、P38通路相关因子表达 第7天处死大鼠,取下角膜匀浆,14 000 r/min离心5 min,完成后取上清,BCA法进行蛋白初定量,-80℃分装保存。将提取的蛋白样品按 20 μg/孔依次上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后将蛋白转印至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭1 h后,加入VEGF、p-VEGFR-2、p-ERK1/2、p-P38抗体,在 4℃ 冰箱中孵育过夜,然后在辣根过氧化物酶标记的二抗作用中孵育 1 h。用二氨基联苯胺(DAB)显影,扫描拍照。
1.6统计学方法 采用SPSS17.0 软件进行t检验、单因素方差分析。
2 结 论
2.1DHA对缝合诱导CNV的抑制作用 NS组不仅覆盖缝合部位,甚至达角膜中心,而各浓度DHA组在治疗7 d后角膜中发现的血管数逐渐减少,呈浓度依赖性,见图1;NS组、5、10、20 mg/L DHA组CNV面积比例分别为(23.74±3.00)%、(23.38±2.79)%、(19.53±2.42)%、(15.73±2.88)%,与NS组相比,10、20 mg/L DHA组CNV的抑制作用均显著增加(P<0.05)。
2.2免疫荧光法检测p-ERK1/2、p-P38和CD31表达 p-ERK1/2、p-P38和 CD31 蛋白主要在角膜上皮和基质层中表达,p-ERK1/2 和p-P38阳性表达呈绿色,CD31阳性表达呈红色,见图2。NS组p-ERK1/2、p-P38和CD31免疫荧光光密度值分别为(156.78±30.02)、(97.43±26.10)、(73.20±33.28),20 mg/L DHA 组分别为(44.78±7.03)、(30.18±7.28)、(19.34±4.21),组间比较均有统计学差异(P<0.05)。


2.3Western印迹检测VEGF、p-VEGFR-2、p-ERK1/2、p-P38表达 与NS组相比,20 mg/L DHA组VEGF、p-VEGFR-2表达显著下降(P<0.05);而5、10 mg/L DHA组无明显差异(P>0.05)。与NS组相比,10、20 mg/L DHA组p-ERK1/2、p-P38表达显著下降(P<0.05);而5 mg/L DHA组无明显差异(P>0.05)。见表1,图3。
3 讨 论
CNV严重威胁视力,甚至导致失明〔5〕。在新生血管形成的众多学说中,多数学者倾向于细胞因子学说,即认为新生血管刺激因子的过度表达或抑制因子的不足是CNV发生的基础〔6〕。其中VEGF是已经发现的促血管新生作用最强的因子,VEGF通过激活其特异性受体,介导早期的血管新生,在CNV的形成过程中起重要作用〔7〕。DHA有抗疟疾,下调VEGF表达的作用〔8〕。
VEGF能促进内皮细胞分裂增殖,促使新生血管生成〔9〕。VEGF这一功能是通过与其特异性受体结合来发挥作用,而VEGFR2是VEGF的主要受体,VEGF与其结合后,VEGFR发生二聚体化,形成同源二聚体或异源二聚体,进一步激活下游信号通路〔10〕。本研究结果说明20 mg/L DHA促进VEGF、p-VEGFR-2表达急剧下降,提示DHA可能通过抑制这一途径降低CNV,而20 mg/L和10 mg/L DHA对CNV也有抑制作用,因此推测DHA的抑制能力呈剂量依赖性,但可能还有其他因素导致CNV抑制。
CD31特异性表达于血管内皮细胞中,相对于其他内皮细胞标记,CD31更能精确反映血管数量〔11〕;丝裂原活化蛋白激酶(MAPK)主要分为3个亚族:ERK1/2、JNK、p38,它们参与多种细胞功能的调控,尤其在细胞增殖、分化及凋亡过程中,是多种信号转导途径的共同作用部位。文献报道,抑制ERK1/2 信号通路可以抑制血管平滑肌细胞(VSMCs)的增殖迁移〔12〕;p38经外界刺激而激活,引起细胞内蛋白激酶的连锁反应,参与细胞周期调控并且在细胞分化中起着重要作用〔13〕。ERK1/2和P38是VEGF信号转导的两个主要下游蛋白〔14〕。研究表明,VEGF受体的激活会促进ERK1/2蛋白活化〔15〕。VEGF还能激活P38通路引起细胞有丝分裂及细胞迁移〔16〕。本研究结果说明经DHA治疗降低了ERK1/2、P38的磷酸化。此外,P38还是炎症细胞因子表达的关键调节因子,在炎症过程中发挥了非常重要的作用。实验中CNV模型基于缝线会继发角膜炎症,因此DHA也可能通过P38途径降低炎性细胞因子的表达抑制CNV。

