橙皮素对小鼠皮肤急性光损伤的保护作用
卢倩,卢志禹,程雨欣,夏青月,骆丹
(南京医科大学第一附属医院,江苏 南京 210000)
皮肤作为人体的首道屏障,易受各种物理、化学 等外源性刺激影响,造成皮肤损伤,甚至进一步发展为皮肤癌。紫外线是最主要的外源性刺激之一[13],中波紫外线(UVB)可达表皮及真皮浅层,在短时间内即可导致皮肤的红肿破溃等,造成皮肤急性光损伤。紫外线参与皮肤急性光损伤的主要机制涉及氧化应激、细胞凋亡、DNA损伤、炎性反应等。研究表明,大剂量UVB照射后,可诱导表皮产生过量的活性氧(ROS),从而启动多条氧化应激通路,导致组织损伤[29]。然而,皮肤自身对这种急性损伤有一定的防御机制,如一些氧化还原酶,超氧化物歧化酶(SOD)、过氧化氢酶、谷胱甘肽还原酶和谷胱甘肽过氧化物酶等,或非酶的抗氧化物,维生素E、谷胱甘肽等[6]的作用。核因子E2相关因子2(Nrf2)通路作为主要的内源性抗氧化信号通路之一,会影响上述抗氧化物的活性,从而发挥抵抗氧化应激反应的作用[14]。
已有研究表明抗氧化剂外用能够减轻皮肤损伤,但目前的抗氧化剂普遍存在皮肤刺激性强、稳定性差的问题。因此,开发安全有效的新型外用药物,来预防紫外线导致的皮肤损伤是目前研究的热点[18]。黄酮是一类提取自天然植物的多酚类化合物[2],有抗氧化、抗炎、免疫调节等多种作用。近年来,黄酮类化合物,例如芹菜素[26]、槲皮素[25]、柚皮素[27]等在减轻皮肤光损伤中的作用已有广泛研究。橙皮素是一种提取自柑橘类水果的天然黄酮提取物,有抗肿瘤[8]、抗病毒[9]、抗炎[10]等多种强大的生物活性。Li等[21]研究了橙皮素对二氧化硅所致的大鼠肺损伤的保护作用,结果发现,予橙皮素灌胃的大鼠暴露于二氧化硅后肺部组织炎性反应浸润较对照组减轻,总抗氧化能力及SOD、过氧化氢酶、谷胱甘肽过氧化物酶的活性增加。白细胞介素-1β(IL-1β)、IL-4、肿瘤坏死因子-α(TNF-α)的产生减少。但橙皮素在皮肤光损伤中的作用目前尚无报道。
本研究拟在建立小鼠的皮肤急性光损伤模型的基础上,探讨橙皮素对小鼠皮肤急性光损伤的保护作用及可能机制。
1 材料与方法
1.1 实验动物和材料 选取雌性健康无特定病原体(SPF)级 balb/c小鼠 50 只,体质量(20±2)g,鼠龄6~8周,购于南京医科大学实验动物基地。饲养于SPF级动物房内,适应性饲养1周后,进行实验。本实验由南京医科大学动物伦理委员会批准。UVB台式紫外线光疗仪,购自上海SIGMA公司;橙皮素购自上海源叶生物科技有限公司;OCT包埋剂、磷酸盐缓冲液(PBS)、ROS 染液、4',6-二脒基-2-苯基吲哚(DAPI)、自发荧光淬灭剂、抗荧光淬灭封片剂、柠檬酸(pH6.0)抗原修复液、BSA、Nrf2抗体、HRP 标记山羊抗兔均购自武汉赛维尔科技有限公司;SOD测试试剂盒(WST-1法)和丙二醛(MDA)测定试剂盒(TBA法)购自南京建成生物工程研究所;RNA提取试剂盒购自诺唯赞生物科技股份有限公司;Kelch样环氧氯丙烷相关蛋白-1(Keap1)抗体、羊抗小鼠IgG-HRP购自中国Proteintech公司。血红素氧合酶(HO-1)、β-actin抗体购自美国CST公司。羊抗兔IgG-HRP购自美国Jackson Immuno Research。引物序列由广州剪刀手基因有限公司合成。
1.2 方法
1.2.1 制备基质及橙皮素乳膏 将100 mg硬脂酸、100 mg白凡士林、20 mg甘油硬脂酸酯、15 mg司盘60置于烧杯,加热至80℃,充分溶解,制成油相,518 mg水、100 mg甘油、25 mg吐温-85、2 mg尼泊金甲酯置于另一个烧杯中加热溶解,制成水相,-80℃保温,将油相缓慢加入水相,搅拌,室温冷却。将10 mg橙皮素粉末与水相至于另一烧杯中加热溶解,将相同温度的油相缓慢加入水箱中,不断搅拌,直至乳化完全,室温冷却。
1.2.2 构建小鼠光损伤模型 小鼠光损伤构建参考文献[7],将光疗仪置于暗处,照射距离为15 cm,用刀片刮去小鼠背部的皮肤,再用脱毛膏进行2次脱毛。将用于构建模型的10只小鼠随机分为5组,分别予 UVB 单次总剂量 0、180、360、720、1 080 mJ/cm2,按照UVB剂量=UVB辐照度×时间(s)计算,即辐照度3.6 mJ/(cm2·s)照射0、50、100、200、300 s,连续照射3 d。观察小鼠背部皮肤变化及组织学改变,确定最佳照射剂量。随机将40只小鼠分为4组,分别为空白组(未经UVB照射和任何处理)、UVB组(未经药物处理)、基质+UVB组(背部均匀涂抹基质乳膏)、橙皮素+UVB组(背部均匀涂抹橙皮素乳膏),每组各10只,除空白组外,每组以最佳剂量照射1次/d,连续照射3 d,照射前30 min涂抹乳膏,每天观察并记录小鼠背部皮肤状况。
1.2.3 小鼠皮肤光损伤的大体观和组织学形态学观察 小鼠末次照射结束24 h后,采用异氟烷麻醉后头颈部脱臼的方式处死,取照射部位0.5 cm×0.5 cm皮肤,用多聚甲醛固定,二甲苯透明,乙醇脱水,常规石蜡包埋,制成切片后进行HE染色,皮肤组织病理观察。
1.2.4 免疫荧光法检测ROS水平 组化笔圈出各组冰冻切片上的皮肤组织,加入自发荧光淬灭剂5 min,流水冲洗10 min。圈内滴加PBS稀释后的ROS染液(稀释比例1∶200),避光37℃恒温孵育30 min。玻片置于PBS(pH7.4)中,在脱色摇床上晃动洗涤3次,5 min/次。切片稍甩干后在圈内滴加DAPI染液,避光室温孵育10 min。再次用PBS洗涤3次,5 min/次。稍甩干后用抗荧光淬灭封片剂封片。切片于正置荧光显微镜下观察并采集图像。Image J软件分析荧光强度值。
1.2.5 WST-1法测定SOD活力、TBA法测定MDA水平 将各组小鼠背部皮肤组织在冰冷的生理盐水中漂洗,除去血液并用滤纸擦干,天平称重后放入烧杯。取组织9倍重量的生理盐水于烧杯中,眼科剪剪碎组织块,低温研磨仪研磨,连续7次循环,低温离心机2000转/min离心15min(半径为10cm),取上清液,按照试剂盒说明书操作,测定小鼠皮肤组织中SOD活性和MDA水平。
1.2.6 实时荧光聚合酶链反应(RT-PCR)检测Nrf2 mRNA、Keap1 mRNA、HO-1 mRNA水平 各组小鼠分别取约20 mg组织样本于500 μL Buffer RL中,冰冻研磨仪研磨至无颗粒透明状溶液,按试剂盒操作提取RNA。测定RNA浓度与纯度后逆转录为cDNA。RT-PCR检测各mRNA水平,每个样本设计3个复孔,并进行3次生物学重复。各基因引物如下:Nrf2上游引物:5'-CTGAACTCCTGGACGGGACTA-3',下游引物 :5'-CGGTGGGTCTCCGTAA ATGG-3';Keap1上游引物:5'-TCGAAGGCATCCACCCTAAG-3',下游引物:5'-CTCGAAC CACGCTGTCAATCT-3';HO-1上游引物:5'-CACAGCACTATGTAAAGCGTCT5'-3',下游引物:5'-GTAGCGGGTATATGCGTGGG-3'。
1.2.7 免疫组化检测Nrf2蛋白表达 石蜡切片脱蜡至水,抗原修复后晃动洗涤,放入3%双氧水溶液室温避光孵育25 min。晃动洗涤,用血清封闭后滴加一抗,放于湿盒内4℃孵育过夜。次日洗涤后滴加二抗,室温孵育50 min,晃动洗涤,滴加DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色,苏木素复染3 min后水洗,再用苏木素返蓝液返蓝,流水冲洗并脱水封片。处理后的切片至显微镜观察,采集图像并分析。
1.2.8 蛋白质印迹法(Western blotting,WB)检测Keap1、HO-1蛋白表达水平 各组小鼠分别取约20 mg组织样本于300 μL蛋白裂解液,冰冻研磨仪研磨至无颗粒透明状溶液。离心后,取上清液,并且用BCA法测定蛋白浓度。加入适量蒸馏水,将样本浓度调成一致,加入1/4总体积的5×SDS loading buffe后混匀。制备十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)胶,吸取 20 μL体积样品加入泳道,凝胶电泳、转膜,取膜后,4℃环境下在5%脱脂牛奶中固定封闭膜1 h。将膜放入按比例稀释的一抗后,4℃孵育过夜,再使用洗膜缓冲液(TBST)洗膜,再放入按比例稀释的二抗,室温孵育1 h。再次用TBST洗膜。ECL显影液显影,置于凝胶成像仪上,观察目的蛋白与对应内参的灰度值,并定量分析蛋白表达情况。
1.3 统计学分析 采用GraphPad Prism 8.0统计软件。计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 UVB照射诱导小鼠皮肤光损伤模型的构建 经0、50、100、200、300 s照射后,各组小鼠皮肤外观出现不同程度的改变。经UVB照射50 s后,小鼠皮肤外观基本正常,无红斑及鳞屑。经UVB照射100 s后,背部中下部皮肤出现红斑,不伴鳞屑。经50 s照射后,小鼠背部皮肤出现红斑及少量鳞屑。经100 s UVB照射后,背部出现红斑及大量鳞屑。
UVB照射50 s组小鼠皮肤可见表皮组织仍结构清晰,较空白组无明显变化,真皮浅层少量炎性细胞浸润,胶原纤维基本正常。100 s照射组小鼠皮肤可见轻度角化过度,胶原纤维轻度增粗红染,真皮浅层中量炎性细胞浸润。200 s照射组小鼠角质层缺如,角化过度,表皮细胞间水肿,真皮浅层可见血管扩张,大量以淋巴细胞为主的炎性细胞浸润,胶原纤维轻度增粗。300 s照射组小鼠表皮角化过度,真皮浅层见血管扩张,大量淋巴细胞浸润,胶原纤维增粗,排列紊乱,见图1。
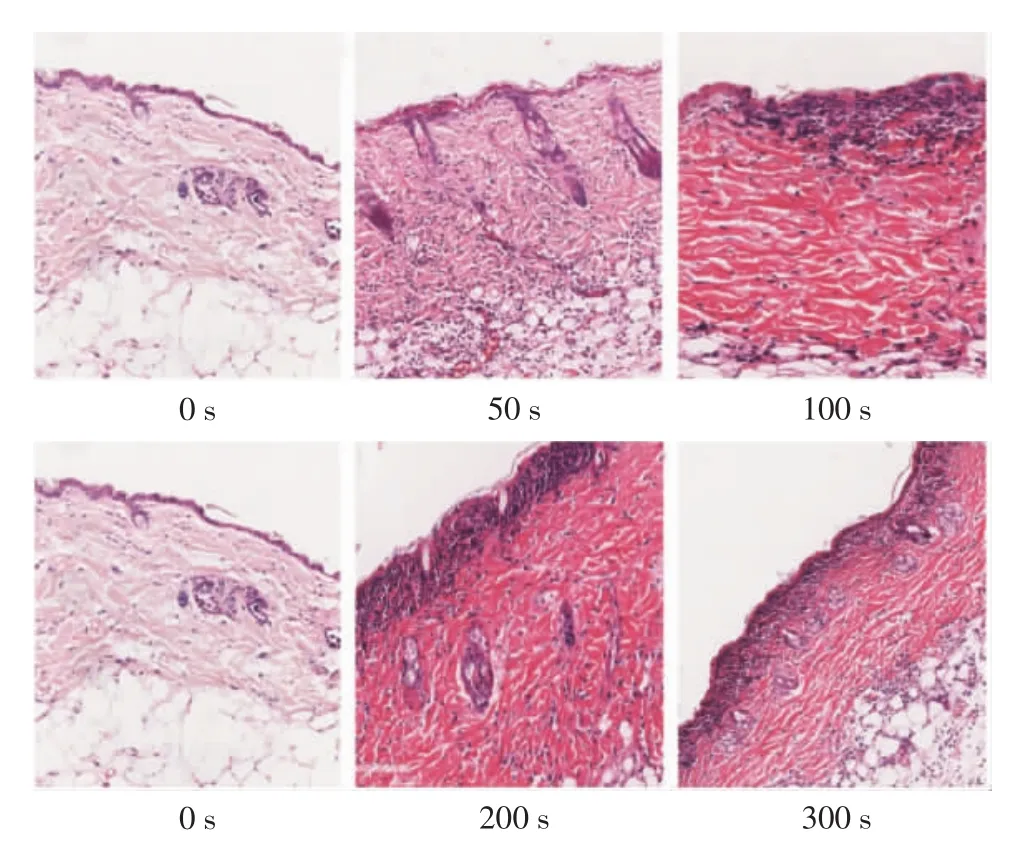
图1 不同照射剂量下小鼠皮肤组织病理学表现(HE染色×100)
2.2 橙皮素对UVB诱导的急性光损伤小鼠皮肤外观及组织形态的影响 皮肤出现红斑脱屑是急性光损伤的重要表观学改变,而表皮角化过度,真皮浅层血管扩张、炎性细胞浸润是急性光损伤的重要病理表现。见表1、图2,橙皮素+UVB组小鼠皮肤炎性反应及损伤程度较UVB组和基质+UVB组明显减轻。

表1 各组小鼠皮肤外观及组织病理表现
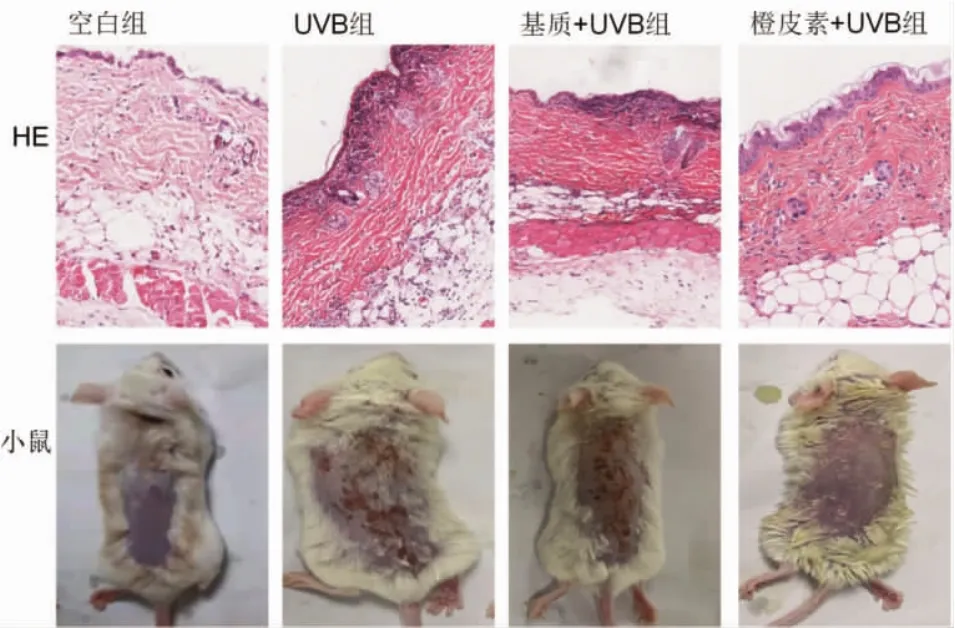
图2 各组小鼠皮肤外观及组织病理表现
2.3 橙皮素减少UVB诱导的急性光损伤小鼠皮肤组织中的ROS水平 ROS是氧化应激发生的始动因子,可以诱导细胞凋亡甚至导致其坏死。UVB照射后,UVB组和基质+UVB组ROS水平与空白组相较明显升高,差异有统计学意义(P<0.05)。基质+UVB组ROS水平较UVB组降低,但差异无统计学意义(P>0.05)。橙皮素+UVB组ROS水平与UVB组和基质+UVB组比较明显降低,差异有统计学意义(P<0.05),见图3。

图3 各组小鼠皮肤组织ROS水平
2.4 橙皮素对UVB诱导的急性光损伤小鼠皮肤组织中SOD和MDA表达水平的影响 SOD是重要的抗氧化酶,可以反应机体清除氧自由基的能力,而MDA作为脂质过氧化的产物,可以反应其损伤程度。外用橙皮素后,小鼠皮肤组织SOD活力明显提高,MDA水平显著下降,且差异与UVB组和基质+UVB组相较均有统计学意义(P<0.05),见表2。提示外用橙皮素乳膏后,小鼠皮肤组织的抗氧化能力显著提高,且组织受损的程度明显降低。
表2 各组小鼠SOD、MDA表达水平比较 (±s)

表2 各组小鼠SOD、MDA表达水平比较 (±s)
注:与空白组比较,*P<0.05;与 UVB 组比较,#P<0.05;与基质+UVB 组比较,△P<0.05。
组别 n S O D(U/m g p r o t) M D A(n m o l/m g p r o t)空白组 6 9.0 7±0.6 4 0.0 5±0.0 0 U V B 组 6 1 6.2 1±0.0 9* 1.9 9±0.2 7*基质+U V B 组 6 2 0.2 1±0.8 1* 1.1 2±0.1 4*橙皮素+U V B 组 6 4 3.9 2±0.1 7*#△ 0.6 1±0.5 3*#△
2.5 橙皮素对UVB诱导的急性光损伤小鼠皮肤组织中Nrf2、Keap1、HO-1的mRNA水平的影响 Nrf2是体内启动抗氧化应激通路的关键转录因子,一般情况下与Keap1结合,存在于胞质中,Nrf2通路被激活后,可促进下游抗氧化酶的表达,其中HO-1发挥重要的抗氧化作用。PCR结果显示,橙皮素+UVB组较UVB组Nrf2、Keap1、HO-1的mRNA水平增加,且差异有统计学意义(P<0.05),见表3。提示橙皮素可能通过Nrf2通路抑制UVB造成的光损伤。
表3 各组小鼠Nrf2 mRNA、HO-1 mRNA、Keap1 mRNA水平比较 (±s)
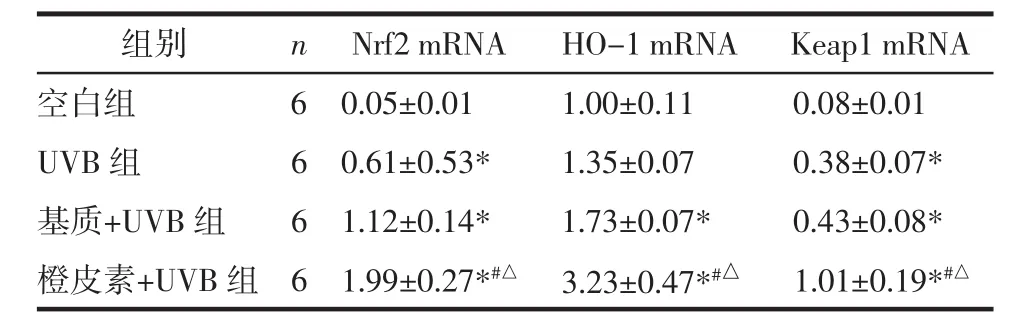
表3 各组小鼠Nrf2 mRNA、HO-1 mRNA、Keap1 mRNA水平比较 (±s)
注:与空白组比较,*P<0.05;与 UVB 组比较,#P<0.05;与基质+UVB 组比较,△P<0.05。
组别 n Nrf2 mRNA HO-1 mRNA Keap1 mRNA空白组 6 0.05±0.01 1.00±0.11 0.08±0.01 UVB 组 6 0.61±0.53* 1.35±0.07 0.38±0.07*基质+UVB 组 6 1.12±0.14* 1.73±0.07* 0.43±0.08*橙皮素+UVB 组 6 1.99±0.27*#△ 3.23±0.47*#△ 1.01±0.19*#△
2.6 橙皮素对UVB诱导的急性光损伤小鼠皮肤组织中Nrf2蛋白表达的影响 UVB照射后表皮细胞核有少量Nrf2蛋白表达;预先使用橙皮素后,细胞核中Nrf2蛋白的表达量明显增加。说明橙皮素能够促进急性光损伤小鼠皮肤组织中Nrf2蛋白表达,见图4。

图4 UVB组与橙皮素+UVB组小鼠皮肤组织的免疫组化(×100)
2.7 橙皮素对UVB诱导的急性光损伤小鼠皮肤组织中Keap1、HO-1蛋白表达的影响 橙皮素+UVB组小鼠Keap1、HO-1表达较UVB组明显增加,且差异有统计学意义(P<0.05),见图5。说明橙皮素能够促进急性光损伤小鼠皮肤组织中Keap1、HO-1的表达。

图5 橙皮素促进急性光损伤小鼠皮肤组织中Keap1、HO-1蛋白表达
3 讨论
紫外线是阳光的重要组成部分,其中UVB可以与DNA直接作用,生成环丁烷嘧啶二聚体,6-4嘧啶光产物等,亦可与内源性色基和光敏剂相互作用,产生ROS,对DNA、蛋白质和脂质造成损伤[24]。因此在日常生活中,保护皮肤免受紫外线过度照射尤为重要。
橙皮素是一种有强大的抗氧化[22]作用的黄酮类化合物,在阿尔兹海默症[10]、慢性阻塞性肺疾病[11]、心肌缺血[12]等与氧化应激相关的疾病中的研究表明,橙皮素可以通过减轻炎性反应、氧化应激等,减轻相关细胞组织的损伤。其生物活性的主要原因是其抗氧化能力,可以穿透磷脂双分子层清除自由基。已有研究发现,在高脂饮食诱导的NAFLD大鼠模型中,给予橙皮素灌胃,橙皮素可通过磷酸肌醇-3激酶/蛋白激酶(PI3K/AKT)-Nrf2-抗氧化反应元件(ARE)通路改善肝脏氧化应激和炎性反应,缓解肝脏脂肪变性和纤维化[23]。
但尚未有关于皮肤急性光损伤的研究。目前已有关于外用含橙皮素和环状溶血磷脂酸钠的血清的单中心临床试验,结果表明外用血清后,角质层水合作用和皮肤弹性有显着改善,有一定的抗衰老作用[19]。且在整个研究期间,并未观察到相关的不良事件,如水肿、脱屑、瘙痒、刺痛或烧灼感等。这一定程度上验证了人体皮肤外用橙皮素的安全性。参考现有外用黄酮类药物的方式[28],选用外用橙皮素乳膏的给药方式,探讨橙皮素对UVB照射诱导的小鼠皮肤组织急性光损伤的影响,本研究中亦未观察到小鼠外用橙皮素后局部皮肤的刺激性反应。
本实验首先通过大剂量照射中波紫外线,诱导小鼠的急性光损伤模型。大剂量UVB照射后,小鼠皮肤出现红斑、皱纹甚至破溃,组织切片HE染色示真皮炎性细胞浸润明显。在此基础上,为探讨橙皮素对UVB诱导的小鼠皮肤光损伤的保护作用。笔者比较了外用橙皮素后小鼠皮肤外观及组织病理改变。结果显示外用橙皮素组的小鼠,皮肤略显粗糙,但表皮完整,亦未见红斑等急性损伤表现,镜下皮肤层次分明,可见少量炎性细胞。这表明橙皮素对于UVB造成的小鼠皮肤急性光损伤有一定的保护作用。
已有研究表明,大剂量UVB照射后,表皮会产生大量ROS,同时机体将启动一系列防御机制抵御氧化损伤,但过多自由基产生超出机体的清除及修复能力时,就会导致蛋白质、DNA和脂质的损伤。SOD[16]是生物系统中细胞抗氧化防御系统的重要酶,能催化和清除超氧阴离子,通过对SOD的活力的检测可以间接反应机体清除氧自由基的能力,而MDA作为膜脂质过氧化的重要产物,则可以反应细胞损伤的程度。本研究发现在大剂量UVB照射后,小鼠皮肤组织ROS水平明显升高,MDA的水平升高,提示UVB诱导小鼠出现急性光损伤。接下来,为探究橙皮素是否可以改善急性光损伤中的氧化应激反应,笔者对外用橙皮素乳膏后照射UVB的小鼠ROS水平进行了检测,发现大量ROS被清除,MDA的水平降低,而SOD的活力明显提高,表明橙皮素有清除氧自由基的潜力和抗氧化活性,减轻UVB造成的氧化应激反应,从而保护皮肤组织。
Nrf2是保护细胞免受氧化损伤的关键转录因子[17],可以与抗氧化原件结合或亲电反应原件结合,从而调控编码抗氧化蛋白的上游区域。在一般情况下,Nrf2与Keap1结合,主要以非活性结构存在于包浆中,而在发生氧化应激作用后Ⅱ相诱导剂引起Keap1的修饰,Nrf2被释放,在细胞核内,与ARE结合,诱导一系列编码解毒酶和抗氧化蛋白的防御基因编码[7]。在Nrf2信号通路被激活后,调控下游靶蛋白,其中HO-1发挥重要的抗氧化作用,不仅阻止游离血红素参与氧化反应,其酶解产物一氧化碳(CO)、胆红素也发挥抗氧化、抗炎的作用[15]。
为探索Nrf2信号通路在橙皮素减轻UVB诱导的急性光损伤中的作用,本研究检测了各组小鼠皮肤Nrf2、Keap1、HO-1的mRNA表达水平,发现外用橙皮素后Nrf2、Keap1、HO-1的 mRNA水平升高,同时Nrf2、Keap1、HO-1蛋白表达增加。提示橙皮素可以促进Nrf2的核移位、转录与表达,从而调控内源性抗氧化系统参与维持氧化还原稳态,从而抑制UVB造成的急性光损伤。
综上所述,本研究通过动物实验证明,以外用橙皮素为给药途径,可以通过激活Nrf2通路,增加下游抗氧化酶的表达,减轻氧化应激反应,从而防御UVB对小鼠皮肤造成的光损伤,这为未来外用光防护剂的研究提供了新的方向。已有研究通过多壁碳纳米管负载橙皮素来干预大鼠脑缺血/再灌注损伤[20],相较于口服常规橙皮素,能够显著降低学习和记忆缺陷、减少脑部梗死面积和MDA水平,提示多壁碳纳米管可以作为一种有前途的新型载体来提高橙皮素的生物利用度和治疗脑损伤。由于本研究以小鼠为模型以及相关技术问题,未来可以进一步探索橙皮素在人皮肤中应用的浓度、剂型等,深入研究其作用机制,并对安全性及有效性进行更全面的评估。

