微生物的交流信号*
程珂珂 曾艳华 蔡中华 何永红 周 进
(清华大学深圳国际研究生院,海洋工程研究院,深圳 518055)
尽管大多数微生物都是单细胞生物,但在自然界中,它们并不是孤立地存在,而是以群落形式栖息于复杂多变的环境中。为了生存与繁殖,处于不同生态位中的微生物与相邻的物种间建立了紧密的联系。这些邻居可能是同种的个体,也可能是异种的成员,甚至是与其共享生态幅的其他生物有机体。通过交流,微生物进行合作、分工、竞争抑或拮抗等复杂的群体行为,进而提高其在环境中的适应能力[1‑2]。
微生物的交流常常因菌株和环境而异,产生的互作可能是互惠互利,也可能是竞争拮抗[3]。但从根本上来说,其交流过程主要包含3 个步骤:a.微生物从周围环境中感知信号;b.由自身信号翻译出所识别的环境状况;c.最后对外部信号做出响应。这种复杂多样的“听—想—做”过程,使微生物能够感应环境的变化,对邻近细胞做出反应,并通过调节自身行为来快速应对周边环境,进而增加种群竞争力,如抗生素的分泌与耐受、生物膜的形成和扩散、毒力因子的产生与趋化运动等[4‑5]。
目前已有大量研究揭示了微生物通过不同的机制进行交流,包括群体感应、扩散分子、胞间接触等。这些交流方式使微生物借助一系列化学信号进行种内、种间或者跨界交流(图1),并以协调群落活动为目的,对种群整体发展具有重要意义[6]。在微生物信息时代,为了更好地剖析微生物的行为,深入理解微生物之间的交流方式是其中的关键。
在分子和化学水平上对微生物的交流语言进行解读,并充分理解其互作过程是一项极具挑战性的任务。微生物学与多组学联用技术的发展,为研究微生物信号及其机制提供了越来越多的分子数据和研究方法。本文总结了目前报道的微生物交流语言,并代表性地介绍了主要信号分子及其在微生物互作中的作用,以期深入认识微生物的信号交流过程,为复杂环境下微生物行为的理解和生态事件的解读提供分子层面的依据。
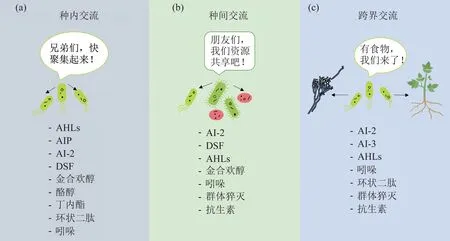
Fig.1 An overview for the signal communication of microorganisms in nature图1 自然界中微生物的信号交流概述
1 群体感应信号
微生物在生长过程中能够通过分泌某些小分子进行相互交流。这些信号分子聚集在细胞周围,并在达到阈值浓度后调节自身种群密度,激活下游功能基因的表达,表现出生物发光、毒性表达、抗生素产生以及生物膜形成等行为[7]。这类信号分子被称为“群体感应(quorum sensing,QS)”信号,是最早被报道的细菌语言之一。它所调节的行为被称为QS,是基于细胞密度建立的级联信号转导过程。至今,已报道了多种细菌的QS 信号分子(表1),且大多数信号分子为约1 000 u的有机小分子或5~20 个氨基酸多肽[15‑16]。革兰氏阴性菌常利用的信号分子是N‑酰基高丝氨酸内酯(N‑Acyl‑L‑homoserine lactones, AHLs 或 autoinducer‑1,AI‑1)、长链脂肪酸、脂肪酸甲酯以及自诱导物II(autoinducer‑2,AI‑2)。AI‑2 也可被一些革兰氏阳性细菌所使用,但通常它们更喜欢利用修饰或环状的肽,如寡肽(autoinducing peptide,AIP)。除细菌外,新近的研究表明,一些致病真菌,如白色念球菌(Candida albicans)也具有QS现象[17],其信号分子主要为醇类化合物。以下分述主要QS信号分子以及它们在微生物交流中发挥的作用。

Table 1 Typical quorum sensing signal produced by microorganisms and their structures表1 微生物产生的典型群体感应信号分子及其结构
1.1 N-酰基高丝氨酸内酯(AHLs)
AHLs 是革兰氏阴性菌最常利用的一类信号分子。它由保守的高丝氨酸内酯(HSL)环组成,酰胺(N)连接C4 到C18 长度不等的酰基侧链[18‑19]。AHL 核心结构相对简单,但其链长结构会随物种的改变而具有差异性,这些结构变化则介导着细菌的特异性识别[8]。例如,植物病原菌Pantoea stewartii 和 铜 绿 假 单 胞 菌 (Pseudomonas aeruginosa)分别产生3‑oxo‑C6‑HSL 和3‑oxo‑C12‑HSL[20],不同的信号分子使得细菌在多物种混杂的种群中仍能通过AHL区分自我。QS信号分子主要由两种蛋白质调节:第一类是AHL 合成酶,由AI‑1诱导基因(luxI、phzI、traI、lasI等)所编码,并将信号前体转化为一个或多个AHL 信号分子;第二类是受体即R 蛋白,由R 基因(luxR、phzR、traR、lasR等)所编码,其表达需要特定基因的激活或抑制。在低细胞密度时,产生的AHL 信号随细胞浓度梯度扩散或被转运至胞外。随着种群密度的增加,AHL 信号在细胞内逐渐积累。当达到阈值水平时,AHL 与R 蛋白相互作用,介导R 蛋白发生二聚,从而被转运并结合到一个QS控制的特定启动子区域,利用RNA 聚合酶激活下游靶基因的表达[21](图2a)。
大多数细菌物种仅能识别同类的AHL 信号,因此通常被认为介导的是种内交流[25]。但是,近期许多研究发现,某些细菌有能力利用其他物种合成的AHL,并通过AHL 信号与相邻种群或者真核宿主进行交流[26]。例如沙门氏菌(Salmonella spp.) 和大肠杆菌(Escherichia coli) 无法合成AHL 自体诱导物,但却拥有AHL 受体,这使它们能够“偷听”群落中其他细菌的交流[27]。同样的,许多植物也具有“窃听”功能,如苜蓿、拟南芥和三叶草等,可以感知AHL 并作出防御性或刺激发育变化的特异性反应[28]。
1.2 寡肽(AIP)
与革兰氏阴性菌相比,革兰氏阳性菌中不具备经典的AHL 系统。一个可能的原因是革兰氏阳性菌缺乏多孔外膜结构,并且覆盖了一层很厚的肽聚糖外壳,这可能限制了AHL 信号向胞外的扩散。但是,大多数革兰氏阳性菌能够利用被称为寡肽(AIP)的小分子肽作为通讯信号。这些AIP从细胞中主动运出,在达到阈值浓度时激活细菌表面由组氨酸激酶和响应调控子组成的双组分系统,通过磷酸化级联信号转导,激活目标基因的表达,如金黄色 葡 萄 球 菌(Staphylococcus aureus) 的Agr 系统[29](图2b)。除此之外,AIP还可以通过寡肽运输系统转运回胞内并与RAP 磷酸酶或转录调控因子互作,启动靶基因的转录[30],如链球菌(Streptococcus) 中短疏水肽与Rgg 调节因子的互作[31]。
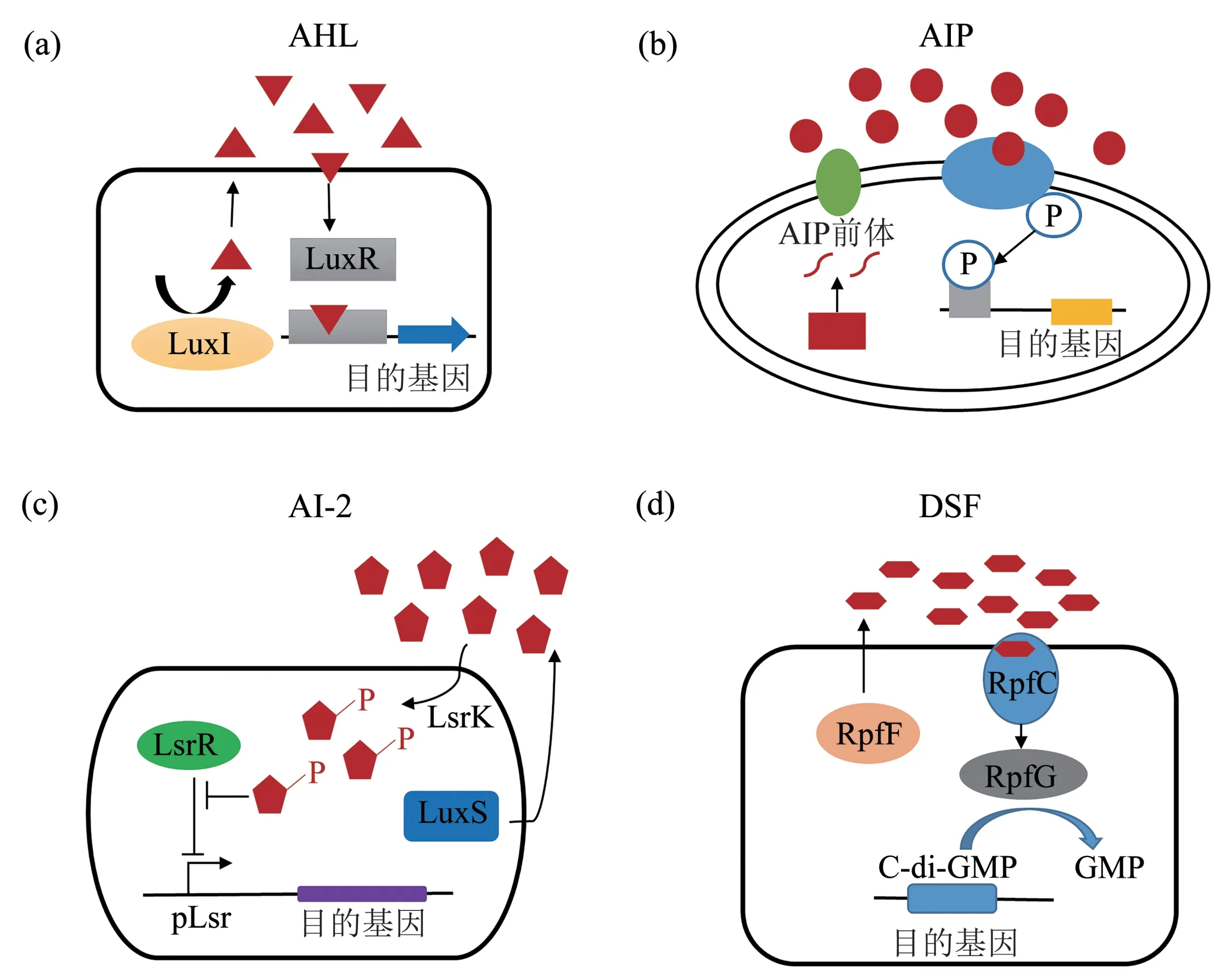
Fig.2 The mechanism of the main quorum sensing signals图2 主要群体感应信号的作用机制
此外,不同的菌属拥有不同的信号物质,Jarraud等[32]发现不同的金黄色葡萄球菌(S.aureus)产生不同类型的信号肽。每种类型的信号肽只被同源的AgrC 受体所识别,当其他菌株分泌的非同源信号肽与AgrC 受体结合后,则会抑制AgrC 的活性[33]。这说明非同源信号肽能够阻止细胞间的沟通。因此在多菌株共存时,第一个建立其QS 系统的菌株可能更易感染宿主。因此,靶向细胞间的交流将成为一个对微生物感染进行治疗的重要方式。
1.3 自诱导物2(AI-2)
与高丝氨酸内酯型AI‑1 对应,另一类重要的信号分子是自诱导物2(AI‑2),其广泛存在于革兰氏阴性和阳性菌中[10]。AI‑2是一组由4,5‑二羟基‑2,3‑戊二酮(DPD)衍生的化合物,由luxS基因编码合成并自发环化形成的一系列呋喃酮衍生物[34]。合成后的AI‑2 可以被转运到细胞外,并在浓度达到一定阈值时,通过一系列的级联系统来调节QS基因的表达并影响菌株的生理行为,包括生物被膜的形成和毒力基因的表达等[35‑37](图2c)。
目前的研究表明,一个物种产生的AI‑2 可以影响其他物种的基因表达[38]。同时,细菌产生的AI‑2 特异性感应物,能进行自我和非自我的交流[39],因此AI‑2 被认为是既可介导种内,又可介导种间的通讯工具。此外,Kong 等[40]的研究指出,植物病原真菌烟草疫霉(Phytophthora nicotianae)、大豆疫霉(Phytophthora sojae)和瓜果腐霉(Pythium aphanidermatum)同样能够产生AI‑2,表明AI‑2 可 能 还用于 真 菌与细 菌 的跨界交流。
1.4 扩散信号因子(DSF)
扩散信号因子(diffusible signaling factor,DSF)是细菌用于种内和种间交流的另一类重要信号分子。其通常是α,β‑不饱和脂肪酸,并被称为顺式‑11‑甲基‑2‑十二碳烯酸[41]。DSF 的合成受rpfF和rpfB基因的调节,这两个基因分别编码烯酰辅酶A 和长链脂肪酰基辅酶A 连接酶[11]。分子识别涉及两部分调节系统,即传感器RpfC 和响应调节器RpfG[42](图2d)。Rpf 蛋白最早在黄单胞菌属(Xanthomonas spp.)中被发现,且其同源蛋白广泛地存在于黄单胞菌属中,并控制着这些细菌毒力因子的合成、聚集行为和生物膜的形成[43]。作为黄单胞菌的近缘物种,假单胞菌(Pseudomonads)具有黄单胞菌DSF 传感器的同源蛋白,因此在这两种细菌之间可能存在普遍的种间交流。此外,铜绿假单胞菌的DSF 类似物也影响着大肠杆菌、肺炎克雷伯氏菌(Klebsiella pneumoniae)、奇异变形杆 菌 (Proteus mirabilis)、 化脓性链球菌(S. pyogenes)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(S. aureus) 和白色念珠菌(C. albicans)中生物膜的成熟与扩散[44‑46]。进一步证实了DSF 具有宽泛的生态幅,可实现多物种的种间交流。但是,对于DSF 的调节机制以及在种间交流中的作用,目前的结论推测跟营养获取和生存适应有关,但仍然需要确切的证据来证明[47]。
1.5 醇类
自Hornby等[15]从真菌——白色念珠菌中鉴定了第一个QS 信号分子,即金合欢醇(farnesol)后,迄今为止已经发现至少47 种能够分泌金合欢醇的真菌物种,包括多种假丝酵母菌[48]。金合欢醇是无环倍半萜醇,其QS 涉及组氨酸激酶Chk1p[49]和Ras1‑Cyr1 途径[50],但其受体存在多变性,还有待进一步商榷。金合欢醇调节多个基因的表达,并诱导一种抑制真菌丝状化的转录辅因子TUP1[51],同时抑制菌体形态转变激活剂CPH1 和HST7的表达[52]。因而,该信号分子常被视为真菌形态(孢子态、菌丝态、游动态等)的调节剂。
虽然金合欢醇作为细胞密度调节器的功能尚待确定,但其已被报道能够抑制白色念珠菌生物膜的形成[53]。此外,Semighini 等[54]发现,当构巢曲霉(Aspergillus nidulans)和白色念珠菌共培养时,其生长和发育受到金合欢醇依赖性的损害。Jabra‑Rizk等[55]对金黄色葡萄球菌的研究表明,金合欢醇可抑制生物膜形成,损害细胞膜的完整性,并增强了金黄色葡萄球菌对抗生素的敏感性。这些结果表明,金合欢醇除了能调节形态发生的QS功能外,还起着种内种间交流的作用。重要的是,金合欢醇在预防生物膜相关的感染和降低病原菌耐药性的治疗中具有潜在的应用价值[56]。
除了金合欢醇,Chen等[13]在白念珠菌中发现了另一种QS 信号分子,即芳香醇——酪醇(tyrosol)。酪醇由芳香族氨基酸经转氨作用、脱羧和乙醇脱氢酶还原而成[57]。与金合欢醇相似,酪醇也能够控制菌丝的形成、生长、形态发生以及生物膜的发生。不同的是,酪醇会在生物膜形成的早期和中期刺激菌丝的发育,而金合欢醇则在成熟生物膜的后期促进菌丝的释放,以帮助菌体在更远的地方分散和定殖[58]。除此之外,一些其他醇类也可作为信号分子参与对真菌的调节,如色醇和苯乙醇, 它们可控制酿酒酵母(Saccharomyces cerevisiae)从单细胞形式转变为侵袭性丝状形式的发育[59]。更普遍的是,芳香醇的合成基因被证实存在于大多数酵母物种中[60],并证明它们常常与真菌的形态表型相关[61]。
1.6 吲哚
吲哚(indole)属于杂环芳香族化合物,由细菌中的四聚体色氨酸酶(TnaA)催化色氨酸向吲哚、丙酮酸和氨的转化而产生[62‑63](化学反应:L‑色氨酸+H2O >吲哚+丙酮酸+NH3)。目前已有超过85 种细菌会产生吲哚,并影响着细菌的生理和代谢[14,64]。在大多数细菌中,吲哚被视为信息素或者调节剂,革兰氏阴性菌中吲哚控制着微生物群落中对毒素、药物和酸的抵抗力,生物膜的形成及其他多种生物学功能[65‑66];在革兰氏阳性菌中,有报道指出吲哚通过与丙酮酸激酶结合增加金头孢菌(Stigmatella aurantiaca)孢子的形成[67]。在早期的研究中,吲哚仅被认为是细菌的种内信号,但近期的研究报道了其介导种间交流的能力。假单胞菌在与大肠杆菌共培养时,通过吲哚增加自身生物膜,同时控制大肠杆菌生物膜的形成[66]。Mueller 等[68]指出,霍乱弧菌(Vibrio cholerae)使用吲哚信号转导来增强对真核生物盘基网柄菌(Dictyostelium discoideum)的抗性。
此外,Wikoff 等[69]的观察结果表明,细菌和哺乳动物的新陈代谢之间存在显著的相互作用,而吲哚及其衍生物则是两者信号传递中的重要媒介。在海洋生态系统,浮游植物也与周围的细菌通过信息物质交流来互利共生,例如亚硫酸杆菌Sulfitobacter 通过分泌吲哚‑3‑乙酸来促进硅藻细胞分裂;同时,利用硅藻分泌的以及内在的色氨酸来继续合成吲哚‑3‑乙酸以增加硅藻细胞浓度[70]。综上,吲哚代表了一类新的信号分子,不仅在种内,而且在种间及跨界交流中均表现出重要的功能[71‑72]。
1.7 其他信号分子
除了上述描述的主要信号以外,其他各种QS分子也参与细胞信号传导,包括丁内酯、自诱导物3及环状二肽等。
a.丁内酯(butyrolactone)。丁内酯最初发现于链霉菌属(Streptomyces spp.),其主要控制细菌的形态分化和次级代谢产物的产生[73]。虽与AHL结构类似,但丁内酯不与AHL 受体结合,且其作用方式通常是使阻遏蛋白从目标基因启动子区域解离,从而维持基因的稳定表达。
b.自诱导物3(autoinducer‑3,AI‑3)。它是一种胺化的芳香族化合物,最初从肠道病原体的上清液中纯化获得[74],并进一步证实其合成不依赖AI‑2 合成酶[75],但其精确的结构和合成途径仍知之甚少。AI‑3 由一些不同的革兰氏阴性菌产生,参与毒性的控制及鞭毛的合成,被认为是一个多物种的交流信号。AI‑3 在细菌表面被感受器激酶QseCB 双组分系统的QseC 所识别,QseCB 也响应真核宿主产生的荷尔蒙,如肾上腺素、去甲肾上腺素,因此可能参与跨界交流[76]。
c. 环状二肽(diketopiperazines,DKP)。环状二肽也称为二酮哌嗪,是细菌使用的一组信号分子,用于传达有关种群数量的信息,并调节与宿主从共生到独立生存的行为转换[77]。DKP 可以模拟AHL 的功能,并在AHL 结合位点与LuxR 蛋白相互作用[78],但所需的DKP浓度远高于AHL。除了作为AHL 分子类似物,也有报道称链霉菌所产生的DKP还参与植物的交流,并具有抗菌活性[79]。
2 群体猝灭信号
群体猝灭(quorum quenching,QQ)是微生物破坏信号分子以阻碍QS过程的一种策略。它的目的是抑制QS级联反应中的特定功能,同时避免对细菌生存和生长产生影响。首次报道的QS降解酶分离自土壤的贪噬菌属(Variovorax)和芽孢杆菌(Bacillus)[80‑81],自此已经发现许多与QS降解或修饰有关的QQ 酶。现今发现的QQ 酶主要有4 类:a.降解高丝氨酸内酯环的内酰胺酶[82];b.酰胺水解酶或酰化酶,可在酰胺键处裂解AHL 并释放脂肪酸和高丝氨酸内酯[83];c.将3‑氧基AHL 转化为其同源3‑羟基AHL的还原酶[84];d.催化酰基链氧化的细胞色素氧化酶[85]。这些酶广泛存在于细菌、古菌和真核生物中。有趣的是,一些产生AHL 的细菌同时也带有降解AHL 酶的基因,如铜绿假单胞菌PAO1 的PvdQ 和根癌农杆菌(Agrobacterium tumefaciens)的AttM/AiiB 酶能够降解AHL[86‑87]。而有些不产生AHL 的细菌也合成了AHL 降解酶[88]。这些特征表示QQ 是由QS 产生者为清除自身QS 信号而进化出的自然机制,或者是产QQ 生物与QS信号产生者竞争的一种有效手段[89‑90]。
QQ 的作用机理主要包含3 种策略:抑制信号的产生、传播或感知[91](图3)。Chung等[92]确定了两种作用于C8‑HSL的抑制剂,分别竞争性抑制C8‑HSL 的合成酶TofI 以及C8‑HSL 的受体TofR。Wong 等[93]报道了真核酵母Trichosporon loubieri通过内酯酶活性降解细菌QS分子,从而破坏AHL的信号传导。一些QS 抑制剂也可直接作用于QS受体,如卤化呋喃酮可以调节LuxR 活性,进而破坏AHL 依赖性转录激活因子来降低细胞密度[94]。卤化呋喃同时被证明能够影响铜绿假单胞菌生物膜的结构与附着[95‑96],抑制大肠杆菌的种群数量[97],从而能够控制病原菌感染。
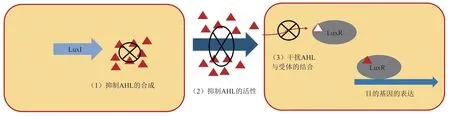
Fig.3 AHL-mediated quorum quenching mechanisms[98]图3 AHL介导的群体猝灭作用机理[98]
QQ 为治疗病原菌感染提供了新的策略,拓宽了当前预防细菌疾病的有效方法[99]。Dong 等[88]通过转基因使植物表达AHL‑内酰胺酶,结果发现植物猝灭了病原菌的QS 信号,并显著增强了对欧文氏菌Erwinia carotovora 的抗性。来自芽孢杆菌的群体猝灭剂有效降低了嗜水气单胞菌对斑马鱼的致病率[100]。AHL类群体感应抑制剂的作用范围较窄,并且长链的AHL 类似物比短链的更具有针对性[101]。此外,LuxO 是控制全球霍乱弧菌QS 级联反应的中央调节剂,有研究者确定了针对LuxO的抑制剂可以干扰多种弧菌的毒力控制[102]。由于这些抑制剂都只能靶向作用于特定生物,因此有助于消除混合物种中的指定生物。QS 抑制剂通过选择性的抑制特定生物而不是全部消杀的方式,能够有效替代抗生素来避免耐药性的限制,作为一种有前途的治疗方法广泛应用于人类、兽医、农业和水产养殖等各个领域。
3 抗生素类信号分子
抗生素是由微生物产生的低分子质量(3 000 u)有机分子,由于具有抑菌或杀菌能力而被筛选出来。据估计,诸如红霉素和链霉素等抗生素的生物合成途径已有上百年的历史,并且在全球范围内广泛推广[103]。随着抗生素的大量使用,研究者逐渐发现在抗生素减少病原菌对宿主黏附的同时,还会影响病原菌的毒力特征。Bader 等[104]的研究表明, 鼠伤寒沙门氏菌(Salmonella typhimurium)暴露于亚致死浓度的抗菌肽下会激活其PhoP/PhoQ 和RpoS 毒力调节因子,同时抑制鞭毛合成和与入侵相关的III 型分泌系统所需的基因转录。Linares等[105]则证实亚抑制浓度的妥布霉素、四环素和诺氟沙星会触发铜绿假单胞菌毒力因子的表达,诱导生物膜的行成。因此如今出现了新的观点,认为抗生素不仅是细菌武器,而且在亚抑制浓度下可以充当种间信号分子,调节微生物群落的平衡[106‑107]。
目前已有研究表明,大环内酯类抗生素和红霉素能以最小的生长抑制浓度控制铜绿假单胞菌中AHL 的合成[108‑109]。除此之外,在低于阈值水平时,这些抗生素能够调节细菌中5%~10%的基因转录[105,110]。亚抑制性抗生素浓度可以增加细菌中编码影响与宿主细胞互作基因的表达[111],并且可以诱导生物膜形成,如铜绿假单胞菌和大肠杆菌对氨基糖苷的亚抑制水平起反应,并产生抗生素抗性生物膜[112]。这也许是革兰氏阴性菌用来对抗产生抗生素的革兰氏阳性菌(如链霉菌)的一种策略。亚抑制水平的抗生素并不总是对生物膜的形成有促进作用。半合成的大环内酯类化合物阿奇霉素可减少流感嗜血杆菌(Haemophilus influenzae)的生物膜形成。但有趣的是,其他与阿奇霉素具有相似抗菌机制的抗生素,如红霉素(具有高度相关的结构)和庆大霉素,对流感嗜血杆菌的生物膜形成几乎没有影响[113],这可能暗示同一类别中不同抗生素对特定细菌功能启动子具有特定激活模式。
近年来越来越多的研究指明,亚抑制浓度下的抗生素是细菌细胞转录的有效调节剂[114‑115]。因此,低浓度抗生素能够作为信号分子调节邻近细胞的代谢和生理机能,而只有在超过阈值浓度时才会产生抗菌作用。也就是说在低浓度下的抗生素甚至可以有益于自然环境中潜在病原菌的感染行为,这完全改变了人们对抗生素生态功能的看法。因此,在未来的研究中需要投入更多的努力去阐明亚抑制浓度下抗生素的作用靶点以及其中涉及的调控机理,这不仅有助于开发特定细菌感染的治疗方案,如通过促进有益细菌形成生物膜以抵御病原菌侵袭或对病原菌毒力因子的靶向控制实现特定抑制,而且对生物圈中微生物互作的理解都有深远的意义。
4 接触依赖型交流
微生物除了通过有距离地交换扩散性信号进行交流外,还能够以细胞间的直接接触来传递信息。在这种接触依赖的胞间交流中,信息的载体不仅是小分子,也可以是蛋白质、DNA 和RNA。研究发现,大肠杆菌EC93在混合培养条件下,可以抑制其他大多数大肠杆菌的生长[116]。这种抑制需要细胞的直接接触,并且由称为接触依赖性抑制剂A(CdiA)和分泌CdiA 的家族成员CdiB 两个蛋白质调节。CdiAB 系统表达的抑制细胞与靶细胞通过BamA 受体间的相互作用而聚合,CdiA 的羧基端被蛋白酶裂解后转运到靶细胞内进行破坏。而在抑制性细胞中,其cdiI基因编码免疫蛋白避免了自我抑制。这种接触依赖的细胞交流有助于细菌在相近物种间的竞争中建立种群优势。
此外,有研究者发现一种由连接相邻细胞的胞间纳米管(intercellular nanotubes)所介导的细菌通讯[117]。枯草芽孢杆菌能够产生不同大小的管状延伸桥接邻体细胞,直接将胞质荧光蛋白进行转移,同样,细胞也可以从其接触的邻体那里获得抗生素耐药性。这种纳米管不仅可以桥接枯草芽孢杆菌和同种细胞的信息传递,还可以介导和金黄色葡萄球菌或者大肠杆菌的胞内分子交换,为种内和种间的物质交换提供了一个网络(图4a)。
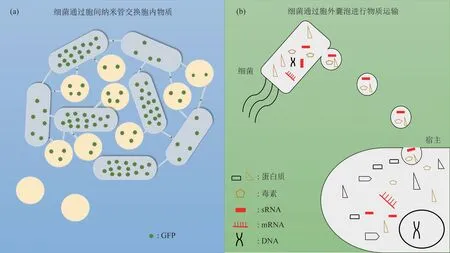
Fig.4 Bacteria communicate through intercellular nanotubes(a)[117]and extracellular vesicles(b)[118]图4 细菌通过胞间纳米管(a)[117]和胞外囊泡(b)进行交流[118]
5 胞外囊泡交流方式
原核和真核细胞都能够分泌一种进化保守的纳米级膜状囊泡——胞外囊泡(extracellular vesicles,EVs),EVs 能够通过多种内吞途径进入宿主细胞[119](图4b)。而EVs 中常包含许多成分,如小RNA、蛋白质、病毒等,在进入目标受体后被释放出来。例如,沙门氏菌产生的一种PhoP 激活的小RNA‑PinT,不仅可以介导与入侵相关的效应因子和存活所需的毒力基因的活性,还可以调节宿主基因的表达[120]。一种侵袭性真菌病原体灰葡萄孢菌(Botrytis cinereal)将有毒的小RNA转移到拟南芥植物细胞中,通过使宿主防御基因沉默来实现感染[121]。有研究者对珊瑚病原弧菌V.shilonii产生的EVs进行分析后发现,其中包含与病原菌毒性相关的蛋白质,除此之外还检测到了AHL 的存在,暗示弧菌通过EVs 进行QS 交流[122]。另外,还有证据指出,EVs在宿主与病毒的相互作用中起重要作用[123]。这些结果说明,EVs 作为一种新型通讯方式,介导着微生物与宿主间的紧密交流。
6 信号交流的作用
微生物栖居过程中常常需要应对多变的环境,包括资源的匮乏和恶劣条件的刺激,为了获得长久生存,微生物通过交流将单个细胞的功能与群体的需求联系在一起,共同应对外界挑战。这些信号交流频繁发生,并在种群和物种水平上带来益处。在这里,重点归纳3种生态作用,即产生生物膜获得自我保护、通过资源分割实现营养共享,以及与宿主不断互作完成协同进化。
6.1 形成生物膜
在自然环境中,微生物很少以浮游形式出现,而是聚集存在于由胞外聚合物(extracellular polymeric substances, EPS) 组 成 的 生 物 膜(biofilm)中。EPS 主要由多糖、蛋白质、酶和脂质等组成,为微生物提供保护性屏障来避免细胞直接暴露于不利条件[124]。目前研究表明,生物膜的形成与扩散受到微生物QS 系统的严格调控[125‑126]。敲除铜绿假单胞菌的QS 基因导致了其生物膜密度和多糖含量的显著降低,相同培养条件下,QS 突变株生物膜中的细胞更易被抗生素杀灭,但野生型菌株生物膜中的细胞几乎不受卡那霉素影响[127]。
此外,由于生物膜常包含多种细菌及真菌,因此种间或跨界交流在生物膜的发展和维持中也起着至关重要的作用。如对牙根尖病变的研究中发现,牙龈卟啉单胞菌(Porphyromonas gingivalis)显著增强了核梭杆菌(Fusobacterial nucleatum)生物膜的形成,而其产AI‑2 的luxS 基因缺失导致这种增强作用降低,这说明邻近生物的交流使许多微生物形成更复杂的生物膜[128]。尽管微生物的生存并不需要生物膜,但生物膜赋予了细胞多种生存优势,包括增加抗逆性、抵抗紫外辐射、提高抗生素耐药性等,增加了它们在不利条件下繁殖、存活和代谢的机会[129]。
6.2 资源共享
微生物常生活于多物种共存的环境中,这就不可避免地要为有限的资源而纷争。为了更好地分配资源,微生物形成了社会群体,通过释放信号来共享生态位。一个典型的例子是豆科植物与根瘤菌通过多种分子对话机制建立的固氮共生,其中QS 介导的基因调控在宿主‑细菌相互作用中起重要作用,影响着结瘤效率、共生体发育、胞外多糖产生和固氮[130]。此外,Wyss[131]发 现 细菌 中的 固 氮酶(Nif)可以将大气中的氮转化为藻类可利用的氮,同时使用类似QS 的机制感知藻类密度,在高藻类密度下抑制固氮基因的表达,防止藻类的过度增长,控制着共生体的整体密度。这些交流通过分割生态位,实现营养的有效利用,将资源枯竭的可能性降至最低,有利于群体的长远发展。
6.3 协同进化
微生物借助各种语言进行交流来实现与其他物种错综复杂的互作,而物种间持续的相互作用是进化进程的关键驱动力。目前有学者指出,QS 系统可能是维持物种合作和调整进化的一种分子机制[132]。Bruger 等[132]比较了野生型与luxR 基因突变型弧菌(V. campbellii)在调控合作与进化中的作用,发现突变株的群落谱系逐渐被作弊者(使用但不贡献资源的生物)替代,而具有QS 系统的菌株群落则维持着协同进化;进一步的研究发现,野生型菌株其生物发光和蛋白酶的产生逐渐降低,说明微生物交流系统通过减少表型功能的表达来控制群落成员的变化。此外,在与植物的互作中,QS也被证明影响着宿主与其共生细菌之间的进化[133]。农杆菌(Agrobacterium)利用QS 对宿主发起侵染,植物信号则通过激活其群体猝灭机制来进行信号串扰,农杆菌与其植物宿主之间复杂的信号互作反映了一种平衡的共同进化[134]。
7 信号交流的应用
微生物间的交流常常与病原菌的致病性密切相关,通过QS系统调控毒力相关过程,使细菌能避免宿主防御系统对它的早期识别,并在定殖成功后统一种群行为,有效扩大其生态影响。信号交流为微生物带来了生存优势,但同时也使其成为疾病治疗、农业病害防治及环境修复的新突破口。
7.1 疾病治疗
由于有65%~80%的疾病感染与生物膜有关,因此生物膜已成为一个明显的药物靶点[135]。Chow等[136]通过基因工程合成的AHL 内酯酶,能够有效破坏临床分离的病原菌鲍曼不动杆菌(Acinetobacter baumannii)生物膜的形成,为感染性疾病提供了有效的防治策略。铜绿假单胞菌具有多种QS系统,因其极易形成生物膜且具有多重耐药性而难以治疗[137]。鼠模实验表明,合成的呋喃酮化合物成功干扰了铜绿假单胞菌的AHL 系统,加速了肺部细菌的清除,降低了感染的严重程度,并显著延长了小鼠的存活时间,对铜绿假单胞菌肺部感染具有良好的治疗效果[138]。鉴于病原菌抗生素耐药性的日渐严重,开发治疗细菌感染的新疗法,例如基于群体猝灭的治疗手段,将具有巨大的临床意义。不同于抗生素,群体猝灭剂调节了病原菌的毒力,抑制生物膜的形成,但不影响细菌的生存生长,因此在减弱致病性的同时,不会造成抗菌治疗的选择压力,是治疗细菌感染性疾病的有效途径[139]。
7.2 农业生产
细菌感染是农业生产、畜牧养殖中所面临最严重的问题之一,对生产养殖造成了巨大损失[140],因此寻求有效的生态友好型病害防治手段具有重要价值。目前已有研究者通过转基因使烟草表达N‑氧代酰基高丝氨酸内酯,避免了软腐植物病原菌Erwinia carotovora 植物细胞壁降解酶的过早产生,并及时激活植物防御反应,从而增强了对病原菌的抵抗力[141]。Kalia 等[142]总结了多种来源的QS 抑制剂,这些抑制剂能够有效对抗具有重要经济价值的植物和动物性疾病。此外,借助植物共生菌产生抗性物质是病害防治的另一有效方法,如假单胞菌P.aureofaciens通过QS系统产生吩嗪类抗生素,能够保护小麦免受真菌感染[143]。因此,QS抑制剂或激活剂在农业生产中具有潜在的应用前景。
7.3 环境修复
微生物、藻类和原生动物等在海洋环境中常常定殖于基质表面形成生物污损,对海洋工业和海军产生一系列严重后果,如促进金属腐蚀、降低仪器灵敏度、增加船体阻力等。生物污损通常采用防污涂层进行控制,但目前已经发现一些目标生物具有抗药性,此外大部分防污化学物质具有毒性会增加环境污染风险,因此急需开发新的环保型防污策略。Dobretsov 等[144‑145]通过筛选发现QS 抑制剂曲酸和呋喃酮能够降低细菌和硅藻的密度并且有效控制生物污损。目前越来越多的研究者指出,干扰细菌QS系统破坏生物膜将是未来新型无毒害的防污损手段[144,146]。
8 总结与展望
随着微生物研究的不断深入,人们逐渐认识到生活在庞杂环境中的微生物并不是孤立地存在,而是表现出群体的行为。在群体过程中它们使用多样的交流系统去协调自身活动,感知邻近细胞的动态,并相应调节自身的行为。这些交流语言广泛存在且具有种属差异,包括化学信号、小分子化合物、信息素,以及细胞间的物理接触等,行使着种内、种间和跨界通讯的功能,决定着微生物与相邻生物之间互利共生或是竞争的关系。近年来,更有研究表明,最简单的生命个体——病毒,也在QS信号的介导下参与着宿主的互作交流[147]。
在过去的几十年里,结构和功能多样的信号系统正以惊人的速度被发现,并不断增加着人们对微生物通讯、微生物生理和微生物进化的认知,但是许多信号分子的全部面貌和交流分子机制仍是未知领域。此外,目前对微生物信号的了解大多基于实验室内的纯培养,对于自然微生物群落的研究还非常缺乏。因此,在未来研究中仍有许多方向需要进一步开拓。
a.不同生境下多物种交流方式的探索,如极端环境(高原、冰川、深海、热液、极地)、特殊生境(深渊、大气、临近空间等)下,嗜热、嗜冷、嗜酸古菌是如何通过交流与沟通抵抗环境胁迫协同生存,以及它们的对话机制在环境耐受中如何发挥作用。
b.新技术的应用。高通量测序技术的发展,多组学技术和显微成像技术的不断进步,为认识复杂微生物群落的组成和动态信息提供了契机。有望通过更多新方法找到更多的信号分子,扩充微生物语言库,更深入地理解微生物在复杂群落结构中的信息交流,以及揭示这种交流如何驱动生物过程和微生物的进化。
c.利用交流语言阐释生态事件,解读微生物的行为机制,例如环境适应、共生关系、协同进化等。前期的研究工作中已经发现,共生微生物通过种间交流能够调节藻际环境的物质交换和珊瑚共生体的稳态,对揭示赤潮的发生和珊瑚的白化有辅助意义[148‑149]。随着研究的推进,针对语言调节下微生物行为的深入理解,可更好地解释生态现象、开展生态修复,包括环境治理、废水处理以及病原防控等。
d.借助合成生物学对微生物语言进行改造与利用。合成生物学的应用开创了操纵自然微生物群落中群体感应行为的先例。目前,国内外已经实现通过合成QS 系统的元件构造和遗传通路,完成菌群的搭建并对菌群特定功能进行“开关”控制,并合成了多种QS抑制剂或探针进行疾病的抵抗或治疗。借助合成生物学调控QS 这一策略已逐渐应用于疾病治疗、环境治理和生态保护,但操控QS 元件并设计人工微生物群落组成仍处于发展阶段,不过随着对微生物语言的不断了解以及更多新技术的应用,将推动微生物学这一领域的快速发展。

