siRNA纳米递送系统研究进展*
张琼丹 陈朝霞 李芾瑶 张 宇*
(东南大学生物科学与医学工程学院,生物电子学国家重点实验室,江苏省生物材料与器件重点实验室,南京 210096)
小干扰RNA(small interfering RNA,siRNA),也被称为沉默RNA、短干扰RNA 或非编码RNA。siRNA 是生物针对外源侵入基因所表达的双链RNA(double stranded RNA,dsRNA)进行切割后生成的具有特定长度和序列的小片段RNA,siRNA的特定长度为21~25 bp[1]。这些siRNA 可以通过RNA 干扰作用特异性沉默耐药相关基因的表达来改善化疗药物的抗癌效果。RNA 干扰于1998年首次在哺乳动物细胞中被发现,Fire 等[2]向秀丽隐杆线虫(Caenorhabditis elegans,C.elegans)中递送长片段的dsRNA,结果显示dsRNA 能有效沉默目标基因表达。此后,逐渐发现RNA 干扰是由双链RNA 诱导同源mRNA 高效特异性降解的现象。这种诱导基因沉默的机制是通过阻碍特定基因的翻译从而抑制特定基因的表达,是真核生物细胞的一种重要防御机制[3]。2001年,Elbashir等[4]将干扰RNA 应用于人类疾病的治疗,用实验证明了合成的siRNA 可以限制一个基因在哺乳动物的不同细胞系中特异性排列的方式。2004年,第一个以siRNA 为基础的RNA 药物(治疗湿性年龄相关性黄斑变性)进入I 期临床试验[5‑6]。2010年,第一次应用于肿瘤患者的有针对性的纳米颗粒输送系统进入I 期临床试验,siRNA 开始系统性地应用于实体瘤[7]。从此siRNA 的研究进入全新的领域,开始了快速发展的阶段。
1 RNA干扰
1.1 RNA干扰作用机制
RNA 干扰是一种RNA 分子作用的过程,它通过与目的基因序列的编码互补,从而诱导降解相对应的信使核糖核酸(messenger RNA,mRNA),阻止mRNA翻译成蛋白质[8‑9]。RNA干扰通过传递小RNA发挥作用, 包 括siRNA、 微 小RNA(microRNA, miRNA)、 短发卡RNA (small hairpin RNA,shRNA)和内切酶底物RNA(dicer siRNA,dsiRNA)等形式[10]。其中,shRNA 的作用途径在最上游,其发挥效用需要细胞核加工;其次是dsiRNA,其发挥效用需要内切酶处理[11]。而siRNA 和miRNA 是目前研究的核心,其作用途径是直接输送到RNA 诱导沉默复合物(RNA‑induced silencing complex,RISC),二者不同之处是:miRNA 并不需要完全与目标序列配对,而siRNA则需要完全与目标序列配对,这种差异导致miRNA 和siRNA 发挥不同的基因沉默效果;同时miRNA 抑制翻译,而siRNA 诱导Argonaute‑2 蛋白降解。哺乳动物细胞中miRNA 与siRNA 介导的RNAi机制如图1所示[12]。哺乳动物初级miRNA转录本(pri‑miRNA)在细胞核中转录(①)并被微处理器复合体(Drosha‑DGCR8)切割以产生约30 bp shRNAs(②),称为pre‑miRNA。输出蛋白5(Exportin 5) 结 合 并 运 输pre‑miRNA 到 细 胞 质(③),在细胞质中它与Exportin 5 脱离(④)并与Dicer 和TAR RNA 结 合 蛋 白(TAR RNA‑binding protein,TRBP)结合(⑤)(也有非Dicer 介导的途径)。Dicer切割pre‑miRNA的末端环(⑥)并诱导形成RISC 装载复合物(RISC‑loading complex,RLC), 与Argonaute (Ago1‑Ago4) 蛋 白 结 合(⑦)。选择反义链并将其装载到Ago1‑Ago4中,并丢弃正义链(⑧)。成熟的RISC 可以通过抑制mRNA 翻译、诱导mRNA 在细胞质P 体和/或GW体中的螯合、促进mRNA 降解和指导靶基因位点的转录基因沉默来调节基因表达(⑨)。Argonaute、GW182 和反义链对于RISC 的mRNA沉默活性至关重要。TRBP 和Dicer 可以在反义链装载后与成熟的RISC 分离。与反义链的种子区域(从5′端开始的第2~8 个碱基)互补的mRNA 即可受到RNAi的影响。合成的siRNA通过胞吞作用进入细胞质,随后发生内涵体逃逸(⑩)。siRNA 随后直接与胞质RNAi 酶(Dicer 和TRBP)相互作用(⑪),通过Dicer 介导或非Dicer 介导的途径形成RLC (⑫) 并进行链选择以产生成熟的RISC(⑬)。siRNA 反义链通常与单个靶标mRNA 具有完全互补性,以诱导有效且靶向范围窄的基因沉默(⑭)。Ago2对于RNAi疗法尤其重要,因为它具有内在的剪切活性,可以有效地切割mRNA 靶标(⑮)。
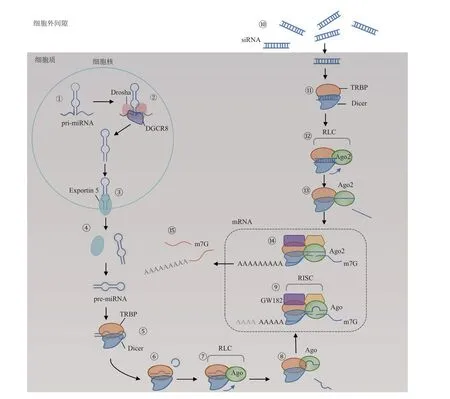
Fig.1 A model for the mechanism of RNAi图1 RNA干扰作用机制模式图
1.2 RNA干扰的应用
由于RNA 干扰的有效性和选择性,它已成为沉默哺乳动物细胞中特定基因表达的首选方法。通过RNA干扰特异性沉默治疗,在病毒感染、癌症、家族遗传病和自身免疫病等方面有着广泛的应用[13]。由一个或几个基因的异常表达引起的各种人类疾病都适合使用基于RNA 干扰干预的治疗策略,包括显性遗传疾病、病毒感染、癌症和自身免疫疾病等[14]。首要的RNA干扰治疗应用是针对遗传疾病的治疗,如突变等位基因转录物中的单核苷酸多态性可用作RNA 干扰的选择性靶标。Miller等[15]在实验中使用siRNA 作为RNA 干扰研究核心,siRNA仅直接选择性地降解突变转录物,尽管突变型与野生型序列只有一个错配,但实验中野生型转录本仍可保持完整。RNA 干扰也可用于抑制病毒感染。McCaffrey 等[16]首次利用体内RNA 干扰治疗乙肝,实验中使用高压尾静脉注射共递送乙型肝炎复制子和编码抗乙肝病毒(HBV) 的shRNA,利用其pol III表达体系来治疗乙肝,可以实现肝细胞中99%的HBV 核心抗原的敲除。除了上述应用之外,将RNA 干扰用于癌症治疗具有非常广阔的前景,可以彻底改变这种破坏性疾病的治疗方法。
在肿瘤的发生和后续发展过程中涉及到多种基因的非正常表达和功能异常化。而造成这些基因功能异常化有两个原因:一是由于正常基因的过度表达造成的;二是由于正常基因发生突变而产生的功能异常的等位基因,因此肿瘤在一定程度上也可被称为基因疾病。近年来随着对肿瘤致病机制的深入研究,以肿瘤细胞内信号转导通路的关键激酶为药物筛选靶点成为抗肿瘤药物研究的新途径,通过这种途径可以获得高效、低毒及高特异性的新型靶向药物。目前,正处于研究或临床应用的新型靶向药物一般都属于疾病基因或靶基因的抑制剂,其通过在肿瘤细胞中沉默相关高表达的疾病基因或靶基因,从而有效地抑制肿瘤生长。而RNA 干扰能够简单高效地沉默靶基因的表达,因此利用RNA 干扰可以起到与靶向药物相同的作用。而且,靶向抑制剂主要直接作用于蛋白质,但是通过这种方式可能会干扰其他蛋白质的表达;而siRNA 则主要作用于mRNA,其能够特异性抑制靶基因的表达,作用位点专一,通常不影响正常基因表达,因此siRNA作为靶向药物应用时,会具有更好的选择性及特异性。理论上,通过siRNA 几乎能够抑制体内任何基因的表达,使得siRNA 比现在广泛应用的小分子靶向药物更具有治疗和应用潜力[17]。
1.3 siRNA药物的优势
siRNA 药物由于其不同于其他药物的独特性质,相较于其他药物,在某些疾病治疗上展现出巨大优势(图2),主要表现在以下方面:
a. siRNA 可以通过序列设计靶向不同的靶基因[18],从而实现对不同疾病的治疗;同时这种设计是快速的,并且具有高效的沉默效果。除此之外,siRNA的合成不需要细胞表达系统,不用像蛋白质药物需要经过表达、纯化等繁琐的步骤。
b.siRNA的沉默效果是瞬时的,并不会敲除靶蛋白的表达基因[19]。因此,如果作为研究对象的目的基因是生存所必需的,或是想研究随时间推移靶蛋白表达降低的影响,siRNA 是非常合适的工具。
c.siRNA的靶点特异性强。对于同一个家族的激酶而言,小分子抑制剂常会出现脱靶效应而产生副作用,而使用siRNA 作为药物可以通过序列的精确设计尽可能减少脱靶的产生。
d.siRNA的效果容易被检测。siRNA的作用机理简单,通过直接降解靶基因的mRNA,达到降低靶基因表达的效果。故检测降低效果时,可以通过定量反转录PCR(qRT‑PCR)检测mRNA 的含量;也可以通过免疫印迹(Western Blot)等方法直接检测蛋白质水平的表达量。而小分子抑制剂通常是通过结合蛋白质的特定位点,影响蛋白质的活性,但是靶基因本身的mRNA 和蛋白量并没有发生变化,需要尝试其他方法才能检测小分子的效果。
正是由于siRNA 药物表现出的一系列优势,近年来,siRNA药物越来越受到重视,与其有关的研究也越来越多。

Fig.2 The advantage of siRNA drugs图2 siRNA药物的优势
2 siRNA纳米递送系统与上市药物
2.1 siRNA纳米递送系统
siRNA是一种很有前景的治疗解决方案,通过转录后基因调控解决基因过表达或突变引起的多种病理状况,如病毒感染、癌症、遗传疾病和自身免疫性疾病(如关节炎)[20]。由于其特异性、适应性和广泛的靶向能力,它在多种疾病的个性化基因治疗中也很有效。然而,裸siRNA 在血流中不稳定,除了具有免疫原性外,还不能有效地穿过细胞膜。因此,精确设计递送系统对于充分发挥这种疗法的潜力至关重要。
药物递送系统是用于靶向递送和/或控制释放治疗剂的工程技术。目前,将纳米载体递送技术与RNA 干扰技术结合,已经成为一种新型基因药物递送系统,这种体系能够有效递送siRNA 进入人体。纳米级尺寸的粒子可通过增强的渗透与滞留效应,从而聚集在肿瘤细胞周围。纳米粒子的尺寸、形状、表面性质、刚性都会影响药物对癌症治疗的效率。纳米载体通常以纳米粒、纳米胶束、纳米水凝胶和高聚物作为药物或基因的载体,同时可在表面键合靶向性分子,如抗体、核酸适体、靶向肽或叶酸等,通过与细胞表面相互作用进入靶细胞。目前纳米载体用来包载的基因主要包括:DNA、 RNA (siRNA)、 反 义 寡 核 苷 酸 药 物(antisense oligodeoxynucleotides, AODNs) 和microRNA等[21‑22]。
2.2 siRNA纳米药物
自从2006年RNA 干扰的研究获得诺贝尔奖,大型制药公司已经投入了数十亿美元用于人类基因沉默治疗的开发。对于药物开发人员而言,siRNA疗法的潜力是不容忽视的。siRNA 具有很强的药效,功能多样,能够对传统小分子药物“无成药性”的蛋白质编码基因进行抑制,并且具有制备“可编程”药物的潜力,可以在不改变体内药代动力学的情况下实现重新靶向[12]。siRNA 疗法的治疗潜力是深远的,许多基于siRNA的药物正在开发中,用于治疗从病毒感染、心血管疾病到遗传性疾病与癌症的各类病症[23‑25](附件表S1)。利用siRNA的这些独特特性,一些siRNA递送系统最近已进入临床试验阶段(表1),并作为一种非常有效和有前景的癌症治疗方法而被研究者广泛研究。药物开发过程极其艰巨,旨在克服复杂的生理障碍,有效、安全地将siRNA递送到所需的组织和细胞,以及增强siRNA的稳定性与特异性,降低其潜在脱靶效应[26]。
2018年8月标志着RNA 干扰治疗的新纪元,美国食品和药物管理局(Food and Drug Administration,FDA)批准了首个基于RNA 干扰的 药 物 Onpattro (Patisiran, 也 称 为 ALN‑TTR02)[12],由美国Alnylam 制药公司(Alnylam Pharmaceuticals)研发(表2)。Patisiran 的批准为医疗需求未得到满足的遗传性运甲状腺素蛋白淀粉样 变 性 (hereditary transthyretin‑mediated amyloidosis,hATTR)患者带来了新希望,并预示了RNA 干扰治疗领域的新时代。2019年11月20日,Alnylam 公司的第二种RNA 干扰药物Givlaari(Givosiran)获得FDA 批准[27‑28]。一年后的11月23日,该公司的第三种药物Oxlumo(Lumasiran)获得批准[29]。如今,针对肝脏,肾脏和眼部适应症的多种候选药物正在I、II 和III 期临床试验中,并且针对中枢神经系统(central nervous system,CNS) 和其他非肝组织的研究性新药(investigational new drug,IND)应用有望在未来两年实现。在接下来的10年中,随着RNA干扰途径新功能的发现、具有增强的特异性和药效的先进RNA 干扰负载策略的开发,以及全身和局部RNA干扰递送方法的持续创新,RNA 干扰领域新的突破性疗法将会不断涌现。
Patisiran 是这3 种上市药物中较典型的siRNA纳米递送系统。2018年8月10日,FDA 批准了作用 于 肝 脏 的siRNA 药 物Patisiran (Onpattro;Alnylam 制药)[12]。Patisiran 是用于治疗运甲状腺素蛋白(transthyretin,TTR)淀粉样变性的siRNA脂质纳米颗粒(lipid nanoparticle,LNP)。hATTR是一种罕见的、遗传性的、威胁生命的神经退行性疾病,由TTR 淀粉样蛋白沉积在周围神经系统、心脏、胃肠道和其他器官中导致。患者有进行性神经病、心肌病、行动障碍和其他各种衰弱的症状,诊断后中位生存期为5~15年。
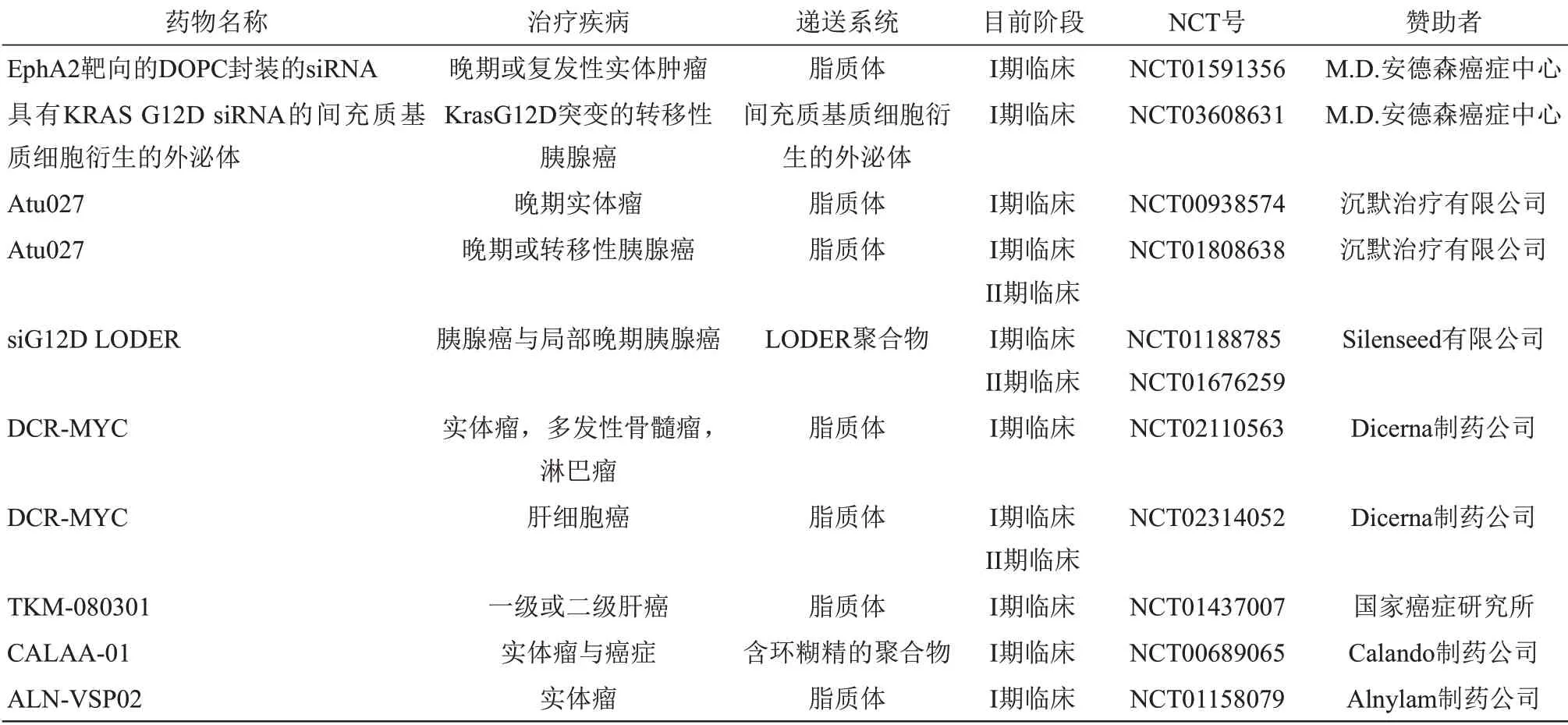
Table 1 siRNA delivery systems in clinical trials表1 临床试验中的siRNA纳米递送系统
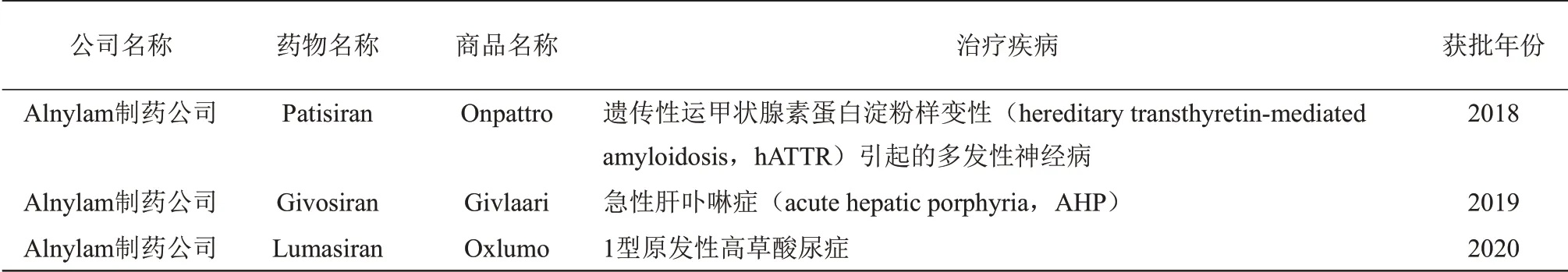
Table 2 FDA approved siRNA drugs表2 FDA批准上市的siRNA药物
大多数TTR 蛋白在肝脏中产生。TTR 中有超过120 个突变可引起hATTR。在开发Patisiran 之前,药物治疗的选择仅限于将TTR 四聚体稳定在其天然构象的小分子药物。尽管这些方法可以减慢疾病的进展,但是仍然迫切需要更有效的治疗选择。
Patisiran siRNA(ALN‑18328)通过沉默肝细胞中的野生型和突变型TTR mRNA 来降低TTR 蛋白的血清水平。为了对TTR mRNA 变体实现广泛的沉默活性,反义链靶向mRNA 的3′非翻译区(untranslated region,UTR),这段序列据推测在患者人群中变异性较小。与临床开发中的大多数siRNA不同,ALN‑18328并非经过完全修饰、代谢稳定的siRNA,并且没有靶向配体来增强肝细胞的摄取,而是通过将ALN‑18328 封装在用于肝细胞摄取的固体脂质纳米粒(LNP)中来实现递送(图3)。Patisiran 由与脂质赋形剂复合的siRNA 组成。这些成分在酸性pH 值下组装成LNP,并每3 周(q3w)静脉注射一次,剂量为0.3 mg/kg,siRNA靶向TTR基因的3′非翻译区,该基因编码运甲状腺素蛋白,以沉默所有可能存在编码区突变的mRNA。RNAi 沉默导致循环TTR 蛋白含量持续减少至30% 以下,有效阻止TTR 淀粉样蛋白的沉积。
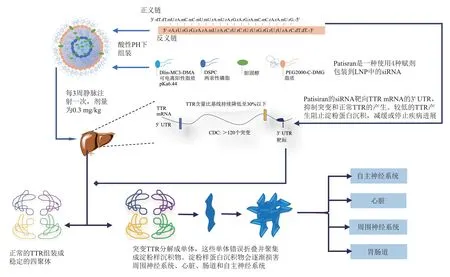
Fig.3 The therapeutic mechanism of Patisiran图3 Patisiran的治疗机制
在临床上测试了两代LNP 制剂:ALN‑TTR01和ALN‑TTR02。ALN‑TTR02(现在称为Patisiran)是一种“第二代”聚乙二醇化LNP,包含胆固醇、极性脂质(distearoylphosphatidylcholine,DSPC)、聚乙二醇脂质(PEG2000‑C‑DMG)和可电离的氨基脂质(DLin‑MC3‑DMA),在pH 值为7 时呈中性,但在酸性pH值下(最佳pKa为6.44)变为阳离子。siRNA‑LNPs通过在酸性pH下(当DLin‑MC3‑DMA 为阳离子时)siRNA 和脂质赋形剂之间的静电相互作用组装。组装后,LNP表面上的PEG2000脂质在储存过程中保持颗粒稳定性。在全身循环中,PEG2000‑C‑DMG 丢失并被血清蛋白,尤其是载脂蛋白E(apolipoprotein E,ApoE)取代,后者与掺入LNP 脂质基质的胆固醇分子相互作用。在肝脏中,肝细胞吸收被ApoE覆盖的LNPs,然后将其发送至内涵体,在内涵体的酸性pH 下引起氨基脂质成分的再离子化,从而导致颗粒分解。解体的脂质小球(借助DLin‑MC3‑DMA 展开的脂质尾部构型帮助)与内涵体膜之间发生静电和疏水相互作用,从而帮助siRNA逃逸到细胞质中。与使用较早的可离子化脂质(DLin‑DMA)ALN‑TTR01 相比,Patisiran在体内的效力提高了10倍以上。
Patisiran的III期、双盲、安慰剂对照临床试验(APOLLO)于2013年12月开始招募,共招募了225 例hATTR 多发性神经病患者。在研究过程中,一些患者接受了Patisiran,并将其结果与接受安慰剂的患者进行了比较。18个月后,接受Patisiran治疗的患者TTR 蛋白平均降低了84%。从研究开始到第18 个月,与服用安慰剂的患者相比,接受Patisiran的患者神经功能和生活质量显著改善。在接受Patisiran治疗的患者中,56%从研究开始就表现出神经功能的改善,而接受安慰剂的患者中仅有4%;51%从研究开始就表明生活质量得到了改善,而接受安慰剂的患者中仅有10%;对于神经功能未改善的患者,与接受安慰剂的患者相比,神经病变的进展得到减缓。
2.3 siRNA药物临床开发中的困难
siRNA药物临床开发的进步,促进了siRNA药物开发过程的日益成熟。但其中遇到的许多挫折,也使药物开发过程更加复杂。从中吸取的主要经验教训包括:使用正确的动物模型来预测药物安全性和药物活性;使赋形剂具有尽可能低的复杂性和毒性,以简化其制造、储存和临床测试过程;降低发生重大不良反应的风险[12]。使用正确的体外和体内模型准确预测药物毒性和效力至关重要。不同的模式生物对寡核苷酸和赋形剂可能有不同的反应。RNAi 药物的一个特殊问题是,它们的毒性和活性在很大程度上取决于动物模型转录组中存在或缺失的序列。在小鼠中不会引起脱靶效应的siRNA 很可能在人类中具有无法忍受的脱靶RNAi活性。相反,在沉默小鼠基因方面效果良好的siRNA 可能对人类基因几乎没有活性。
除此之外,需要考虑的重要因素是赋形剂(如纳米颗粒、聚合物、肽和蛋白质)的复杂性、均一性、稳定性、递送效率和毒性。脂质体和聚合物纳米颗粒已被广泛用于提高siRNA 的稳定性并改善药代动力学特性,但它们仍然面临一些生理屏障而导致递送效率降低,同时其规模化制造具有很大挑战性,并且所得产品通常在颗粒组成、颗粒特性和载药量方面具有一定程度的异质性,从而更难以在临床开发过程中建立治疗窗口。此外,颗粒在储存或给药后会变得不稳定,并释放分解产物,从而导致难以追踪的毒性。同样,尽管内涵体溶解赋形剂,如蜂毒肽,可以显著改善RNAi试剂的内涵体逃逸,但它们也可能具有潜在的毒性。2016年,Arrowhead公司报告称,他们的EX1赋形剂是一种修饰以聚乙二醇的GalNAc(N‑乙酰半乳糖胺)偶联的蜂毒肽样内涵体溶解肽,但是在安全性研究中,高剂量给药导致了几种非人类灵长类动物的死亡[12]。虽然试验动物死亡的确切原因尚未披露,但使用EX1 的3 种药物(ARC‑520、ARC‑521 和ARC‑AAT)的临床开发已停止,尽管它们的初步临床试验结果颇具前景。
3 siRNA纳米药物递送的主要挑战
RNA 干扰途径可以调控人类细胞中几乎所有mRNA的稳定性以及翻译过程。siRNA分子可以有效触发特定基因的RNA 干扰沉默,但是其治疗用途却面临着安全性和有效性的众多挑战[12]。高效与无毒的递送是siRNA 药物发挥作用的关键,并且是siRNA技术与其治疗应用之间的最大障碍。
siRNA递送的难易程度部分取决于体内靶器官或组织的可到达性[30]。局部siRNA 递送,即直接将siRNA 治疗应用于靶组织,具有许多好处,包括在接近靶组织的情况下,药物具有更高的生物利用度,以及与全身性给药相关的不良反应会大大减少。相比之下,全身递送意味着静脉注射递送纳米药物颗粒,然后在整个体内传播至靶器官或组织,这要求颗粒具有避免被非靶组织吸收和清除的能力。用于全身给药的siRNA 制剂在到达靶细胞的细胞质之前,在体内面临着一系列生理障碍。注射后,siRNA 复合物必须在机体的循环系统中航行,同时避免肾脏过滤、吞噬细胞摄取、血清蛋白聚集以及内源核酸酶的酶促降解。所以必须对递送系统进行改造,以具备对血清核酸酶的稳定性、逃避免疫系统、避免与血清蛋白和非靶细胞的非特异性相互作用、预防肾脏清除、从血管中出来到达靶组织、进入细胞和整合入RNA 干扰机制的能力(图4)[23,31‑32]。
siRNA递送首先要面临的挑战是血液循环中的降解及清除。在血管中,存在血清核酸酶降解、调理素介导的吞噬作用;此外,肾小球滤过以及siRNA与血清组分的非特异性结合都会导致siRNA在血液循环中不稳定,从而使其半衰期缩短(<10 min),最终阻碍siRNA在所需组织中的积累。裸露的siRNA 进入血液后,会被RNAase A 型血清核酸酶降解并刺激先天免疫系统[33‑36]。未经修饰的siRNA太大(~13 ku)且带有过多负电而无法穿过细胞膜[30,37‑38]。纳米颗粒载体具有克服血管内降解的潜力,并且可以安全有效地递送siRNA,通过被动或主动靶向增强药物在肿瘤部位的积累[39‑42]。与血清成分的相互作用可以多种方式影响siRNA 的递送。进入血液后,纳米粒子会遇到充满血浆蛋白和免疫细胞的复杂环境。循环中的免疫细胞(例如单核细胞、白细胞、血小板和树突状细胞)对纳米颗粒的摄取会通过各种途径发生,并且调理素在颗粒表面的吸附会促进纳米颗粒被摄取[43]。具有高表面正电荷的递送粒子可能会与红细胞发生不利的聚集[44]。血清调理素蛋白可能会吸附在递送载体颗粒的表面上,标记它们以供单核吞噬细胞系统(mononuclear phagocytic system,MPS)摄取[45]。MPS 的调理作用和随后的摄取是一种常见的途径,通过该途径可以清除血液中的递送系统并阻止其达到靶标[37]。另外,纳米颗粒表面的物理和化学性质,例如大小与表面电荷,可导致溶血、血栓形成和补体激活,从而导致生物分布改变以及潜在的毒性[43]。
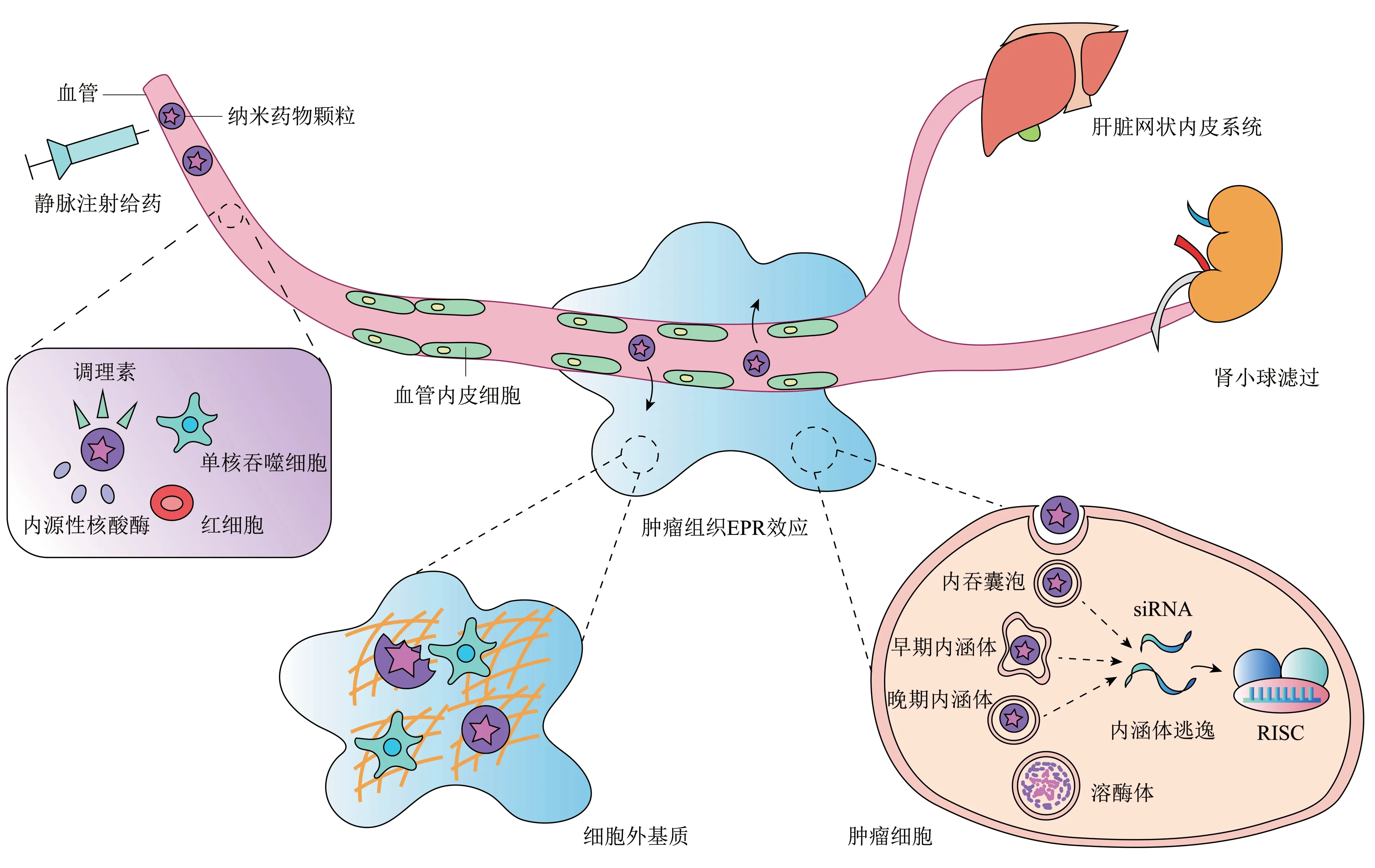
Fig.4 Overcoming the biological barriers of RNAi delivery图4 克服siRNA递送过程中的生理屏障
siRNA离开血液的一种主要途径是通过肾脏清除。肾小球提供了物理过滤屏障,可以使水和小分子进入新生尿液中,而大分子则保留在循环中[46]。肾小球滤过屏障的孔径约为8 nm[47‑48]。裸露的siRNA 长度约为7~8 nm,直径约为2~3 nm。该分子太大,无法穿过细胞膜,但又小到足以被肾小球清除[49]。因此,一旦siRNA 离开血液,它们将在膀胱中积聚,并在几分钟至半小时内迅速从体内排出,从而阻止了它们在靶组织或细胞中的积累[26,50]。同时,一些纳米颗粒递送系统易在肾小球中发生分解。例如,当与肾小球基底膜的带负电荷的蛋白聚糖接触时,由静电相互作用形成的颗粒可能会破裂,从而使siRNA“货物”被过滤到尿液中[51‑52]。
从血液中流出并穿过血管内皮屏障对将siRNA递送至体内许多组织提出了重大挑战。没有被肾脏降解、吞噬或清除的siRNA递送系统必须通过穿越血管内皮到达其他组织而离开血流。毛细血管孔尺寸限制了外渗颗粒的尺寸上限。通常,直径大于5 nm 的分子不易穿过毛细血管内皮,因此将保留在循环系统中,直到从身体清除为止[30]。但是,某些内皮不连续的组织允许较大的分子进入,包括肝脏、脾脏和一些肿瘤[23]。这些器官允许直径高达200 nm 的分子通过,可以容纳典型的药物递送纳米载体。肝内皮的窗孔使直径为100~200 nm 的分子从血流中扩散出来,并进入肝细胞[53‑54]。
组织渗透也是siRNA给药的困难所在。纳米药物在肿瘤部位的穿透性差主要是由于肿瘤微环境,同时也与纳米颗粒的性质有关。为了将siRNA安全有效地递送至目标mRNA,必须协调许多变量。尽管纳米颗粒的大小在1~1 000 nm 范围变化,但已经清楚的是,直径大于100 nm 的静脉内注射颗粒很可能会被网状内皮系统(reticuloendothelial system,RES)截留在肝、脾、肺和骨髓中,导致被活化的单核细胞和巨噬细胞降解。与正常毛细血管相比,肿瘤血管的形状不规则,存在缺陷,渗漏且宽度不等[55]。肿瘤周围有足够的异源血供,但肿瘤中心的异源血供减少,这就要求纳米颗粒向肿瘤中心移动的距离增加[56]。实体瘤中较高的组织液压力也会对纳米颗粒的扩散提出挑战。组织液压力(interstitial fluid pressure,IFP)从肿瘤外周向肿瘤中心升高,阻碍了纳米颗粒从外周血管渗出后向肿瘤深部扩散[57]。
肿瘤微环境中的细胞外影响因素也对siRNA递送提出挑战。siRNA复合物离开血流后,必须穿过复杂的细胞外基质(extracellular matrix,ECM)才能到达癌细胞。细胞外基质是由多糖和纤维蛋白组成的致密网络,可对大分子和纳米颗粒的运输产生抵抗力[58‑61]。这会减缓甚至停止药物递送过程,并为纳米颗粒被驻留巨噬细胞摄取提供了额外的机会。吞噬作用在血流中与组织的细胞外基质中都是重要的免疫屏障。吞噬细胞(例如巨噬细胞和单核细胞)从体内清除异物,以防止病毒、细菌和真菌感染。但与此同时,吞噬细胞也会从体内有效地去除某些治疗性纳米复合物和大分子,所以在设计药物输送载体时必须采取措施以避免调理作用[31]。与胰腺癌有关的结缔组织增生是复杂的肿瘤微环境在达到药物治疗浓度方面提出挑战的一个很好的例子[62]。ECM的生物学、化学和物理特性可能导致纳米颗粒提前解体并释放其内含物。与中性纳米颗粒相比,带有正电荷或负电荷的粒子更常发生巨噬细胞的吞噬作用,例如被肝脏中的库普弗细胞或淋巴结中的树突状细胞摄取[43]。除了巨噬细胞的吞噬作用之外,嗜中性粒细胞也会捕获纳米颗粒[63]。
细胞内运输是siRNA 递送的最后一道关卡。大多数siRNA 递送系统通过内吞作用进行细胞内化。颗粒被靶细胞摄取后,必须逃逸内涵体以到达细胞质[64]。如果siRNA 纳米复合物无法逃逸出内涵体,它将通过pH不断降低的内膜隔室进行运输,并在溶酶体中发生降解[65]。一旦被内吞,胞内运输即开始于早期的内吞囊泡。这些囊泡随后与早期内涵体融合,并进一步成熟为晚期内涵体[66]。这些晚期内涵体会被膜结合的质子泵ATPase 酸化(pH5~6)。晚期内涵体的内容物被重新分配到溶酶体中,然后被进一步酸化(pH4.5)。并且溶酶体中含有可降解siRNA 的核酸酶。因此,如果在这些后期事件之前未发生内涵体逃逸,则不会发生RNA 干扰[67]。siRNA 必须有效地从内涵体和溶酶体逃逸到细胞质,随后将siRNA 的反义链装载到RISC中。
最后,到达细胞质后,必须将siRNA 从载体释放,并整合入RISC中以触发RNA干扰。优先将5'端杂交最不稳定的siRNA 链装入RISC,另一条链被降解。在siRNA 递送系统中,通常避免将递送材料附着到反义链的5'端,因为该端对于RISC装载至关重要。必须谨慎选择siRNA 骨架修饰和siRNA 序列,以确保RISC 能够正确选择链,并避免与非靶标mRNA 部分杂交,这可能会导致基因沉默脱靶[37]。
因此,如何克服siRNA 药物在体内的运输困难并成功发挥作用也成为siRNA 药物开发中的一个重要课题。其中,开发有效的siRNA 药物纳米载体进行辅助是一个可行的解决方案,在此方面已有不少siRNA纳米药物载体被成功研制[68]。
4 设计siRNA药物纳米载体的主要策略
siRNA 作为药物存在半衰期短、血浆稳定性差、易被核酸酶降解,且siRNA 带负电荷不易透过带负电荷的细胞膜进入肿瘤细胞,容易被细胞内的溶酶体降解[69]。因此,siRNA 作为药物很难直接用于疾病治疗,需要采取一定的手段实现其在生物体内的有效递送并达到治疗疾病的目的。其中,利用纳米载体构建siRNA 药物纳米递送系统进行siRNA药物的递送是实现siRNA药物进行治疗时的常用手段。
siRNA药物纳米递送系统成功发挥作用的关键在于其能通克服递送过程中的生理屏障以及内源性核酸酶降解,使siRNA 药物成功递送进靶细胞并有效发挥治疗效果。基于上述作用机制,siRNA药物纳米递送系统的设计主要分为两部分:一是采取不同的方式构建不同材料、尺寸与结构的siRNA药物纳米递送系统,实现siRNA 药物递送系统对siRNA药物的装载;二是对纳米递送系统进行表面修饰、分散与保存,对siRNA 药物纳米递送系统进行优化,使其能实现更好地siRNA 药物递送。目前,表面修饰是对包括siRNA 药物纳米递送系统在内的纳米递送系统进行优化的常用手段,例如,利用PEG[70]进行亲水修饰以延长siRNA药物输递体系的血液循环时间;利用富含精氨酸(arginine,Arg)的细胞穿透肽进行修饰用以增强细胞对siRNA 药物的内吞,因为在生理条件下,每个精氨酸残基都含有一个带正电荷的胍基,胍基可以通过其平面结构与细胞膜相互作用,从而促进膜的渗透;利用含有咪唑环的组氨酸进行修饰,并利用其在微酸环境中产生的“质子海绵效应”促进siRNA 药物溶酶体逃逸[71]等。为增强这种逃逸作用,许多递送系统采用pH 敏感单元来响应内涵体和溶酶体中的pH变化,递送材料会吸收H+,在表面上呈现正电荷。随后,内涵体或溶酶体中的渗透压将增加,导致Cl-和H2O 的内流。最后,这些变化会导致膜渗透性增加,使siRNA 释放到细胞质中,这种设计可以很好地帮助siRNA药物实现内涵体或溶酶体逃逸。同时根据不同组织的不同特性,可以采取相应的措施增强siRNA 药物的有效递送。例如,在肿瘤中,高渗透性内皮细胞伴随着不良的淋巴引流,导致恶性组织中循环纳米颗粒的积累更多,这被称为增强的渗透和滞留(enhanced permeability and retention,EPR)效应,可以利用和增强该特性来改善纳米颗粒的递送[72‑73]。直径小于100 nm 的纳米颗粒被认为是肿瘤内递送和避免RES 清除的最佳选择[74]。与此类似,针对不同组织的不同生理特征可以设计不同的优化策略。
纳米递送系统的优化手段根据不同的生理组织特异性和递送要求具有不同的方法。目前,siRNA药物纳米载体的构建主要有4种不同的策略,本节将对这4种siRNA药物纳米载体的构建思路及方式进行介绍。
4.1 纳米载体表面装载siRNA药物
先设计合成纳米载体,之后将siRNA药物装载到载体表面构建siRNA 药物纳米递送系统是帮助siRNA药物突破生理限制,成功发挥作用的常用方法之一。此种方法主要通过静电作用实现纳米载体对siRNA 药物的装载,由于siRNA 带有负电荷,因此一般要求纳米载体表面带正电。目前可用于表面装载siRNA的纳米载体主要有自身带有正电荷的纳 米 载 体 和 利 用 精 氨 酸 、 乙 二 胺(ethylenediamine,EDA)或N,N‑二甲基乙二胺(N,N’‑Dimethylethylenediamine,DMA)等进行修饰形成的表面带有正电荷的纳米载体。
自身带有正电荷的纳米载体包括带正电荷的聚合物、树状分子[75]、阳离子胶束[76]和一些自身带有正电荷的蛋白质[77]等。如,Liu等[78]利用聚酰胺‑胺类树状分子(PAMAM)递送siRNA:阳离子PAMAM树形分子表面大量的胺基基团可以通过静电相互作用结合siRNA并形成稳定纳米粒,从而有效保护siRNA,避免其被核酶降解;然后,siRNA/树状分子复合物纳米粒经内吞途径被细胞摄取,被内化的纳米粒主要聚集在酸性细胞器中,如内涵体和溶酶体;树状分子结构中存在大量叔胺基团,使其具备很强的pH 缓冲能力,可通过“质子海绵”效应实现内涵体或溶酶体逃逸,从而促进siRNA的释放,达到基因沉默效果。
自身不带电荷或带负电荷的纳米载体,可以用精氨酸、乙二胺等物质进行修饰使其表面带正电荷,进而进行siRNA 药物的递送,发挥其治疗效果。如,Kara等[79]利用精氨酸修饰磷酸钙(CaP)纳米颗粒,使纳米颗粒表面带正电荷,提高纳米颗粒对带负电荷siRNA 的负载(图5)。他们合成了两种不同化学和形态特征的精氨酸修饰的CaP纳米颗粒,作为针对survivin (凋亡抑制基因) 和cyclin B1 (周期素B1 基因) 沉默的两种特定siRNA 载体。survivin 和cyclin B1 在癌症发生发展中起促进作用,Kara 等[79]利用A549 非小细胞肺癌(non‑small‑cell lung cancer,NSCLC)细胞进行实验,发现CaP‑Arg‑siRNA介导抑制这些基因导致细胞生长明显减少,诱导细胞凋亡。CaP 作为载体,具有生物相容性好、制备简单、对RNA 的亲和力高等优点。此外,在细胞早期溶酶体内,CaP经内吞后在低pH下降解为离子,导致渗透压升高。这种压力的增加也支持siRNA 进入细胞质的逃逸。所有这些原因使CaP 纳米颗粒成为合适且安全的siRNA药物载体[80]。
4.2 siRNA药物与纳米载体共组装
为了进一步提高siRNA负载量、稳定性以及调控其内涵体或溶酶体内释放,可以将siRNA与载体共组装成纳米递送系统。共组装的主要原理是基于siRNA与载体的各种相互作用,其中静电相互作用是一种利用较多的组装方式。因为siRNA带有较高的负电荷,所以此种方法使用的载体材料多为聚阳离子载体,例如阳离子化金纳米簇、阳离子脂质载体等。
利用聚阳离子脂质可以静电结合siRNA的能力形成纳米大小的复合物,从而增强细胞的吸收。Akin等[81]开发了以一种新型类脂材料98N12‑5(1)为载体,用于在体内向肝细胞递送siRNA的siRNA递送系统。首先利用脂质体的自组装能力以及与siRNA的静电相互作用进行共组装,将siRNA包载在纳米复合物中。随后在外部修饰PEG,这样有助于防止聚集,促进纳米载体的稳定性,并增加血液循环时间。得到的球状纳米复合物通过内吞作用进入细胞,然后会破坏内涵体膜或通过内涵体“质子海绵”[82]机制引起内涵体破裂,使siRNA 成功在细胞内释放,并且通过调控复合物中各组分的比例,可以使得最多的siRNA被负载与递送。
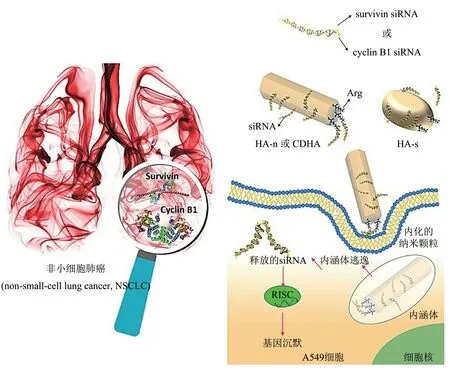
Fig.5 Schematic diagram of the process of three different CaP-Arg nanoparticles delivering siRNA for the treatment of NSCLC[80]图5 三种不同CaP-Arg纳米粒子递送siRNA治疗NSCLC的过程示意图[80]
利用阳离子载体与siRNA带有负电的特性,胡献丽等[83]设计了荧光阳离子化金纳米簇(cationic gold nanocluster,CGN)与siRNA通过静电作用共组装形成纳米递送系统。其设计原理为以牛血清白蛋白(bovine serum albumin,BSA)为模板,通过还原四氯金酸(HAuCl4),合成可发射近红外荧光的GN。随后在1‑乙基‑3‑(3‑二甲基氨丙基)‑碳化二亚胺(EDC)和N‑羟基琥珀酰亚胺(NHS)的活化作用下, 乙二胺或二甲基乙酰胺(dimethylacetamide,DMA)能与GN 表面BSA 上的谷氨酸等残基反应,使BSA‑GN阳离子化,并与siRNA通过静电相互作用进行共组装。形成的纳米复合物经细胞摄取后进入酸性内涵体,内涵体的酸性pH 环境使EDA或DMA上的胺基质子化,利用“质子海绵”效应[83]使内涵体破裂并释放siRNA,实现siRNA 的有效递送,并高效沉默目标基因。这种纳米复合物的尺寸远大于单独的siRNA 尺寸,避免被肾脏在短时间内清除,并且利用质子海绵效应可以成功在细胞内释放。
为进一步提高siRNA 纳米药物在病变组织内的累积,设计构具有靶向性的siRNA 纳米药物载体具有重要的价值。Yang等[84]研究设计了球形纳米复合物HA‑PEG/MDR1 siRNA。该复合物使用能够靶向CD44(cluster of differentiation 44)的透明质酸(hyaluronic acid,HA)作为载体。CD44 是一个多功能跨膜糖蛋白家族,是HA的主要细胞表面受体,在乳腺癌等恶性肿瘤细胞膜上高表达。对HA修饰PEG和PEI(聚乙烯亚胺),PEG能够延长siRNA 的体内循环时间和防止聚集,PEI 带有高密度正电荷和siRNA 之间形成静电相互作用,包裹抗MDR1‑siRNA基因用于乳腺癌疾病的靶向递药。多药耐药基因1 (multidrug resistance gene 1,MDR1)以及P 糖蛋白(P‑glycoprotein,Pgp)的过表达是多药耐药性(multidrug resistance,MDR)发展重要原因,将这种药物成功转入癌细胞中,可以抑制MDR1和Pgp的表达,使得治疗乳腺癌的药物如紫杉醇等能够长时间对病人产生效果,抑制MDR 现象。并且这种纳米复合物包裹siRNA 防止其在人体内被降解、被清除,提高siRNA 的整体递送效率。
4.3 纳米载体包裹siRNA药物
为了更好地保护siRNA、增加体内循环时间及在肿瘤组织内的累计,将siRNA 直接包裹在纳米胶囊、高分子胶束等纳米载体内部,也是一个值得开发的纳米递送系统[85]。下文将详细介绍如何利用这种方法构建siRNA纳米递送系统,提高基因沉默的效率。
利用阳离子脂质体与siRNA 的经典相互作用力,Zhao 等[86]使用表面修饰聚乙二醇‑聚乳酸‑羟基 乙 酸 共 聚 物(polyethylene glycol‑block‑poly(D,L‑lactide‑co‑glycolide)‑block, PEG‑b‑PLGA)阳离子脂辅助纳米颗粒(cationic lipid‑assisted nanoparticle,CLAN) 封装靶向布鲁顿酪氨酸激酶(Bruton’s tyrosine kinase,BTK) 的siRNA(siBTK)用于治疗类风湿性关节炎(rheumatoid arthritis,RA)。BTK已经被证实是有效治疗RA的一个靶点,然而有效抑制BTK 需要高剂量的BTK抑制剂,所以这就要求递送BTK 抑制剂的体系需要尽量减少人体内免疫系统的清除作用以及肾小球的滤过作用等对药物递送效率的影响。而使用CLAN 封 装 靶 向 BTK 的 siRNA (CLAN‑encapsulated siRNA that targets BTK,CLANsiBTK)递送体系可以实现BTK 抑制剂的有效递送。利用静电相互作用力,阳离子脂质体将带有负电荷的siRNA 包裹在内部,而表面具有亲水修饰的PEG,这样可以延长siRNA 药物输递体系的血液循环时间,成功抑制BTK活性,为RA治疗提供了一个很好的替代方案。
类似地,利用脂质体的亲水内核与疏水脂质双层特性,Yadav 等[87]制备构造了纳米球状结构脂质载体,包被抗IL17A‑siRNA 与丙酸氯倍他索(clobetasol propionate,CP)药物用于治疗银屑病。IL‑17A 基因与银屑病的发病密切相关,其会促进和加速表皮角质形成细胞的增殖,导致表皮增生、表皮内嗜中性微脓肿等病变。利用磷脂双层自组装形成的球形内核具有亲水性将抗IL17A‑siRNA包裹在内部,脂质双层分子之间具有的亲脂性将脂溶性CP 药物成功搭载在纳米脂质体上。这种纳米脂质复合物有效克服了裸露siRNA递送中皮肤产生的阻碍、不良的物理化学特征以及内源性酶降解倾向,并且具有双重输送核酸和抗炎皮质类固醇的能力,可实现多靶点治疗并通过多种机制发挥作用,最终达到治疗效果的增强。
利用前面提到的共组装策略将siRNA与两亲性阳离子分子或药物复合形成疏水纳米复合物,从而可利用两亲性聚合物胶束将其包裹在内部而形成纳米递送系统。Saw 等[85]首先设计合成基于MTO(具有阳离子特性的抗肿瘤药物米托蒽醒,mitoxantrone)的两亲性阳离子前药SA‑MTO,随后通过静电作用与siRNA形成疏水纳米复合物(图6)。这些siRNA/SA‑MTO 复合物可被包裹在由肿瘤组织弱酸微环境响应的两亲性高分子材料Meo‑PEG‑b‑PPMEMA(甲氧基‑聚(乙二醇)‑b‑聚(2‑(五亚甲基亚胺)甲基丙烯酸乙酯)形成的纳米胶束的疏水性内核中。该纳米载体用于siRNA的体内递送时具有“多级逐步递送”(multistaged delivery)的特性。首先纳米载体通过血液循环并利用肿瘤增强渗透滞留效应,富集在荷瘤小鼠的肿瘤部位。随后肿瘤组织弱酸微环境会引起PPMEMA链的质子化,导致纳米载体结构的解散和siRNA/SA‑MTO 复合物的快速释放。然后siRNA/SA‑MTO 复合物利用其尺寸较小的特性,深度穿透肿瘤组织并进入肿瘤细胞,减小致密的细胞外基质对于药物递送的影响。最后肿瘤细胞中高表达的脂酶会降解SA‑MTO,使得siRNA和MTO在胞浆内快速释放,siRNA 可以用于沉默癌基因,MTO 可以抑制DNA链复制,实现siRNA 与化疗药物在细胞内的成功共递送。

Fig.6 Schematic illustration of the TME pH-responsive polymer-prodrug hybrid nanoplatform for multistage siRNA delivery and combination cancer therapy[85]图6 构建的纳米载体用于siRNA体内递送时利用其肿瘤组织弱酸微环境响应性促进基因沉默和联合抑制肿瘤生长示意图[85]
为了提高纳米递送系统的靶向能力和肿瘤微环境响应释放能力,通过响应性载体设计策略,并在纳米载体表面修饰特定肽段,得到更加高效的siRNA 纳米递送药物。例如,Li 等[88]设计制备了一种响应肿瘤微环境活性氧(reactive oxygen species,ROS)的纳米载体用于血管内皮生长因子siRNA (vascular endothelial growth factor siRNA,siVEGF)的体内递送和结肠癌治疗(图7)。首先制备由苯硼酸修饰的聚N,N‑二乙基丙烯酸氨基乙酯(PDP)与siRNA共同组装的纳米复合物,在利用 二 油 酰 基 卵 磷 脂(1,2‑dioleoyl‑sn‑glycero‑3‑phosphocholine,DOPC)、二油酰基磷脂酸(1,2‑dioleoyl‑sn‑glycero‑3‑phosphate,DOPA)和二硬脂酰基磷脂酰乙醇胺‑聚乙二醇(1,2‑distearoyl‑sn‑glycero‑3‑phosphoethanol‑amine N‑[methoxy(polyethylene glycol)‑2000],DSPE‑PEG)形成脂质包裹。其中聚阳离子高分子材料PDP 可通过静电作用将siRNA包载在纳米载体中,而DSPE‑PEG上的PEG 链段能够延长siRNA 的体内循环时间。最后,为了增强上述纳米载体的肿瘤细胞靶向能力和内涵体逃逸性能,将具有肿瘤细胞靶向和膜穿透功能的1 型人免疫缺陷病毒转录激活因子(human immunodeficiency virus‑1 transcription activator,HIV‑1 TAT)修饰到纳米载体表面。在肿瘤组织中,纳米载体会利用其表面修饰的TAT 肽靶向肿瘤细胞并携带siRNA 进入胞浆。在肿瘤细胞内高浓度ROS 会导致聚阳离子材料PDP 的分解,从而释放siRNA,从而能够显著提高siVEGF 在胞浆内的释放和沉默靶基因的效率。
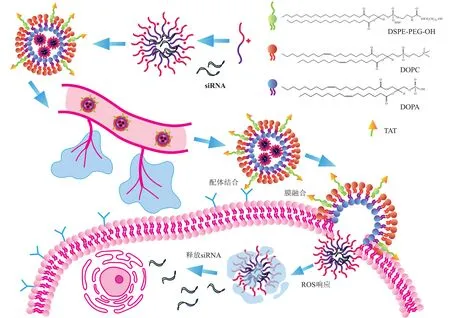
Fig.7 Schematic illustration of a lipid-coated ROS-responsive assembly for siRNA delivery图7 用于siRNA递送的脂包覆ROS响应组装体示意图
4.4 siRNA自组装实现siRNA药物的高效递送
近年来,一种新的siRNA药物递送策略逐渐受到关注——核酸自组装体用于siRNA药物递送,主要有3种方法。一是通过siRNA之间偶联自组装形成负电荷密度较高siRNA多聚体,再借助阳离子载体实现siRNA药物高效递送。二是由寡核苷酸自组装构建载体,并通过与siRNA药物杂交形成纳米核酸药物,这种方法的优点是大多不需要借助阳离子载体即可被细胞摄取。三是设计包含有siRNA模板序列的环状DNA,通过滚环转录技术形成Poly‑RNA。Poly‑RNA 再进一步自组装成RNA 纳米微球,该方法能够大大提高siRNA的装载量,降低由于阳离子载体和siRNA药物过量使用而引起的细胞毒性,同时紧凑致密的纳米结构增强了siRNA的核酸酶稳定性[89]。
5 总结与展望
siRNA 作为一种新型药物,由于其高效[90]、特异性强、治疗效果易检测等一系列优势正在逐渐受到研究人员的重视,设计合适的siRNA药物纳米载体是实现siRNA药物成功递送并发挥作用的重要一环,有关研究也在逐年增加。现阶段,利用纳米载体实现siRNA 药物递送已经取得了很大的发展,但仍存在一些问题需要研究人员进一步攻克。siRNA药物应用于临床时,依然存在靶向药物结构设计不精准、脱靶效应严重、内涵体逃逸难以实现、纳米载体大规模制备困难等问题。
siRNA 作为药物通过RNA 干扰特异性诱导基因沉默而发挥作用,在病毒感染、癌症、家族遗传疾病和自身免疫性疾病等方面被广泛应用。siRNA单独使用或与化疗等抗肿瘤药物共递送用于癌症治疗相对于传统药物表现出更大的应用潜力,具有可设计靶向、合成方便、瞬时沉默、靶点特异性强等优势,但其递送也面临着在血液循环中易被降解、被肾脏清除、难以突破血管内皮/细胞膜/溶酶体屏障等问题。设计合适的纳米载体达到siRNA药物的成功递送是siRNA 药物领域的研究热点,目前siRNA药物纳米载体的设计主要有纳米载体表面装载siRNA药物、siRNA药物与纳米载体共组装、纳米载体包裹siRNA 药物以及siRNA 自组装4 种策略。但由于siRNA药物普遍存在大批量制备困难的问题,目前仅有3种siRNA药物获批上市。
如何进行siRNA 药物大规模制备是siRNA 药物应用于临床面临的一大难题并将成为研究热点。同时随着计算机技术的发展,结合人工智能、机器学习等技术,借助大数据分析进行药物设计正在成为新的研发趋势。对siRNA纳米药物进行智能设计和精准调控,设计集靶向、示踪、与其他药物共递送于一体的多功能siRNA 纳米药物实现协同增效,同样是未来siRNA纳米药物的发展方向之一。
附件 PIBB_20210102_Doc_S1.pdf 见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net)。

