核酸适配体介导的肿瘤免疫治疗研究进展*
周灵丽 叶 茂
(湖南大学生物学院,长沙 410082)
近年来随着肿瘤免疫学理论和生物技术的发展,肿瘤治疗方式不再局限于传统的手术治疗、放疗和化疗,免疫治疗已成为克服肿瘤的一种新方法。从2011年《自然》(Nature)期刊宣称“免疫治疗的时代已经到来”,到2018年将诺贝尔生理或医学奖授予美国的詹姆斯·艾莉森(James P Allison)与日本的本庶佑(Tasuku Honjo)以表彰他们在人类肿瘤免疫治疗方面的贡献,都意味着不断发展的免疫治疗将成为肿瘤治疗的重要手段[1]。抗体类药物是肿瘤免疫治疗的主要方式并在临床上广泛应用,但抗体价格昂贵、免疫原性高、存在引起细胞因子风暴的风险。具有“化学抗体”美称的核酸适配体特异性高、易合成且价格实惠、免疫原性低且体内应用更安全,因此在肿瘤免疫治疗中具有较好的应用前景。
1 肿瘤免疫治疗
免疫系统包括先天性免疫和适应性免疫。先天性免疫系统的免疫细胞负责吞噬杀灭外来病原体,识别与杀死受损内源细胞。而由体液免疫和细胞免疫组成的适应性免疫系统则通过产生特异性抗体来保护机体,或通过抗原特异性的细胞毒性T细胞直接杀死病变细胞[2]。肿瘤免疫治疗则通过激活机体免疫系统,克服肿瘤微环境的免疫抑制作用来增强抗肿瘤免疫应答能力。现阶段肿瘤免疫治疗手段主要包括:肿瘤疫苗、过继性细胞免疫治疗以及抗体治疗等[3]。肿瘤疫苗主要利用肿瘤细胞、肿瘤抗原以及编码抗原的核酸等,诱导机体产生特异的抗肿瘤免疫效应,按功能可以分为预防性疫苗和治疗性疫苗,例如2006年美国食品药品管理局(food and drug administration,FDA)批准首款人乳头状瘤病毒疫苗Gardasil 用于预防宫颈癌,于2010年批准了首款树突状细胞疫苗Sipuleucel‑T 用于治疗转移性前列腺癌[4‑5]。而过继性细胞免疫治疗是指将自体或异体T细胞或NK细胞在体外激活后,回输到体内发挥抗肿瘤免疫作用。其中基于抗原抗体的特异性识别作用,使用基因编辑技术构建的嵌合抗原受体T 细胞(chimeric antigen receptor T‑cell,CAR‑T)药物Kymriah 和Yescarta 已获批上市被用于治疗复发或难治性急性B系淋巴细胞白血病和大B细胞淋巴瘤。肿瘤免疫治疗中应用最广泛的方式是抗体治疗,利用抗体靶向肿瘤相关抗原,靶向免疫检查点分子或共刺激受体来调控机体免疫系统。其中靶向免疫检查点的单克隆抗体药物在肿瘤免疫治疗中发挥重要作用,FDA共批准了7种免疫检查点抑制剂类药物用来治疗癌症,包括1款靶向细胞毒性T 淋巴细胞相关蛋白4 (cytotoxic T‑lymphocyte associated protein 4,CTLA‑4)的单抗和6 款针对程序性死亡蛋白1(programmed cell death 1 receptor,PD‑1)及其配体程序性死亡蛋白配体1(programmed cell death 1 ligand 1,PD‑L1)的单抗[6]。这些抗体类药物虽能有效发挥抗肿瘤作用,但大部分患者在使用过程中面临药物不响应的问题,只对小部分患者有用,且在重复给药的治疗过程中会产生耐药性,同时也面临自身免疫毒性风险[7]。
2 免疫相关核酸适配体的筛选
核酸适配体作为新型靶向配体也可以通过结合免疫相关受体调控机体的抗肿瘤免疫反应,有望在肿瘤免疫治疗领域发挥作用。核酸适配体是指通过指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX),从人工合成的寡核苷酸文库中筛选得到的能与靶标特异结合的一小段ssDNA 或者ssRNA序列,筛选流程如图1。核酸适配体可以折叠成特定的二级或三级结构、通过氢键、疏水作用力、范德华力等非共价作用力与小分子、多肽、蛋白质、病毒、细胞、细菌甚至组织等靶标特异结合[8]。基于此,核酸适配体已成为疾病诊断和靶向治疗的有力工具,例如:2004年,第一个核酸适配体药物Macugen 被FDA 批准用于治疗老年性黄斑变性[9]。2019年,由香港浸会大学研究团队研发的骨硬化蛋白核酸适配体药物(DRU‑2019‑6966)已通过FDA授予孤儿药认证,用以治疗成骨不全症。已有研究表明核酸适配体可作为肿瘤相关抗原、免疫检查点分子、共刺激受体、细胞因子的新型靶向配体直接用于肿瘤免疫治疗,也可以与药物、siRNA、纳米材料偶联,或将核酸适配体修饰于细胞膜表面来发挥抗肿瘤作用。表1总结了在肿瘤免疫治疗中发挥作用的相关核酸适配体。
2.1 靶向免疫检查点的核酸适配体
免疫检查点分子是一类免疫活性调控受体,如免疫抑制性受体CTLA‑4 和PD‑1 在肿瘤微环境(tumor microenvironment,TME)中明显过表达,通过触发免疫抑制信号传导途径导致肿瘤免疫逃逸[7]。而靶向抑制免疫检查点分子,重新激活细胞毒性T细胞被称为免疫检查点封锁,是一种触发抗肿瘤免疫反应的有效手段。
2003年,首次筛选到能靶向结合免疫受体CTLA‑4 的RNA 核酸适配体Del 60,并发现Del 60能抑制CTLA‑4 增强小鼠的抗肿瘤免疫反应[10]。核酸适配体在肿瘤免疫治疗领域崭露头角,使得大批科研人员开始致力于筛选具有功能的免疫相关核酸适配体,期望利用核酸适配体进行肿瘤免疫调控。随后发现的靶向CTLA‑4 的DNA 核酸适配体aptCTLA‑4能促进T细胞增殖,且其肿瘤抑制效果与CTLA‑4单抗相媲美,并未见明显肝肾毒性,具有良好临床应用前景[11]。
PD‑1/PD‑L1 轴是涉及肿瘤免疫逃逸的主要途径之一,靶向结合鼠PD‑1蛋白的DNA核酸适配体MP7 拮抗PD‑1/PD‑L1 的结合并减弱PD‑L1 对原代T 细胞分泌白介素‑2(interleukin‑2,IL‑2)的抑制作用。MP7 的聚乙二醇(polyethylene glycol,PEG)化形式的半衰期更长,其抗肿瘤作用与PD‑1抗体不相上下[12]。利用人PD‑1重组蛋白筛选出的XA‑PD‑1‑78 具有与PD‑1 抗体相似的结合功能,但却不具有生物学功能[13]。最近针对人PD‑1蛋白又筛选出两条核酸适配体,分别是C42 和PD4S,其中C42 是通过杂交SELEX 筛选而来,即先进行蛋白质筛选再利用高表达PD‑1 的Jurkat 细胞进行细胞筛选。C42虽然能很好地结合天然构象的PD‑1蛋白,但却不能诱导CD8+T细胞增殖和细胞因 子 产 生[14]。而 利用cell‑SELEX 筛 选 得 到 的PD4S适配体可以解除PD‑1/PD‑L1轴对T细胞的免疫抑制作用,且经胆固醇修饰后的PD4S具有更好的生物稳定性,在CT26肿瘤模型中显示出较好的抗肿瘤作用[15]。近年来,针对PD‑L1 蛋白也筛选了许多核酸适配体,例如核酸适配体aptPD‑L1 能特异性结合PD‑L1 从而调节TME,增加浸润性CD4+和CD8+T 细胞,使肿瘤内IL‑2、肿瘤坏死因子‑α、干扰素‑γ(interferon‑γ,IFN‑γ)和C‑X‑C基序趋化因子CXCL9 和CXCL10 的水平升高从而抑制体内肿瘤的生长[16]。最近,通过cell‑SELEX 筛选得到了核酸适配体XQ‑P3和PL1,其中XQ‑P3高亲和力结合PD‑L1,且在体外能激活T细胞的免疫功能[17]。而PL1能诱导T细胞的增殖和IFN‑γ的释放,有效抑制CT26结肠癌的生长[18]。天然核酸在机体内容易被核酸酶所降解,需要对筛选得到的核酸适配体进行修饰来提高其稳定性或者在筛选前就对文库进行修饰。从一种含有非天然糖环苏糖核酸(TNA)文库中筛选得到的TNA 适配体N5 阻断PD‑1与PD‑L1结合的效果优于AptPD‑L1且稳定性好。N5 能特异性地聚集在结肠癌异种移植小鼠肿瘤部位抑制肿瘤生长,有潜力发展为免疫治疗药物[19]。PD‑1/PD‑L1 轴的信号阻断治疗方式的前提是肿瘤组织中PD‑L1 的高表达,目前主要利用PD‑L1 抗体来检测肿瘤组织中PD‑L1 的表达水平,但是抗体因批次不稳定其检测结果也受到影响。核酸适配体在检测方面同样可以与抗体竞争,例如PD‑L1 的核酸适配体XA‑PDL1‑82 和Clon‑3,其中XA‑PDL1‑82可以检测胰腺癌肿瘤细胞、组织切片上PD‑L1 的表达[13],而通过Modular‑SELEX 筛选得到的Clon‑3 不仅可以检测各种肿瘤细胞、组织切片中PD‑L1的表达,而且检测结果稳定,有望用于临床检测[20]。
CTLA‑4或PD‑1/PD‑L1信号途径的阻断只对部分癌症患者有效,针对其他免疫检查点受体进行阻断治疗也具有重要意义,例如T细胞免疫球蛋白黏蛋 白3 (T‑cell immunoglobulin mucin 3,TIM‑3)和淋巴细胞激活基因3 (lymphocyte activation gene‑3,LAG3)[21]。TIM‑3 和LAG3 在衰竭的T 细胞中与PD‑1 一起表达,已筛选的TIM‑3 核酸适配体的三聚体形式能比TIM‑3 抗体更有效的抑制CT26小鼠模型肿瘤的生长[22]。LAG3 RNA核酸适配体可促进CD4+和CD8+淋巴细胞的活化与增殖[23]。
2.2 靶向免疫共刺激受体的核酸适配体
T细胞表面除表达免疫抑制性受体外还表达免疫共刺激受体,两者共同调控T 细胞的免疫反应。大多数参与免疫反应的受体都需要交联形成二聚或多聚体来启动信号级联,因此推测二聚或多聚体形式的核酸适配体更有可能激活共刺激受体。共刺激分子包括B7/CD28 和TNF 两大家族,其中4‑1BB、OX40和CD40属于TNF家族成员,而CD28是负责T细胞正常活化的的共刺激受体,属于B7/CD28家族。已筛选得到的4‑1BB核酸适配体的二聚或多聚形式才能激活4‑1BB 受体,诱导T 细胞活化[24]。类似的,靶向鼠OX40 的RNA 适配体的二聚化形式能激活T细胞,与树突状细胞疫苗联用提高了黑素瘤小鼠的存活率[25]。靶向人OX40的核酸适配体的多价形式能促进T 细胞增殖,刺激IFN‑γ 的产生[26]。CD40Apt3 是 能 特 异 性 靶 向CD40 的2'‑氟RNA 核酸适配体且被证明能抑制B 淋巴瘤细胞的增殖,抑制肿瘤生长[27]。此外,筛选到两种靶向鼠CD28 的RNA 核 酸 适 配 体CD28Apt2 和CD28Apt7,发现CD28Apt7二聚体的共刺激作用比CD28Apt2 二聚体更好,而CD28Apt2 二聚体的作用与抗CD28抗体相似,都能增强体液和细胞免疫应答[28]。
2.3 靶向细胞因子的核酸适配体
细胞因子作为免疫细胞交流的信息分子,在肿瘤的发生发展和治疗中发挥关键作用。IL‑8又称为趋化因子CXCL8,对嗜中性粒细胞起有效的趋化作用。研究表明血清中IL‑8的浓度与肿瘤大小、浸润深度以及肿瘤的发展阶段有关,而嗜中性粒细胞的积累与癌症患者不良预后也存在相关性。这说明在TME 中阻滞IL‑8 信号传导可能是治疗癌症的有效策略。IL‑8核酸适配体8A‑35能有效抑制IL‑8诱导的嗜中性粒细胞活化和趋化,而IL‑8核酸适配体8A‑44则能抑制IL‑8诱导的口腔癌细胞侵袭[29]。
TME 中的癌相关成纤维细胞所表达的趋化因子CXCL12 是TME 驱动的免疫抑制的关键。CXCL12与其受体CXCR4和CXCR7的表达在许多类型的癌症中均上调,核酸适配体NOX‑A12 以高亲和力结合CXCL12 并阻碍其与受体CXCR4/CXCR7 相互作用,从而抑制肿瘤血管生成并抑制肿瘤生长、侵袭及转移[30]。研究表明用NOX‑A12处理可延长经放射治疗后的胶质母细胞瘤大鼠的寿命[31]。NOX‑A12打破了TME的免疫特权状态,增加了肿瘤处T细胞和NK细胞的浸润,与PD‑1检查点抑制剂联合治疗效果更好[32]。NOX‑A12目前正处于II期临床研究阶段,有望发展为肿瘤免疫治疗药物[33]。
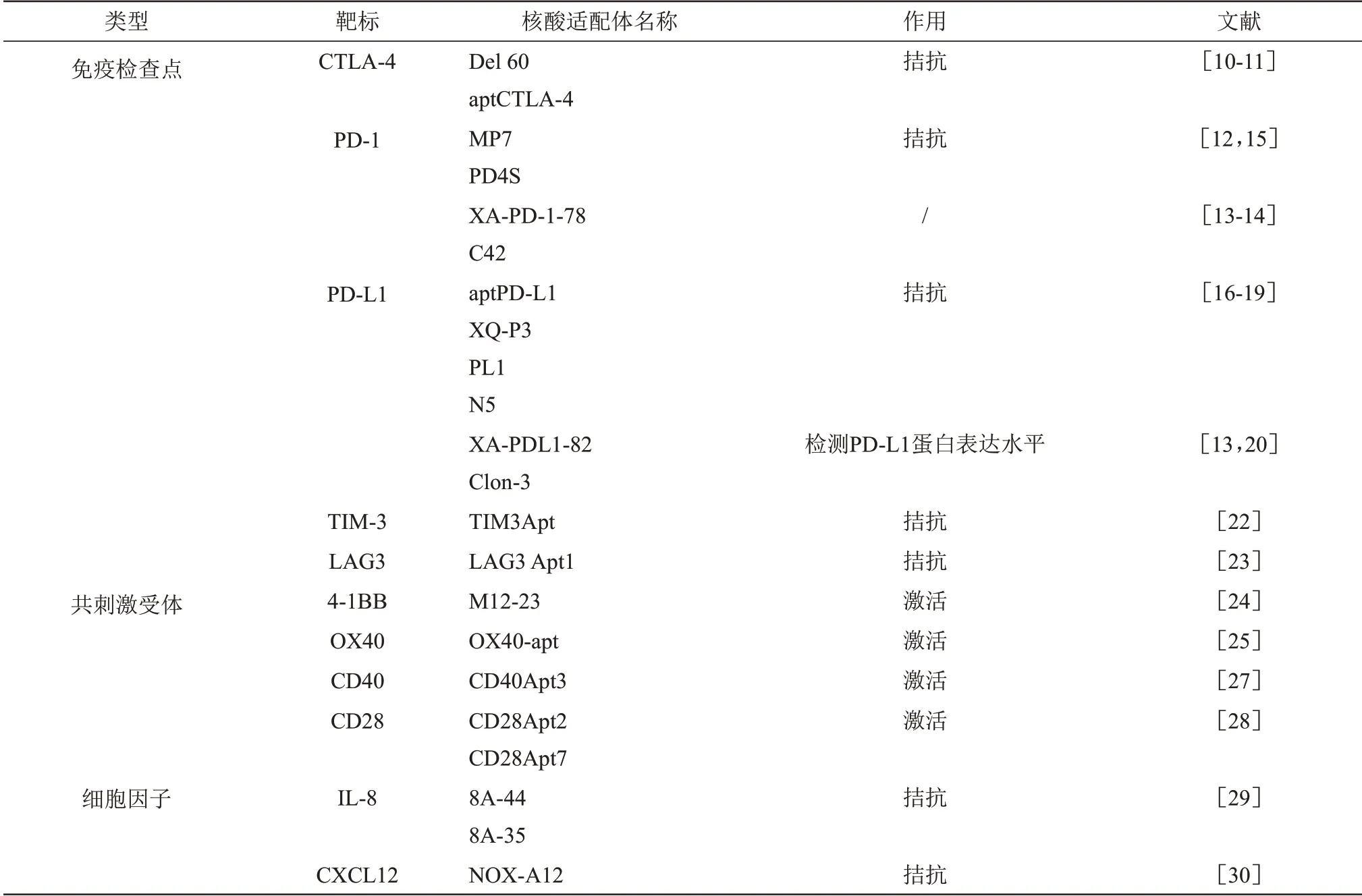
Table 1 Aptamers used in tumor immunotherapy表1 肿瘤免疫治疗相关核酸适配体
2.4 靶向免疫细胞的核酸适配体
近年来已通过cell‑SELEX 筛选出许多特异性结合不同肿瘤细胞的核酸适配体为癌症的检测和治疗提供了新的途径,针对不同免疫细胞是否也能筛选到相应核酸适配体,Pun 等[34]也进行了探索。他们筛选到能特异性结合CD8+T 细胞的核酸适配体A3t,利用表面结合A3t 的磁珠以及与A3t 互补的寡核苷酸链就可以从外周血单个核细胞(peripheral blood mononuclear cell,PBMC) 中无痕分选出CD8+T 细胞用于制备CAR‑T 细胞。该团队还试图筛选仅与M2样巨噬细胞结合的核酸适配体,但可能因为M0、M1和M2样巨噬细胞表面有较多相同的受体,筛选得到的核酸适配体A2 并不能特异性结合M2样巨噬细胞。令人意外的是,发现A2 只与CD14+单核细胞结合,而不与CD16+单核细胞结合,因此可以将A2 适配体与磁珠联用以分离PBMC中的CD14+单核细胞[35]。
3 核酸适配体介导的肿瘤免疫治疗
3.1 双特异性核酸适配体
双特异性核酸适配体通过识别同一细胞上两种不同靶标或识别两种细胞上的不同靶标,影响细胞免疫应答或介导肿瘤细胞与免疫细胞间的相互作用。PSMA‑4‑1BB双特异性核酸适配体由4‑1BB核酸适配体与靶向前列腺特异性膜抗原(prostate‑specific membrane antigen,PSMA)的核酸适配体PSMA 缀合形成,通过PSMA 的靶向作用使4‑1BB在肿瘤处共刺激T细胞进行免疫应答,减少因全身非特异性免疫激活产生的毒副作用[36]。但PSMA与许多受体一样会在配体结合后迅速内化,PSMA‑4‑1BB在靶向结合PSMA的同时也会被内化至肿瘤细胞,导致4‑1BB核酸适配体来不及结合并共刺激T细胞上的4‑1BB受体。血管内皮生长因子(vascular endothelial growth factor, VEGF) 是TME 中血管形成最重要的生长因子,将4‑1BB 核酸适配体与VEGF 核酸适配体缀合形成VEGF‑4‑1BB双特异性核酸适配体可以对肿瘤浸润性T细胞进行共刺激,避免了双特异性核酸适配体内化进入肿瘤细胞[37]。此外,针对肿瘤化疗耐药相关的多药耐药相关蛋白1 (multidrug related protein 1,MRP1)合成了MRP1‑CD28双特异性核酸适配体。MRP1‑CD28 双特异性核酸适配体能够在富含肿瘤干细胞的黑素瘤模型中为浸润淋巴细胞提供CD28共刺激,诱导T细胞增殖,抑制肿瘤生长,提高肿瘤小鼠的存活率[38]。
自然杀伤细胞(natural killer cell,NK cell)介导的抗体依赖性细胞介导的细胞毒作用(antibody‑dependent cell mediated cytotoxicity,ADCC)是免疫系统中的有力武器。c‑Met 是与肿瘤相关的抗原,c‑Met‑CD16 α双特异性核酸适配体将NK细胞募集到过表达c‑Met 的肿瘤处并诱导ADCC[39]。CD16在NK细胞、T细胞、单核细胞和巨噬细胞等免疫细胞中表达,而黏蛋白1(mucin1,MUC1)是在腺癌中过表达的肿瘤标志物。MUC1‑CD16双特异性核酸适配体可将CD16+免疫细胞募集到MUC1+肿瘤细胞处,诱导免疫细胞的特异性杀伤[40]。
为了提高双特异性核酸适配体的稳定性,研究人员开发了环状双特异性适配体,将能够特异性识别幼稚T 细胞膜表面高表达的CD62 的适配体LD201t1 分别与适配体sgc8、TE02 和PD‑L1 形成的环状特异性适配体,可以分别特异性结合CCRF‑CEM 细 胞、Ramos 细 胞 或B16 肿 瘤 细 胞,帮助幼稚T 细胞识别相应肿瘤细胞并聚集在肿瘤处,随后用T 细胞CD3/CD28 激活磁珠原位激活T细胞,可实现对肿瘤细胞的精准靶向杀伤。此外,通过简单的选择靶向不同肿瘤细胞的适配体就可以将该策略应用于不同癌症的靶向治疗[41]。
3.2 核酸适配体靶向递送siRNA
核酸适配体靶向递送siRNA 可减少脱靶效应,增强siRNA 的治疗效果。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是免疫记忆诱导的关键检查点,可促进活化的CD8+T细胞分化为短暂的效应T细胞,减少记忆性T细胞分化,产生有效但短暂的免疫应答。4‑1BB共刺激受体主要在CD8+T 细胞上表达,将4‑1BB 核酸适配体与靶向mTORC1 的siRNA 缀合,可抑制CD8+T 细胞分化为短暂的效应T 细胞,诱导分化为CD8+记忆T 细胞,提高疫苗接种小鼠的保护性抗肿瘤免疫力[42]。CD25表达降低可抑制IL‑2信号转导从而诱导记忆CD8+T 细胞的产生,因此将靶向CD25 的siRNA 与4‑1BB 核酸适配体缀合,下调CD25,诱导分化为CD8+记忆细胞[43]。
肿瘤细胞或肿瘤浸润基质细胞分泌的转化生长因子‑β(transforming growth factor‑β,TGF‑β)是肿瘤生长和肿瘤部位免疫抑制的关键介质,Smad4参与TGF‑β 信号转导途径,因此将针对Smad4 的siRNA与4‑1BB核酸适配体缀合可以抑制TGF‑β信号转导,帮助T 细胞抵抗TME 的免疫抑制作用,增强疫苗和辐射诱导的抗肿瘤免疫反应[44]。
信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)在TME 中可以持续激活CD4+调节性T 细胞,抑制CD8+T 细胞,从而促进肿瘤细胞增殖、侵袭和维持免疫抑制环境[45]。STAT3 siRNA 与CTLA4 核酸适配体缀合可结合表达CTLA4 的T 细胞并下调其STAT3,激活肿瘤抗原特异性T 细胞,减少肿瘤相关CD4+调节性T 细胞的生成。CTLA4‑STAT3 siRNA 在各种小鼠肿瘤模型中均能有效抑制肿瘤生长[46]。
最近发现,将EpCAM 适配体与siRNA 嵌合体连接使核酸适配体可以一次靶向递送多种siRNA,例如EpCAM 适配体靶向递送4 种siRNA(Upf2、PARP1、CD47 和MCL1)能有效抑制HER2+和三阴性乳腺癌小鼠模型中肿瘤的生长并增强肿瘤浸润性免疫细胞的抗肿瘤功能[47]。
3.3 核酸适配体-纳米材料复合物
近年来核酸适配体与纳米材料的复合物已在癌症检测与治疗领域已取得一定成果,纳米材料比表面积大可以增加核酸适配体的负载量并延长适配体的半衰期[48]。例如,将4 个PD‑L1 适配体连接至同一DNA纳米结构上形成了四价APT‑HJ,增加其生物稳定性、体内循环时间以及抗肿瘤效果[49]。在纳米颗粒上偶联不同核酸适配体可实现多靶点治疗,例如将CD28的适配体CD28Apt7与CTLA‑4的适配体Del60组装在一个核酸支架上形成的多价纳米颗粒能促进T细胞的增殖并诱导其分泌IL‑2,有效抑制黑素瘤小鼠肿瘤的生长[50]。ENG‑APT/MIP‑10‑LP 纳米胶囊因适配体ENG‑APT 而具备了靶向小鼠肿瘤血管内皮细胞的能力,能有效抑制肿瘤血管的形成[51]。
3.4 核酸适配体介导肿瘤细胞与免疫细胞相互作用
免疫细胞与肿瘤细胞间的相互作用是实现高效免疫治疗的重要环节,将能特异性识别肿瘤细胞的核酸适配体锚定在免疫细胞膜表面,可诱导免疫细胞进行靶向攻击,提高免疫细胞的治疗效果,并有望应用于过继性免疫治疗中。例如,在永生化巨细胞病毒特异性CD8+细胞毒性T 淋巴细胞表面锚定TD05 核酸适配体,可使T 细胞定向杀伤Ramos 细胞[52]。利用代谢标记法和点击化学反应将靶向SGC‑7901 胃癌细胞的适配体S4F 修饰于CD3+T 细胞表面,赋予其更强的肿瘤靶向性和杀伤性[53]。类似的,也可以利用核酸适配体对巨噬细胞和NK细胞表面进行修饰。在巨噬细胞膜表面修饰Sgc8核酸适配体增强了对CCRF‑CEM细胞的捕获能力,同时与抗癌药物联合治疗可增强对靶细胞的吞噬作用[54]。NK 细胞膜表面锚定CD30 核酸适配体生成的ApEn‑NK细胞能特异性结合表达CD30的淋巴瘤细胞并诱导其凋亡[55]。经TLS11a 适配体和PD‑L1适配体修饰的NK细胞既能靶向攻击肝癌细胞又能抵抗PD‑1/PD‑L1免疫检查点的抑制作用,增强NK细胞在实体瘤中的免疫治疗效果[56]。最近,研究人员将DNA 适配体作为抗体的替代品,构建了一种多价抗体模拟物(polyvalent antibody mimic,PAM),利用疏水插入的方法将PAM 插入到NK 细胞的细胞膜中,使NK细胞有效地识别和捕获对应肿瘤细胞。该方法具有广谱性,可以将任意感兴趣的适配体修饰于各种免疫细胞[57]。与治疗风险大,操作复杂的CAR‑T/NK免疫疗法相比,经核酸适配体修饰的免疫细胞更容易获得且毒副作用小,极具临床应用潜力。
4 总结与展望
抗体在肿瘤免疫治疗的临床应用占主要地位,但因其生产成本高,质量受不同批次的影响,且存在免疫原性可能会引发自身免疫毒性等问题限制了抗体治疗的长远发展。而与抗体相比核酸适配体具有以下优势有望在肿瘤免疫治疗中作为抗体的替代品发挥作用[58]:a.直接化学合成,与基于细胞生产的抗体相比生产成本低,储存期长且质量不受生产批次的影响。b.分子质量小,具有较高组织渗透率,免疫原性低。c. 易于修饰,可以与药物,siRNA或纳米颗粒偶联以增强治疗效果。d.具有可控的靶向治疗体系,通过合理设计互补的寡核苷酸解毒剂可以逆转核酸适配体的活性[59]。目前,核酸适配体在肿瘤免疫治疗领域的研究主要分为两部分,一是筛选具有免疫调节功能的核酸适配体,二是将已筛选到的免疫相关核酸适配体与抗体、siRNA、纳米材料及免疫细胞相偶联,参与肿瘤免疫调控。虽然核酸适配体在肿瘤免疫治疗领域的研究层出不穷,但要应用于临床治疗还有许多问题需要克服。包括:a.核酸适配体筛选周期长,目前针对免疫相关受体筛选得到的有调节功能的核酸适配体的种类不多,例如针对二代新型免疫检查点CD47 还未筛选到相关具有生物学功能的适配体。这表明我们需要优化筛选过程,一是缩短筛选周期,尽可能快地筛选到具有高亲和力与高特异性的核酸适配体。二是思考在筛选过程中引入怎样的筛选压力才能获得具有生物学功能的核酸适配体。b.核酸适配体往往需要经过化学修饰才能长时间发挥抗肿瘤免疫的作用。目前对于核酸适配体修饰主要类型包括5'‑溴、2'‑氨基、2'‑氟、2'‑O‑甲基核苷酸、胆固醇和PEG 修饰等。但近年来发现PEG 也存在免疫原性,会影响核酸适配体药物的疗效并可能引发超敏反应[60],因此还需开发更多安全的化学修饰方法。c.核酸适配体与纳米材料的结合方式有待改进与优化,以满足日益增长的肿瘤免疫治疗需求。d.经核酸适配体修饰的免疫细胞注入体内后并不能在体内增殖,因此发挥作用的时间有限,需要探索如何延长装备核酸适配体的免疫细胞发挥作用的时间。尽管核酸适配体在肿瘤免疫治疗领域还面临许多挑战,但随着对肿瘤免疫机制研究的不断深入,以及适配体筛选流程的逐渐成熟,核酸适配体有潜力发展为一种新型的肿瘤免疫治疗平台。

