低氧诱导因子2α抑制剂的发现及其在肾癌治疗中的应用潜力*
郭振清 李红强 隋爱霞 郭晓强
(1)河北科技师范学院农学与生物科技学院,秦皇岛 066004;2)河北省人民医院肿瘤科,石家庄 050051;3)河北体育学院运动人体科学系,石家庄 050041)
氧是地球上最重要的元素之一,在地壳含量最高(48.6%);氧对生命而言更是至关重要,人体元素组成中65%为氧,高等生物主要依赖营养物质的氧化供能。生命在演变过程中形成一个完善的氧感知和低氧适应系统,以适应不同环境下氧含量变化[1]。由于在阐明这个系统过程中的奠定性贡献,三位科学家分享了2019年诺贝尔生理学或医学奖[2‑3]。
1 低氧信号通路
低氧信号通路核心分子为低氧诱导因子(hypoxia‑inducible factor,HIF),它由两种亚基组成,分别为HIF‑α 亚基和HIF‑β 亚基,其中HIF‑α亚基蛋白稳定性受氧浓度的严格调控,而HIF‑β亚基则与氧含量无关。氧含量正常时,HIF‑α亚基被脯氨酰羟化酶(prolyl hydroxylase domain,PHD)催化发生羟基化,进而被包含VHL(von Hippel‑Lindau)因子在内的泛素连接酶E3 实现泛素化修饰,最终被蛋白酶体降解;低氧状况下,PHD 酶活性降低,HIF‑α无法被羟基化和泛素化修饰,从而在细胞内聚集,随后进入细胞核与HIF‑β形成异二聚体, 通过与低氧应答元件(hypoxia‑responsive element,HRE)结合而激活靶基因表达[4‑5],以增加低氧胁迫下细胞适应性(图1)。
低氧信号通路的阐明拓展和深化了对许多生理和病理过程的理解和认识。适当低氧适应对氧化损伤和炎症侵害如冠状动脉疾病、外周动脉疾病、伤口愈合、器官移植排斥以及结肠炎等均具有保护作用;低氧信号异常则往往造成疾病发生,如过弱可造成贫血等疾病,而过强则是癌细胞典型特征之一,有利于癌组织血管生成和营养物质摄取等。
低氧信号通路关键分子还成为疾病治疗重要靶点,如PHD抑制剂罗沙司他(Roxadustat)已被批准应用于肾性贫血临床治疗。然而,靶向HIF激活途径的药物却尚未投入使用。
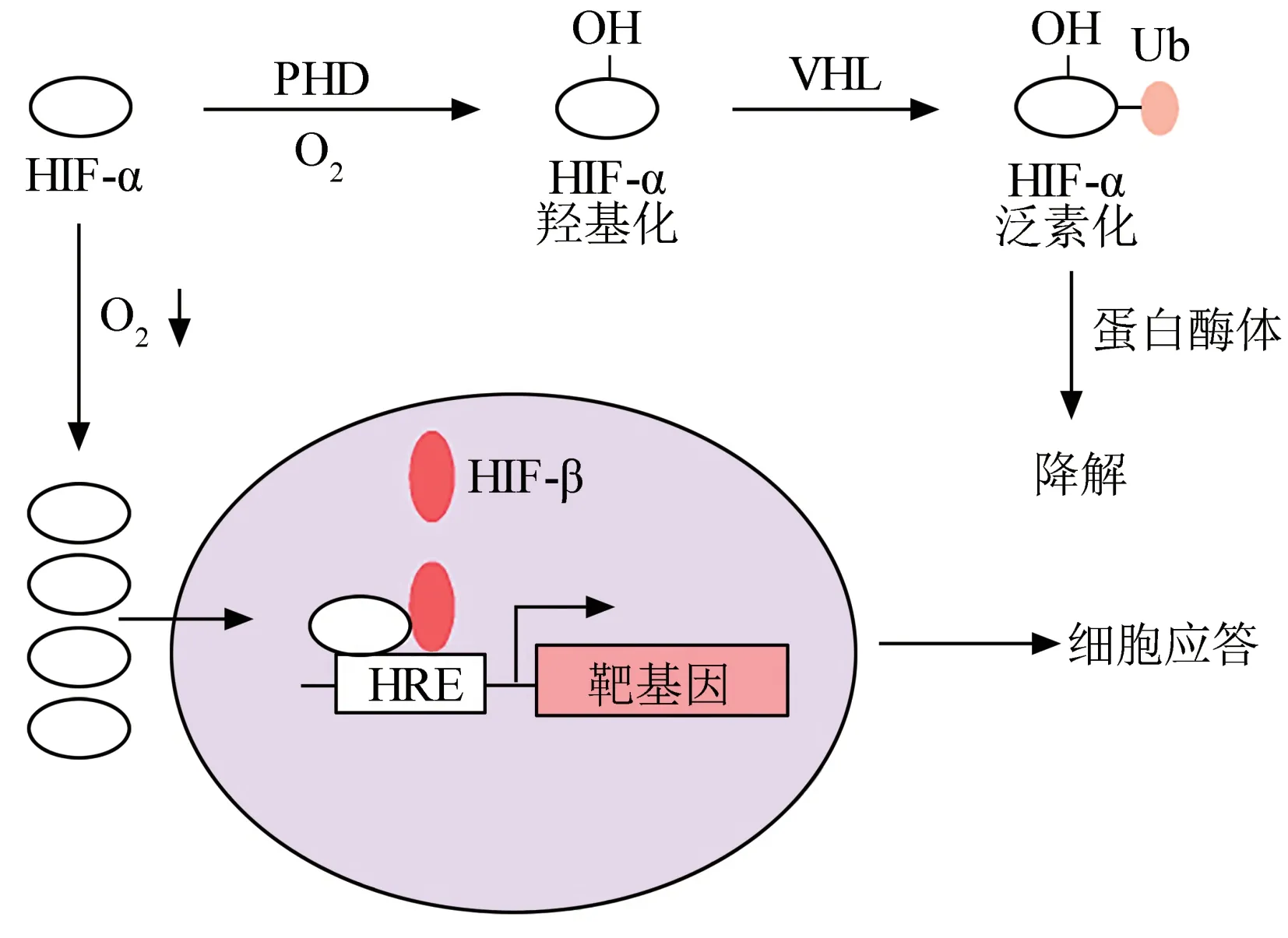
Fig.1 Oxygen sensing pathway[1]图1 氧感知通路[1]
2 HIF-2α与肾癌发生
人类共存在3 种HIF‑α 亚基,分别为HIF‑1α、HIF‑2α 和HIF‑3α。HIF‑1α 最早于1995年由诺贝尔奖获得者西门扎(Gregg Semenza)首先发现[1];HIF‑2α 于1997年 由4 个 研 究 小 组 藤 井 佳 昭(Yoshiaki Fujii‑Kuriyama)、里绍(Werner Risau)、布拉德菲尔德(Christopher Bradfield)和麦克奈特(Steven McKnight) 几 乎 同 时 独 立 鉴 定[6‑9];而HIF‑3α 则于1998年由布拉德菲尔德小组完成克隆[10]。相对于研究较少的HIF‑3α,HIF‑1α和HIF‑2α的生物学作用得到较全面阐述。HIF‑1α 全身所有细胞均可表达,而HIF‑2α 只在特定细胞表达;二者调节的靶基因具有一定重叠性,但并不完全相同,尤其在肾癌发生过程中发挥截然相反的作用。
肾癌,又名肾细胞癌(renal cell carcinoma,RCC)是一种常见泌尿系统肿瘤,约占成人恶性肿瘤的2%~3%,全球每年约30 万新增病例和10 万死亡病例[11]。肾癌典型特征之一是存在高频VHL失活性突变,尤其是亚型肾透明细胞癌(clear cell RCC,ccRCC)有高达90%以上为此类型,VHL蛋白失活破坏HIF‑α正常降解途径,造成常氧状态下HIF‑α 出现大量聚集[12],被认为是肾癌发生主要原因。最初认为HIF‑1α 和HIF‑2α 均促进了肾癌发生,然而后续研究发现并非如此。HIF‑2α 更多发挥致癌作用,本课题组研究也表明HIF‑2α 可通过影响组蛋白修饰而参与肾癌发生[13];相反HIF‑1α一定程度上还具有抑癌活性[14‑15]。已有研究表明,降低HIF‑2α 含量可明显抑制肾癌发展,因此靶向HIF‑2α被看作肾癌治疗的重要策略[16]。
3 HIF-2α抑制剂研发
按照传统抑制剂开发观点,作为转录因子一类的HIF‑2α 属于“不可成药(undruggable)”分子。一方面转录因子单独存在缺乏典型的活性位点,不适宜小分子化合物结合,另一方面它们定位于细胞内,大分子单克隆抗体进入细胞发挥活性也存在巨大障碍[17],这意味着HIF‑2α 抑制剂开发需另辟蹊径,研究人员从HIF‑2α 与HIF‑1β 形成复合物发挥活性这一特性入手。
HIF‑2α 结构可分4 部分:N 端为碱性螺旋‑环‑螺旋(basic helix‑loop‑helix,bHLH)结构,主要参与和DNA上靶序列HRE结合;中间为两个串联的PAS (PER‑ARNT‑SIM) 结构域(PAS‑A 和PAS‑B)[18],主要参与异二聚体(HIF‑2α 与HIF‑1β复合物) 形成;随后为氧依赖降解结构域(oxygen‑dependent degradation domain,ODD),主要为PHD 识别和修饰位点;C 端为反式激活结构域(transactivation domain,TAD),主要作用为招募转录共调节蛋白。HIF‑1β 结构与HIF‑2α 类似,但只有3 部分,缺少ODD,因此蛋白质稳定性不依赖氧含量(图2a)。
2009年,美国德克萨斯大学西南医学中心布鲁克(Richard Bruick)小组发现HIF‑2α 与HIF‑1β形成复合物时PAS‑B结构域形成一个较大的疏水性袋状结构,该结构可被小分子化合物占据而发挥变构调节作用,通过改变异二聚体空间结构而影响靶基因表达[19]。HIF‑2α 这一结构特征为研发人员带来巨大灵感,PAS‑B 袋状结构可看作HIF‑2α 特异性抑制剂发挥活性的最佳结合位点。2010年,佩洛顿治疗公司(Peloton Therapeutics Inc.)在德克萨斯大学生物中心校园成立,开启HIF‑2α 抑制剂研发历程。
基于HIF‑2α/HIF‑1β异二聚体形成过程中PAS‑B结构域特征,研究人员采用高通量筛选技术(high‑throughput screening,HTS)对涵盖20 多万种化合物的小分子文库进行全面初筛,获得上百种潜在抑制剂;进一步根据HIF‑2α 的PAS‑B 与这些抑制剂结合的晶体结构而缩小候选对象范围;最后考虑这些抑制剂的结合能力、选择特异性以及口服吸收效果等因素而锁定两种化合物PT2385 和PT2977 作为抑制剂(图2b),有时亦称拮抗剂(antagonist)。PT2385 作为体外实验用抑制剂,而PT2977 作为临床药物使用,因为相较于前者,后者药代动力学和体内生物利用率更为理想[20‑22]。
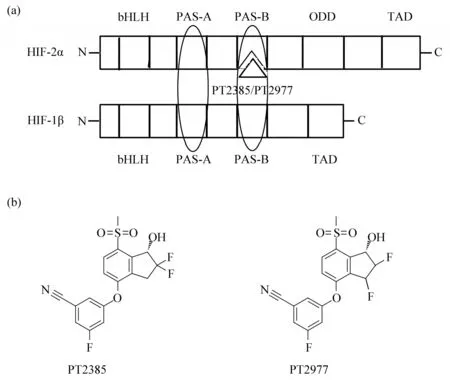
Fig.2 The structure and inhibitors of HIF-2α/HIF-1β[22]图2 HIF-2α/HIF-1β复合物及其抑制剂结构[22]
体外实验表明,PT2385和PT2977可高效(KD在纳摩尔级)抑制HIF‑2α/HIF‑β异二聚体形成及与DNA 结合活性,最终实现抑制HIF‑2α 靶基因表达的目的(图3)。两种抑制剂的作用效果还具有较强选择性,尽管HIF‑1α 和HIF‑2α 蛋白序列具有高度同源性,但二者在PAS‑B 结构方面存在一定差别,因此PT2385/PT2977 只抑制HIF‑2α 与HIF‑1β结合并降低HIF‑2α 靶基因表达,而不影响HIF‑1α生理功能[20,22]。
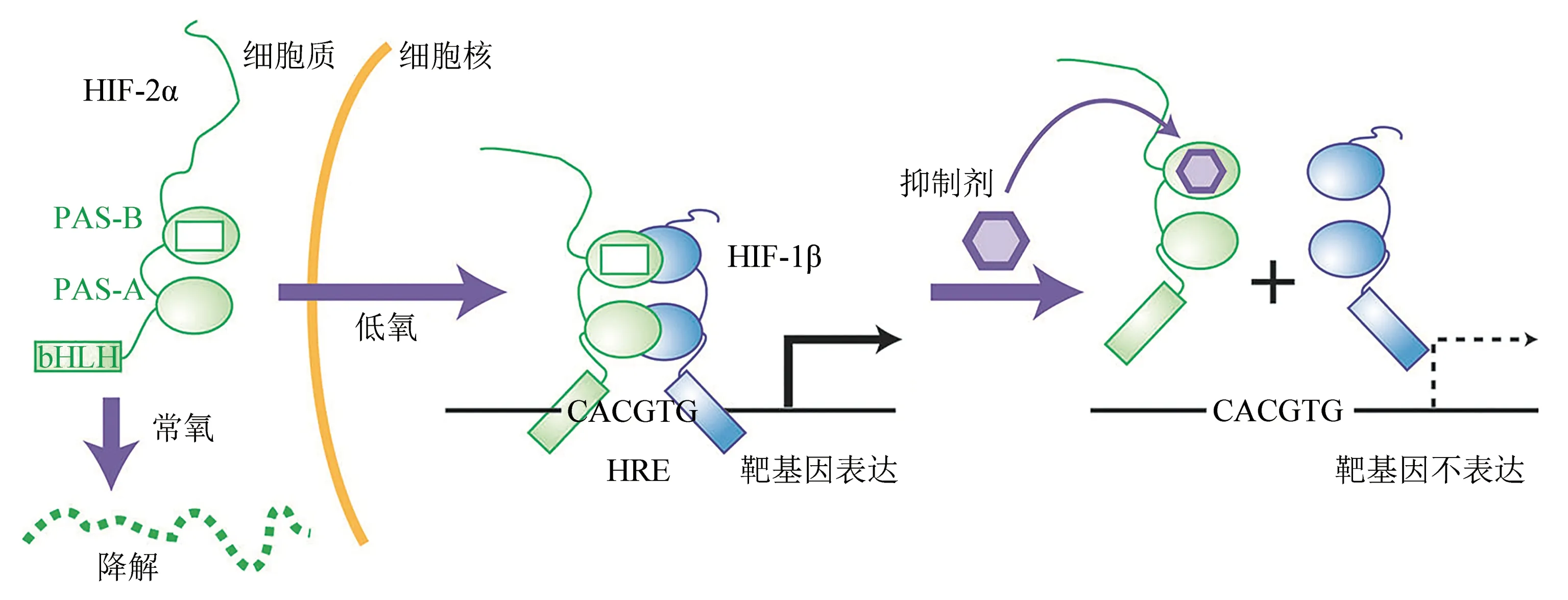
Fig.3 Mechanism of HIF-2α inhibitor图3 HIF-2α抑制剂作用机制(https://www.cancer.gov/news‑events/cancer‑currents‑blog/2016/hif2‑kidney‑cancer)
4 PT2385或PT2977治疗肾癌的临床前研究
在两种VHL 突变的肾癌细胞786‑O 和A498 来源的异种移植小鼠肿瘤模型中,PT2385 可明显抑制HIF‑2α 靶基因如CCND1、VEGFA 和GLUT1 等表达,但不影响HIF‑1α 靶基因表达,说明PT2385体内作用的特异性;进一步通过口服给药方式观察到,PT2385 可剂量依赖性引起异种移植小鼠的肿瘤快速消退(相比而言,786‑O 比A498 更敏感),其效果达到甚至超过经典的酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI) 舒 尼 替 尼(Sunitinib);随后采用一位VHL突变且经舒尼替尼等治疗后出现进展的肾癌患者来源异种移植(patient‑derived xenograft,PDX)小鼠模型进行测试,经过4 周PT2385 治疗可完全抑制肿瘤生长;在副作用方面,PT2385 没有引起可检测到的血液动力学或心电图异常,明显优于舒尼替尼[23]。
对PT2977 的作用研究发现,其与PT2385 类似,在体内特异性抑制HIF‑2α 靶基因表达,但对HIF‑1α 靶基因没有作用;采用786‑O 和A498 来源的异种移植小鼠肿瘤模型也证实PT2977 的体内肿瘤抑制活性[24]。另一项研究对来自22位VHL突变的肾癌患者建立的小鼠体外移植物模型进行PT2977活性测试,规定肿瘤抑制80%以上为敏感,40%~80%之间为中度敏感,而低于40%为抵抗。结果表明,45%肿瘤患者(10/22)对PT2977 敏感,23%患者(5/22)对PT2977 中度敏感,敏感和中度敏感率之和达到68%;疗效比较试验表明,PT2977 抑制效果较舒尼替尼更为显著;在药物耐受性方面,PT2977也更为理想,使用PT2977治疗的小鼠体重出现增加,而使用舒尼替尼的小鼠体重明显减轻[25]。这些喜人结果说明HIF‑2α 是肾癌治疗的理想靶点之一[26],从而为进一步开展临床实验奠定基础[27]。
5 HIF-2α抑制剂治疗肾癌的临床实验
2014年,佩洛顿治疗公司启动HIF‑2α 抑制剂针对晚期或转移性肾癌患者的临床试验。I期临床实验对已接受至少一种靶向治疗的晚期肾透明细胞癌患者进行PT2385剂量递增测试[28],以从中鉴定出药物利用度和安全性最适浓度,为进一步开展临床实验提供推荐剂量。疗效方面,经过PT2385 治疗,完全缓解为2%,部分缓解为12%,疾病稳定为52%,因此疾病控制率达到66%。临床药物不良事件(adverse event,AE)较为轻微,大部分为1级或2级。最常见不良反应为贫血,占比45%,这种不良反应被称为靶向毒性,主要源于HIF‑2α 靶基因之一为促红细胞生成素(erythropoietin,EPO)[29],因此抑制HIF‑2α不可避免造成红细胞生成受阻和贫血发生。其他常见不良反应为外周水肿(39%)和疲劳(37%)。另一项使用PT2977 进行的I期临床实验也获得类似结论,55 例晚期肾癌经PT2977 治疗后,部分缓解24%,疾病稳定54%,疾病控制率达到78%[30],不良反应均为轻度,最常见也是贫血(35%)。
2019年5月,佩洛顿治疗公司被默克公司收购,PT2977 更名为MK6482,商品名Belzutifan。针对MK6482已完成Ⅱ期临床,对55例晚期肾癌患者进行的一项研究表明,客观缓解率(包括完全缓解率和部分缓解率)为24%,疾病控制率达到80%,而中位无进展生存期(progress free survival,PFS)为11 个月[31];另一项针对61 例VHL 突变肾癌患者的临床实验发现,27.9%的客观缓解率,86.9%出现病灶缩小,中位无进展生存期尚未达到,而12个月的无进展生存期比例高达98.3%[32]。两项实验观察到不良反应均较为轻微,主要为1级或2 级,最常见不良反应依次为贫血、疲劳和头晕。基于这些结果,MK6482在2020年6月被看作VHL突变肾癌治疗的突破性药物,2021年3月被美国FDA 受理新药申请并授予优先审查,有望在下半年获批应用于VHL突变晚期肾癌的治疗。
6 HIF-2α抑制剂耐药
临床前和临床实验过程中,除观察到HIF‑2α抑制剂理想的治疗效果外,还观察到耐药性问题。耐药性既包括原发性耐药(起始治疗不敏感)和继发性耐药(应用一段时间后耐药),因此针对耐药性问题的研究一方面有益于临床指导用药,另一方面也对开发新型HIF‑2α 抑制剂或联合用药具有重要裨益。
体外软琼脂生长实验和异种移植小鼠肿瘤模型测试发现,PT2977 对一些VHL 突变肾癌细胞系(如786‑O和A498)敏感,但对另一些VHL突变肾癌细胞系(如769‑P 和UMRC‑2 等)则缺乏作用,进一步分析发现部分原发性耐药肾癌细胞存在p53基因突变,而获得性耐药的786‑O 也出现p53 突变[24],提示p53 信号通路异常可能是HIF‑2α 抑制剂耐药原因之一。
判定HIF‑2α 抑制剂敏感性另一策略是生物标志物[25]。首当其冲标志物是HIF‑2α 蛋白含量,检测发现PT2977 敏感性肾癌83%表达HIF‑2α,而耐药性肿瘤只有23%;其次是基因表达模式差异,如敏感性肾癌通常高表达转录因子GLI1;第三是影像学证据,敏感性肾癌通常血管更为丰富。另一项研究发现,丝氨酸生物合成途径关键调节因子磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase,PHGDH)上调可能也是HIF‑2α 抑制剂抗性产生原因[33]。
耐药性最根本和常见原因是HIF‑2α 的关键氨基酸突变。应用HIF‑2α 抑制剂治疗一段时间后出现耐药性的肾癌肿瘤组织发现一个保守型突变(G323E)[25,34],突变氨基酸恰好位于PAS‑B 形成口袋结构的关键位置,因此突变后可破坏HIF‑2α抑制剂结合,从而无法发挥药物活性;另一项研究从耐药性肾癌组织鉴定出HIF‑2α 的PAS‑B 结构域另一关键位置点突变(S305M)[35],而人为制造HIF‑2α 的点突变(S304M)也损伤PT2977 的抑制作用[24]。
鉴于HIF‑2α 抑制剂耐药性的产生是一个复杂过程,因此尚需进一步研究。
7 意义和展望
肾癌作为一种放化疗不敏感的恶性肿瘤,靶向治疗和免疫治疗成为手术后辅助治疗或无法手术的首选治疗策略[36‑37]。目前肾癌临床治疗常用药物有以下几类:贝伐单抗、酪氨酸激酶抑制剂、哺乳动物雷帕霉素靶蛋白(mammalian targets of rapamycin,mTOR)抑制剂和PD‑1/PD‑L1 抑制剂等(表1)[38‑39]。尽管已有多种药物,但实际应用仍面临诸多挑战,一方面很少患者能对这些药物完全反应,另一方面治疗一段时间后都会出现耐药性而使肿瘤出现进展,而对于晚期或转移性肾癌患者,5年生存率仅为8%。显而易见,需要研发更多、更好的肾癌治疗药物[40]。
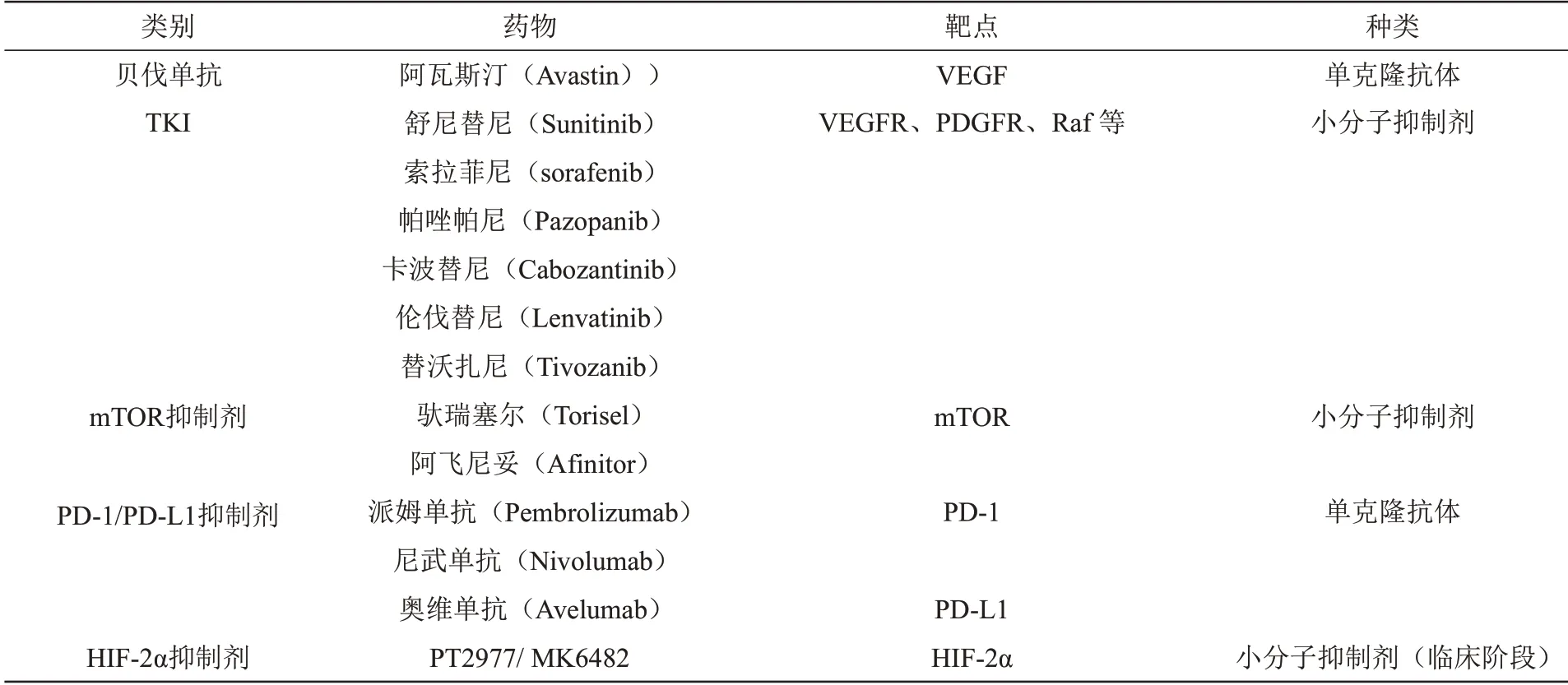
Table 1 Commonly used clinical drugs for RCC treatment表1 肾癌临床治疗常用药物
HIF‑2α 抑制剂研发成功无疑既具有重要理论意义,又具有实际应用价值[41‑42]。理论上这一进展极大改观传统观念转录因子不可作为药物研发靶点的现实,为其他类似蛋白药物设计提供重要思路;应用方面,HIF‑2α 抑制剂有望为肾癌治疗提供全新选择,提升肾癌患者生存时间和生存质量。目前,一方面需要积极开展HIF‑2α 抑制剂临床实验,以期获得最佳治疗方案,另一方面需要探索HIF‑2α 抑制剂耐药机制,为提升临床治疗效果提供重要支持。

