脂质代谢在乳腺癌发病中的作用*
王 淼 王欣宇 李鸿铭 张红胜
(北京工业大学环境与生命学部,北京 100124)
根据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据,乳腺癌新增人数达226 万,肺癌为220 万,乳腺癌正式取代肺癌,成为全球第一大癌症。全球女性乳腺癌新发226万例,远超女性其他癌症类型。全球女性癌症死亡443 万例,其中乳腺癌死亡68 万例,占据第一。在中国癌症情况中,乳腺癌新发病例42 万,排名第四,死亡病例12 万,排名第七。乳腺癌的预防、诊断和治疗越来越受到大家的关注和重视。代谢重编程是肿瘤十大标志之一[1],脂质代谢是为细胞提供能量支持的一环,其代谢异常在乳腺癌中的作用尚未明确阐明,探索脂质代谢异常在乳腺癌中的机制有可能成为新的治疗靶点。
1 乳腺癌分子亚型及治疗方法
根据标志物表达情况可将乳腺癌分为4 个亚型,即Luminal A型、Luminal B型、人表皮生长因子受体2 (human epidermal growth factor receptor 2,HER2)过表达型和三阴型[2]。Luminal 型雌激素受体α(estrogen receptor,ER‑α)和孕激素受体(progesterone receptor,PR)呈阳性,是由于ER‑α激活致癌生长途径引发癌症;HER2过表达型ER‑α和PR 均呈阴性,HER2 呈阳性,是因为编码表皮生长因子受体家族的ERBB2 受体酪氨酸激酶的致癌基因ERBB2 过度活跃而导致乳腺癌发生;三阴性乳腺癌(triple‑negative breast cancer,TNBC)中ER‑α、PR 和HER2 均呈阴性,目前其发明机理尚未明确,可能由多种原因诱发引起的[3]。最新研究表明,三阴性乳腺癌存在3 种不同的代谢表型:a.MPS1脂质合成亚型,其特点是脂肪酸、胆固醇等脂质的代谢和合成在癌细胞中上调;b.MPS2糖酵解亚型,特点是癌细胞碳水化合物和核苷酸的代谢上调;c.MPS3混合亚型,兼具以上两种亚型的特点[4]。该研究提示针对不同代谢表型作为TNBC精准治疗的潜在策略。对于非转移性乳腺癌,治疗的主要目标是根除乳腺和区域淋巴结的肿瘤,防止转移复发。非转移性乳腺癌的局部治疗包括手术切除和腋窝淋巴结的取样或切除,同时考虑术后放射治疗[5]。系统治疗可以是术前(新辅助治疗)、术后(辅助治疗)或两者兼用。对于预后较差以及目前治疗困难的转移性乳腺癌患者来说,治疗目标是延长生命和缓解症状。局部治疗方式(手术和放射)通常只用于转移性疾病的缓解治疗[6]。
2 脂质代谢异常是癌症重要标志之一
癌细胞的一个共同特征是它们通过代谢重编程以维持细胞生长、分裂和存活所需的三磷酸腺苷(adenosine triphosphate,ATP)和大分子生产的能力。脂质是一组高度复杂的生物分子,不仅构成生物膜的结构基础,还作为信号分子和能量来源发挥作用[7]。脂质代谢是脂质在体内合成、分解和代谢等生理过程。有研究表明,癌细胞可以利用脂质代谢来支持其快速增殖、存活、迁移、侵袭和转移,脂质合成或摄取增强也有助于癌细胞快速生长和肿瘤形成[8]。脂质代谢水平随着不同肿瘤的发展而变化,其异常变化有可能对疾病变化、预后等有指导意义。研究癌细胞中的脂质代谢异常,探索脂质代谢对癌症的影响。本文就乳腺癌细胞中脂肪酸、甘油三酯、胆固醇代谢和相关信号通路调控脂质代谢的进展作一综述。
3 乳腺癌中脂肪酸代谢的异常
脂肪酸代谢失调被认为在包括乳腺癌在内的许多不同癌症的恶性转化中扮演着重要作用。参与脂肪酸合成和氧化的关键代谢酶在乳腺癌细胞的增殖、迁移和侵袭中起着关键作用。脂肪酸代谢包括多种途径,包括脂肪酸运输、以甘油三酸酯和胆固醇酯的形式储存在脂质小滴中、从磷脂和甘油三酸酯中动员、脂肪酸氧化等。在大多数人体组织中,细胞对脂肪酸的需求一般是通过利用膳食中的脂肪酸来满足的,脂肪酸从头合成的途径是不重要的,但例外的是肝脏和乳腺,其次是脂肪组织。脂肪酸从头合成途径在正常组织与癌症组织中的重要性不同,使其成为一个有吸引力的治疗目标[9]。除了从头合成脂肪酸外,癌细胞还可以通过摄取饮食中的脂质或摄取与癌症相关的脂肪细胞释放的外源脂肪酸来获得所需的脂肪酸[10]。本节主要介绍调节脂肪酸代谢相关酶的基因在乳腺癌中的异常作用及相关研究进展。图1 为乳腺癌中脂肪酸、甘油三酯、胆固醇代谢途径。
3.1 脂肪酸合成
肿瘤细胞的生物学性状和能量代谢机制与正常细胞不同。研究发现,恶性肿瘤生长增殖所需的脂肪酸主要来源于从头合成途径,且脂肪酸合成和氧化代谢相关的重要酶类在肿瘤组织中过度表达而在正常组织中不表达或低表达[11]。在乳腺癌中参与脂肪酸合成的柠檬酸ATP 酶(ATP citrate lyase,ACLY) 的过度表达或活性增强与肿瘤进展相关[12]。ACLY 表达的降低了肿瘤细胞的活力,抑制了肿瘤细胞增殖、侵袭和转移[13]。脂肪酸限速酶乙酰辅酶A羧化酶(acetyl‑CoA carboxylase alpha,ACACA)在乳腺癌中高度表达,ACACA耗竭会减少脂肪酸的合成,并诱导乳腺肿瘤细胞的凋亡,但不会诱导非恶性细胞的凋亡[14]。硬脂酰辅酶A 去饱和酶(stearoyl‑CoA desaturase,SCD)在癌细胞中过表达,SCD 通过诱导细胞凋亡,阻止细胞周期和防止迁移来控制乳腺癌细胞的增殖,但是SCD 抑制剂的抗肿瘤作用可以被外源油酸逆转[15]。作为调控脂肪酸合成调控的重要转录因子甾醇调节因子结合转录因子1(sterol regulatory element binding transcription factor 1,SREBP1)在乳腺癌中过度表达,并与乳腺癌更差的临床结果密切相关,SREBP1能促进乳腺癌的生长和转移[16]。最新研究发现,脂肪酸合酶(fatty acid synthase,FASN)的表达对于脂质合成和维持棕榈酸酯水平是必要的,特别是在没有外源性脂质的环境中。脂肪酸合成是乳腺肿瘤生长所必需的,FASN可作为乳腺癌脑转移的潜在治疗靶标[17]。
3.2 脂肪酸氧化
脂肪酸β 氧化(fatty acid β‑oxidation,FAO)是脂肪酸的改造过程,通过FAO 可以将长链脂肪酸改造成长度适宜的脂肪酸,供机体代谢所需。酰基辅酶A 氧化酶2(acyl‑CoA oxidase 2,ACOX2)是发生在过氧体中的支链、长链脂肪酸β氧化过程中的限速酶。一个变异转录本ACOX2‑i9的表达和翻译已被证实在ER 阳性乳腺癌细胞系中受到雌激素的调控,敲除该酶会导致细胞活力下降[18]。肉碱棕榈酰转移酶1B(carnitine palmitoyltransferase 1B,CPT1B)是编码FAO 的关键酶。JAK/STAT3调节脂质代谢,抑制JAK/STAT3 能阻止乳腺癌干细胞的自我更新和各种脂质代谢基因包括CPT1B基因的表达,STAT3‑CPT1B‑FAO 途径可促进癌细胞干性和化疗抗性,阻断FAO 可使癌细胞对化疗重新敏感,并在体内抑制小鼠乳腺肿瘤的癌症干细胞[19]。
3.3 脂肪酸摄取
CD36 分子调控脂质的摄取,并且参与了多种转移性肿瘤细胞膜表面的脂肪酸摄入,包括黑色素瘤、乳腺癌、膀胱癌、肺癌和卵巢癌;当CD36表达被敲低,肿瘤细胞侵袭转移行为在小鼠模型中完全停止[20]。CD36在肿瘤浸润的调节性T细胞中表达水平更高,抑制CD36 可阻断调节T 细胞对肿瘤微环境的适应,增强抗肿瘤活性[21]。
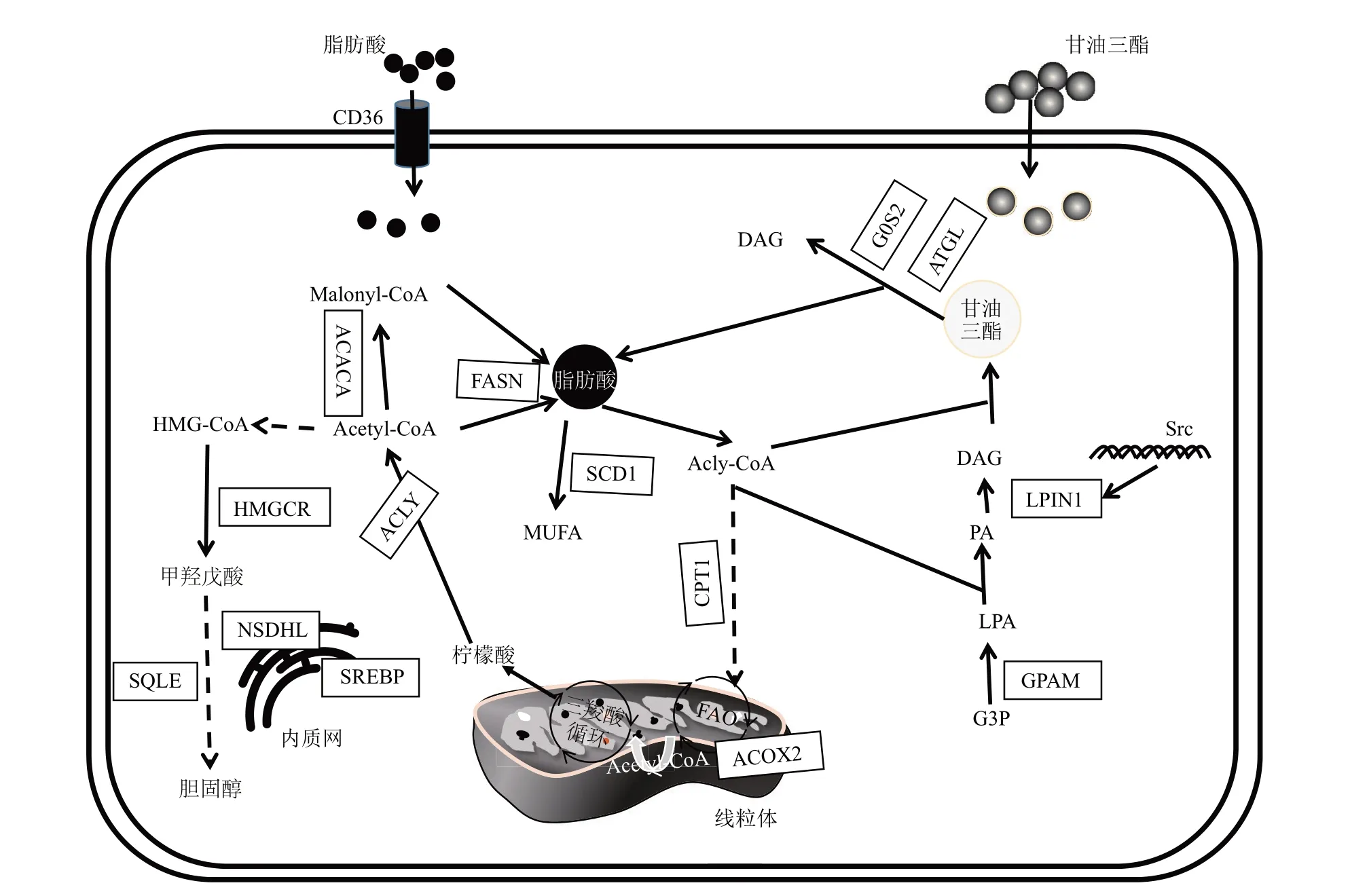
Fig.1 Fatty acid,triglyceride and cholesterol metabolic pathways in breast cancer图1 乳腺癌中脂肪酸、甘油三酯、胆固醇代谢途径
总之,肿瘤细胞异常脂肪酸代谢特异性表型逐渐引起人们高度重视,探索异常脂肪酸代谢在乳腺癌发生发展中的作用,以及通过靶向脂肪酸代谢途径治疗恶性肿瘤的策略正备受关注。
4 乳腺癌甘油三酯代谢的异常
甘油三酯是人体脂肪组织和血脂的主要成分。在乳腺癌中,甘油三酯代谢酶存在异常表达,本节介绍甘油三酯代谢关键酶在乳腺癌中的异常表达及相关研究进展。
4.1 甘油三酯合成
甘油三酯是通过两个主要途径合成的,磷酸甘油途径和单酰基甘油途径。磷酸甘油途径是大多数细胞类型所利用的主要途径。通过逐步添加脂肪酰基可实现3‑磷酸甘油的酰化,每个脂肪酰基均由不同的酶催化。相比之下,单酰基甘油途径主要在小肠中发挥作用,由源自膳食脂肪的单酰基甘油生成甘油三酯。甘油三酯合成基因甘油‑3‑磷酸酰基转移酶(glycerol‑3‑phosphate acyltransferase,GPAM)在乳腺癌中的表达明显升高。基于脂质组分析发现,GPAM蛋白阳性的肿瘤中磷脂,尤其是磷脂酰胆碱的含量明显升高。GPAM在人类乳腺癌中与细胞代谢相关变化有关,特别是增加磷脂的合成[22]。 甘 油‑3‑磷 酸 酰 转 移 酶2 (glycerol‑3‑phosphate acyltransferase 2,GPAT2)在乳腺癌中表达显著上调,GPAT2 敲除降低了乳腺癌细胞增殖、锚定独立生长、迁移和肿瘤发生性[22]。Lipin1(LPIN1)是一种磷脂酸磷酸酶,催化磷脂酸向二酰甘油的转化,这是甘油三酯合成的倒数第二步。其在乳腺癌中高度表达,敲除LPIN1可抑制乳腺癌细胞增殖和迁移[23]。有研究表明,原癌基因Src介导的LPIN1酪氨酸磷酸化与人乳腺癌的恶性肿瘤和较差的预后密切相关[24]。
4.2 甘油三酯降解
脂肪组织中的甘油三酯在一系列脂肪酶的作用下,分解生成甘油和脂肪酸,并释放供应能量。G0/G1 转换基因2(G0/G1 switch gene 2,G0S2)参与甘油三酯降解。还有研究表明,在三阴性乳腺癌中G0S2的表达高度上调,G0S2表达影响乳腺癌的侵入性表型和不良预后。抑制G0S2 可抑制侵入性乳腺癌细胞的增殖、迁移和侵入性[25]。甘油三酯酶(adipose triglyceride lipase,ATGL)是甘油三酯降解的限速酶之一。肺部间充质细胞显著上调中性粒细胞脂滴相关基因,包括G0S2 的表达,这些上调的ATGL 抑制因子反过来抑制ATGL 的酶活性,导致肺部中性粒细胞中甘油三酯的累积[26]。中性粒细胞特异性敲除ATGL增强了细胞的脂质积累,并显著促进体内乳腺癌肺转移,为乳腺癌肺转移的临床干预提供新的靶点[26]。总的来说,甘油三酯代谢调控着癌细胞生长,研究甘油三酯代谢机制可作为治疗乳腺癌潜在新的思路。
5 乳腺癌中胆固醇代谢的异常
胆固醇是生物膜的重要组成部分,由甲羟戊酸途径中的类异戊二烯前体产生。甲羟戊酸途径催化两个碳单元从乙酰基辅酶A 依次缩合形成3‑羟基‑3‑甲基戊二酰辅酶A,随后被还原成甲羟戊酸酯[26]。胆固醇代谢异常在肿瘤的发生发展中起重要作用[27]。本节重点介绍胆固醇合成酶在乳腺癌中的异常表达情况及相关研究进展。
角鲨烯环氧化酶(squalene epoxidase,SQLE)是催化固醇生物合成的第一个氧合步骤,被认为是胆固醇合成的限速酶之一。有研究发现其与一种新型的lncRNA(命名为lnc030)共同作用,可作为乳腺癌治疗的有效靶点[28]。NAD(P)依赖性类固醇脱氢酶样化合物(NAD(P)dependent steroid dehydrogenase‑like,NSDHL)基因编码的蛋白质定位于内质网,参与胆固醇生物合成。在乳腺癌细胞系中敲低NSDHL,观察到总胆固醇水平显著降低,细胞的生存能力、克隆形成、迁移和侵袭能力显著下降[29]。乳腺癌组织与正常组织相比,NSDHL表达水平显著较高;NSDHL高表达与低表达相比,乳腺癌尤其三阴性乳腺癌患者生存结局显著较差、死亡风险显著较高[30]。NSDHL作为乳腺癌的治疗靶点的用途还需进一步研究明确。3‑羟基‑3‑甲基戊二酰辅酶A 合成酶1(3‑hydroxy‑3‑methylglutaryl‑CoA synthase 1,HMGCS1)其相关通路包括固醇调节元件结合蛋白(SREBP)信号传导和萜类骨架生物合成。HMGCS1 作为一种潜在的靶点,对腔隙性和基底性乳腺癌亚型中的甲羟戊酸代谢失调很重要[31]。因此使用药物抑制HMGCS1可能是乳腺癌患者的一种新型治疗方法。这些发现表明,在乳腺癌细胞中胆固醇代谢异常,其对癌细胞存活起着作用。
6 脂质代谢相关信号通路在乳腺癌中的研究进展
细胞需要对环境作出适当的反应,才能使其生存、维持和生长。细胞外信使分子与同种细胞受体结合,将外界刺激传递到细胞内部。受体的激活引发一系列下游信号事件,导致基因表达的改变。这种将细胞外信号转导到细胞核的过程在癌细胞中是失调的。本节主要介绍在乳腺癌中脂代谢相关的信号通路研究进展。图2 为文中介绍的Notch、Hippo、Hedgehog、Wnt、mTOR 信号通路对脂代谢的调控。
6.1 Notch信号通路
Notch信号是通过Notch配体与Notch受体的结合而启动的,是由细胞与细胞之间的接触介导的。Notch信号通路活化可促进乳腺癌的发生[32]。虽然没有直接证据指出FAO对Notch信号的影响,但研究发现Notch1协调FAO调节肝脏的脂质积累[33]和静止内皮细胞的氧化还原平衡[34]。Notch的信号传导还可由细胞膜的脂质成分来调控[35],还有研究发现胆固醇外流调控Notch1 的启动子,在转录水平上调控Notch信号通路的活性,进而调控造血干细胞的形成和分化[36]。这些表明Notch信号通路与脂代谢存在一定的联系,尤其其在癌症中的机制还有待继续深入研究,这可能为治疗癌症提供新的思路或靶点。

Fig.2 Regulation of lipid metabolism by Notch,Hippo,Hedgehog,Wnt,and mTOR signaling pathways图2 Notch、Hippo、Hedgehog、Wnt、mTOR信号通路对脂代谢的调控
6.2 Hippo信号通路
Hippo信号通路主要由上游的激酶复合物、下游的转录辅因子YAP/TAZ 和转录因子TEADs 组成。Hippo信号通路在维持器官大小和组织稳态中起着至关重要的作用。Hippo信号通路的异常失活或下游效应因子的过度激活会导致细胞过度增殖从而促进肿瘤的发生发展。Hippo信号与脂质代谢有密切的联系。脂肪细胞中Hippo信号通路转录辅助因子磷脂‑赖氨酸磷脂转酰酶在饮食脂肪刺激下直接被上调,TAZ敲除改变了一系列分泌蛋白的表达谱,并削弱了脂肪细胞的肿瘤支持功能,从而影响乳腺肿瘤的生长,并且发现脂肪组织中TAZ 蛋白的高表达也与三阴性乳腺癌患者的不良预后相关[37]。研究发现,SCD1参与了肺癌Hippo途径的调控,该研究还发现脂肪酸代谢是肺癌干细胞的一个关键调节因素[38]。SREBP 和戊二烯酸盐途径可以调控Hippo信号通路活性,对于乳腺癌细胞的增殖有重要作用[39]。
6.3 Hedgehog信号通路
Hedgehog信号通路(HH)接收系统由直接与HH 结合的十二次跨膜蛋白Patching(PTC)和跨质膜转导HH 信号的七次跨膜蛋白Smoothened(SMO)家族组成。Hedgehog 信号通路中PTCH1、GLI 家族锌指1(GLI family zinc finger 1,Gli1)、GLI 家族锌指2(GLI family zinc finger 2,Gli2)在人乳腺干细胞中高度表达,HH的激活能增强乳腺癌干细胞自我更新能力[40]。三阴性乳腺癌中的部分肿瘤细胞能够通过旁分泌HH蛋白来刺激肿瘤相关成纤维细胞合成生长因子,从而以旁分泌的方式使肿瘤细胞发生干细胞化,进而促进肿瘤耐药[41]。脂质代谢可以调节Hedgehog 信号通路[42],胆固醇能共价修饰Hedgehog 及其下游的SMO 蛋白[43],氧化胆固醇可以激活SMO 从而激活HH 信号通路[44]。
6.4 Wnt信号通路
Wnt信号通路是由Wnt配体与跨膜受体形成的异质二聚体复合体结合而启动的。Wnt信号在细胞内主要通过两条通路进行传递,包括经典Wnt/β‑catenin信号通路和“非经典”的信号通路,而后者包含Wnt/Ca2+(钙)通路和Wnt/PCP(平面细胞极性)通路[45]。Wnt/β‑catenin 通路主要调控发育过程中细胞的命运,而Wnt/PCP通路的主要功能是调节细胞骨架组织;Wnt/Ca2+途径的生物学功能尚不清楚[45]。目前多数研究围绕经典Wnt/β‑catenin 信号通路进行,而“非经典”信号通路的机制尚不明确。Wnt信号通路与癌细胞的代谢重编程有关[46],β‑catenin在乳腺癌细胞的代谢和能量平衡调节中起重要作用[47],Wnt 信号通路持续激活导致脂肪积累[48]。
6.5 mTOR信号通路
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型的丝氨酸/苏氨酸激酶,mTOR信号通路在多种疾病中扮演着重要角色,可以促进物质代谢、参与细胞凋亡、自噬等[49]。mTOR 形成两个结构和功能上不同的多蛋白复合物,mTORC1 和mTORC2,它们对应于整个信号网络中的两个主要分支。自从mTOR被发现以来,许多研究已经揭示了mTOR信号转导如何重新编程代谢,以从环境和细胞内来源获取营养,从而产生ATP 以及合成大分子的中间产物[50]。mTOR调节SREBP和其他脂质代谢调节器和效应,mTOR抑制剂可以阻断与脂肪生成有关的基因的表达,并阻止SREBP 的核积聚[51]。mTORC1 也可通过LPIN1 的负调控来调节SREBP,在包括雷帕霉素敏感和不敏感位点在内的多个磷酸位点上,脂质被mTORC1磷酸化,当磷酸化时,LPIN1在细胞核中积聚并抑制SREBP依赖的基因转录[51]。目前抑制mTOR途径的策略和可以更有效地阻断关键代谢途径和其他控制代谢的信号分子的联合治疗。联合脂肪酸合成和mTOR抑制剂有望为肿瘤患者提供益处。乳腺癌中mTORC1抑制剂雷帕霉素和FASN抑制剂的临床前试验显示出协同效应[52]。
已知的癌症干细胞相关信号途径,如Notch、Hippo、Wnt 和Hedgehog,都与脂质代谢有密切关系,因此脂质代谢已被指出是抑制癌症干细胞和治疗癌症的有希望的治疗目标,并且由于该途径中的关键调节因子相对简单和可操作性,脂肪酸和胆固醇代谢的治疗目标有助于在体内和体外抑制癌症干细胞和减少化疗抗性方面取得一些令人印象深刻的进展。
7 脂质代谢异常在癌症中的作用
脂代谢的分子异质性调控在乳腺癌中也很好地体现出来[53]。乳腺癌包括多种不同的分子亚型。受体阳性(receptor‑positivebreast cancers,RPBC)和三阴性乳腺癌之间的mRNA表达比较分析显示,这些亚型之间在脂质的获取、储存和氧化方面存在明显的差异[54]。TNBC 中ACSL4 的过度表达与花生四烯酸代谢增强有关,花生四烯酸可作为环氧化酶2(cyclo‑oxygenase 2,COX2)的底物用于前列腺素合成。与RPBC相比,脂滴协调合成促炎症的前列腺素可能反过来导致TNBC中普遍观察到的更具侵略性的表型[54]。有研究根据不同代谢通路分型的特异性代谢特征将三阴型乳腺癌分为3种不同的代谢表型,研究结果表明,相较于其他亚型,脂质合成型三阴性乳腺癌对于脂肪酸合成酶抑制剂相对敏感,而糖酵解型三阴性乳腺癌则对于糖酵解通路抑制剂相对敏感;还发现,在抑制了糖酵解型三阴性乳腺癌的乳酸脱氢酶活性之后,这一类三阴性乳腺癌可以对免疫治疗产生一定的敏感性[4]。总的来说,与其将脂质平衡失调视为癌细胞的一般特征,不如了解这种变化的分子亚型、组织和整个肿瘤微环境背景,这无疑将导致更好的分层方法和有针对性地应用阻断参与脂质代谢的特定途径的代谢抑制剂[55]。
对乳腺癌组织和细胞的代谢研究发现了几种代谢酶、通量和介质的变化,典型地反映了糖酵解、三羧酸循环活性、谷氨酰胺分解和脂质生物合成途径的增强,这种代谢改变根据乳腺癌亚型和分级而不同,同时也取决于乳腺癌细胞和肿瘤微环境中存在的非肿瘤基质细胞(如成纤维细胞、脂肪细胞、内皮细胞和一些免疫细胞)之间的相互作用[56]。乳腺癌细胞和肿瘤微环境在养分利用和代谢调节水平上存在竞争和共生关系,这种复杂的代谢相互作用影响肿瘤逃避免疫监视机制,并参与肿瘤的进展和转移[56]。这些研究揭示了乳腺癌肿瘤微环境与脂代谢之间的关系,深入了解肿瘤中的代谢相互作用有可能揭示抗肿瘤治疗中的潜在药理学靶点。
脂肪酸、甘油三酯和胆固醇这3种经典脂质在癌细胞和肿瘤中急剧增加并积极生物合成,但癌细胞的脂质代谢在很大程度上仍然是未知的,仍然需要不断探索。脂质代谢由细胞中的复杂信号网络调节,非常复杂。通过不同的信号传导途径,或在不同条件下相同的脂质分子可以产生不同的代谢物。理解和研究癌细胞中脂质代谢的信号途径可以为治疗癌症提供合适的靶标,并确定不同脂质分子的功能可以为临床评估产生新的抗癌药物。显然,更好地了解癌症治疗和细胞凋亡的脂质代谢需要进一步阐明和调查,以开发未来癌症治疗的新方法。
在本文中主要介绍了脂肪酸、甘油三酯和胆固醇这3种脂质, 以 及Notch、 Hippo、 Wnt、Hedgehog和mTOR 5种信号通路与脂代谢在乳腺癌和癌症中的研究进展,文中揭示了脂代谢相关蛋白、基因、通路在乳腺癌中的作用和发现,并提出了目前研究的不足和研究的新方向,希望本文能为大家带来新的研究思路,在癌症研究中得到突破。相信在不久的将来,可以通过探索脂质代谢相关基因、信号通路以及与其他代谢途径的联合作用,研发出新的治疗靶点,开发新药物,减轻乳腺癌患者的痛苦,推动癌症探索进入新里程。

