肿瘤干细胞与肿瘤相关巨噬细胞的相互作用*
师玉露 杨胜富 唐 磊 张继虹
(昆明理工大学医学院,昆明 650500)
肿瘤微环境(tumor microenvironment,TME)由干细胞和分化的癌细胞、 细胞外基质(extracellular matrix, ECM)、 间 充 质 干 细 胞(mesenchymal stem cells,MSCs)、癌相关成纤维细胞(cancer‑associated fibroblasts,CAFs)、内皮细胞(endothelial cells,ECs)、免疫细胞以及细胞因子和生长因子等构成[1],与肿瘤的生长、侵袭、转移、新血管生成、免疫逃逸、肿瘤耐药等密切相关。肿瘤干细胞(cancer stem cells,CSCs)虽然仅占肿瘤的一小部分,但是由于其具有较强的自我更新、多能性和致瘤性等特点,在肿瘤维持、耐药性、复发、转移和扩散等方面发挥了重要作用。除了对肿瘤的发展提供结构支持外,TME 也可为CSCs 生态位(niche)的形成及维持创造有利条件,调控CSCs 的自我更新和转移以及对常规化疗药物的耐药性。如在乳腺癌和结肠癌中,MSCs通过分泌前列腺素E2(prostaglandin E2,PGE2)、IL‑6、IL‑8 和CXCL1 来 促 进CSCs 生 态 位 的 形成[2]。成纤维细胞可以通过分泌骨膜蛋白(periostin,POSTN)为乳腺癌CSCs 创造了转移性生态位[3]。同样,肝癌中肝星状细胞通过分泌肝细胞生长因子(hepatocyte growth factor,HGF)而导致CSCs化疗耐药[4]。这些研究进一步证明TME对CSCs 的功能至关重要。此外一个非常值得关注的领域是炎症细胞在CSCs 生态位中的重要作用。TME 的特征是慢性炎症,通过刺激细胞增殖、激活CSCs并促进转移来促进肿瘤形成[5]。肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)作为TME 中数量最多的免疫细胞,可促进肿瘤炎症反应的发生。在TME 中,TAMs 通常表现为M2表型,通过分泌一系列细胞因子、趋化因子和蛋白酶等,激活各种信号通路如IL‑6/STAT3、TGF‑β、Wnt/β‑catenin等,促进CSCs的形成及其干性维持,加剧肿瘤的进展、转移,以及化疗耐药性。
TAMs 为促进CSCs 存活、自我更新、维持和迁移提供关键信号,反之,CSCs 也可通过招募和激活TAMs来塑造其特定的生态位,进一步促进肿瘤的 发 生。如CSCs 产 生CCL2[6]、IL‑6、IL‑4、VEGF 和CSF‑1[7‑8]等促炎细胞因子和趋化因子将巨噬细胞募集到TME,通过分泌如IL‑4、TGF‑β1和MIC‑1 等因子促进巨噬细胞极化为TAMs[9‑10],进一步增强肿瘤的发生。因此,TAMs 和CSCs 是TME 中促进肿瘤生长的关键细胞,二者之间相互作用是肿瘤发生发展的重要因素,可增加肿瘤的耐药性,促进肿瘤的复发。本文旨在阐明CSCs 和TAMs在TME中的相互作用机制及相关信号通路的研究进展,并总结了靶向这些相互作用的临床意义。
1 CSCs对TAMs的调控
TME 中的各类细胞因子,如VEGF、CCL2 和CSF‑1 等将巨噬细胞募集至TME[11],巨噬细胞在各种巨噬细胞极化相关因子的作用下,通过mTOR、NF‑κB、Notch、Stat6、PPARγ和c‑Myc等信号通路极化为经典激活(M1) 或交替激活(M2)表型[12]。在TME中TAMs约占肿瘤的50%,主要表现为M2表型,通过产生大量生长因子、细胞因子和ECM 重塑分子(如CCL2、CXCL12、CXCR4、TGF‑β、VEGF、PDGF、COX‑2 和金属蛋白酶)等来调节肿瘤生长、迁移和血管生成,促进几乎所有肿瘤的进展[13]。因此,CSCs促进巨噬细胞募集并诱导其向M2 型TAMs 转化也是不可忽略的重要促肿瘤机制。
1.1 CSCs调控巨噬细胞的募集
在各种癌症类型中,CSCs 可通过不同的分子机制促进巨噬细胞的募集(图1a①)。Otvos 等[14]研究发现,胶质母细胞瘤中的CSCs 分泌大量的巨噬细胞迁移抑制因子(macrophage migratory inhibitory factor,MIF),以CXC 受 体2 (CXC receptor 2,CXCR2)依赖的方式促进巨噬细胞向肿瘤部位的募集。同样,胶质母细胞瘤和胆管癌中,CSCs也可特异性分泌POSTN与巨噬细胞表面受体整合素αvβ3结合来招募巨噬细胞[15‑16]。
此外,CSCs 的基因和表观遗传学改变也可通过调节趋化因子的产生来促进巨噬细胞的募集。如在肝癌中EGFR/AKT 的激活提高了CSCs 中Yes 相关蛋白(Yes‑associated protein,YAP)/TEAD家族转录因子复合物的转录活性,进而促进了巨噬细胞趋化因子CCL2和巨噬细胞集落刺激因子M‑CSF的表达[17]。在非小细胞肺癌中泛素特异性蛋白酶17(ubiquitin specific protease 17,USP17)的增加促进了癌细胞的干细胞性,并通过增加细胞因子TNF‑α、IL‑1β 和IL‑6 的产生来促进巨噬细胞的浸润[18‑19]。在膀胱癌中,组蛋白修饰基因赖氨酸(K)‑特异性去甲基化酶6A(histone modifier gene lysine(K)‑specific demethylase 6A,KDM6A)突变引起的功能缺失增强了CSCs 的干细胞性和IL‑6 和CCL2的分泌,从而增加了巨噬细胞的募集[20]。
1.2 CSCs调控巨噬细胞的极化
CSCs 不仅促进巨噬细胞的募集,还可以影响巨噬细胞的极化状态。研究表明,CSCs 能够通过分泌多种细胞因子和生长因子促进巨噬细胞向M2表型极化(图1a ②)。如在胶质瘤干细胞(glioblastoma stem cells,GSCs)中,砷酸盐耐药蛋白2(arsenite‑resistance protein 2,ARS2)通过激活新的靶基因MGLL 的转录编码单酰基甘油脂肪酶(monoacylglycerol lipase,MAGL)的产生,促进PGE2 的分泌诱导巨噬细胞向M2 表型极化[21]。另外,GSCs可优先表达和分泌Wnt诱导分泌 蛋 白 1 (Wnt‑induced signaling protein 1,WISP1),并通过旁分泌途径激活巨噬细胞上的整合 素α6β1/AKT 通 路 来 维 持M2 巨 噬 细 胞 的 存活[22]。同样地,Liao等[23]进一步证实了WISP1在各种类型的肿瘤中均与M2 型TAMs 的极化和维持相关,揭示了在不同肿瘤中WISP1 对M2 型TAMs的调控可能是一种普遍现象。类似地,在卵巢癌[24]、膀 胱 癌[20]、胶 质母细胞瘤[9,25]与乳腺癌[26]中,CSCs分泌的IL‑6和IL‑10使TAMs向M2表型转化。另外在卵巢癌中,研究人员发现,卵巢癌干细胞(ovarian cancer stem‑like cells,OCSCs)可以通过激活环氧化酶2(COX‑2)/PGE2/JAK 信号通路,将巨噬细胞极化为抗炎的M2表型。这些发现为卵巢癌的有效预防和治疗提供了新的研究方向和潜在的治疗靶点[27]。在胶质瘤中,CSCs通过产生巨噬细胞抑制因子‑1(macrophage inhibitory cytokine‑1,MIC‑1)和粒细胞巨噬细胞刺激因子(granulocyte‑macrophage colony‑stimulating factor,GM‑CSF)等来驱动巨噬细胞极化[9,28]。另外,CSCs 也可产生促炎因子和可溶性因子(如CCL2和CSF‑1)招募并极化巨噬细胞[29]。
除分泌因子外,CSCs 还通过外泌体的释放来调控巨噬细胞的极化。如GSCs释放外泌体中富含的多种因子(尤其是介导免疫抑制的关键中枢分子STAT3)促进单核细胞向免疫抑制的M2 型巨噬细胞分化[30]。总之,以上研究表明,CSCs 介导的M2 巨噬细胞积累有助于塑造免疫抑制、促肿瘤的TME。
2 TAMs对CSCs的调控
与正常干细胞一样,CSCs 存在于由多种细胞类型组成的细胞生态位中,如免疫细胞、MSCs、内皮细胞和CAFs等,通过分泌各种细胞因子,共同提供了保护和促进CSCs 功能的独特微环境,以促进肿瘤的发生、血管生成、侵袭、转移和耐药性等[5,31]。TAMs 作为CSCs 生态位中的重要免疫细胞,可以通过以下信号通路和细胞因子对CSCs 及其生态位的维持进行调控(图1b)。

Fig.1 Regulatory mechanism of TAMs and CSCs图1 TAMs与CSCs的调控机制
2.1 IL-6/STAT3信号通路
作为一种多效细胞因子,IL‑6不仅调节细胞免疫反应,还可通过激活多种致癌途径促进肿瘤发展。研究发现,IL‑6是维持CSCs特性的重要因子,且与CSCs数量呈一定的剂量关系[32]。IL‑6主要通过介导IL‑6/STAT3 信号转导通路来调节肿瘤的增殖与分化。TAMs分泌的IL‑6可通过激活STAT3来促进非CSCs 向CSCs 的转化及CSCs 的自我更新。如在乳腺癌的裸鼠成瘤实验中发现,巨噬细胞分泌IL‑6 诱导STAT3 的磷酸化来促进乳腺癌中非CSCs向CSCs 的转化[33]。在乳腺癌异种移植模型中,IL‑6 通过与其受体gp130 结合而激活STAT3,促进乳腺CSCs 的自我更新[34]。另有研究发现,TAMs衍生的IL‑6通过激活STAT3诱导CD44+干细胞样细胞扩增[35]。Yao等[25]在人胶质母细胞瘤中的研究发现,巨噬细胞通过分泌IL‑6激活STAT3和B7‑H4的启动子结合从而增强B7‑H4的表达,通过B7‑H4介导胶质瘤CSCs 的转化并导致肿瘤的不良预后。由此可见,TAMs旁分泌的IL‑6激活STAT3通路是诱导CSCs转化的重要机制之一。
2.2 TGF-β信号通路(TGF-β signaling)
TGF‑β具有调控发育、稳态、组织再生和免疫耐受等多种生理功能。然而,TGF‑β在肿瘤异常扩增、侵袭和转移等多种恶性生物学行为中也发挥着重要作用。研究发现,TGF‑β 是CSCs 转化和存活的重要调节因子,可在肿瘤的不同时期和不同部位激活并募集CSCs,参与组织重塑[36]。TAMs 可通过旁分泌TGF‑β的方式促进肿瘤的迁移、侵袭及恶性进展。Ye 等[37]发现,巨噬细胞通过TGF‑β1 信号通路增强胶质瘤干细胞样细胞的侵袭。此外,上皮 间 质 转 化(epithelial‑mesenchymal transition,EMT)是使癌细胞获得CSCs 样特性并维持CSCs干性的重要过程,M2型TAMs通过分泌TGF‑β1诱导肝癌细胞发生EMT,获得较高的侵袭能力并增强CSCs特征[38],通过耗竭TGF‑β1可逆转EMT从而阻断肿瘤干细胞样特性的获得[39]。以上说明TAMs 旁分泌的TGF‑β 在CSCs 转化和维持中发挥重要作用,然而TGF‑β 调节CSCs 的下游信号通路仍需进一步研究。
2.3 Wnt/β-catenin信号通路
已知Wnt/β‑catenin 信号通路与CSCs 及其干性维持相关,TAMs 可以分泌Wnt 配体来调节Wnt 通路。当Wnt 家族蛋白如Wnt1a、Wnt3a 与Fzd 受体和LRP5/6 共受体结合时,可激活Wnt 信号通路。Wnt‑Fzd‑LRP 复合物的形成进一步诱导GSK‑3β 从调节复合物中移位,随后导致β‑catenin入核,调节一系列Wnt靶基因的表达。最近Chen等[40]研究发现,来源于M2样TAMs的TNF‑α通过Wnt/β‑catenin途径促进肝癌细胞的EMT和干细胞样特性。此外,M2样TAMs可以激活甲状腺癌细胞中的Wnt/β‑catenin信号通路,唑来膦酸(zoledronic acid,ZA)通过抑制M2样TAMs极化和Wnt/β‑catenin通路抑制M2样TAMs 诱导的肿瘤细胞增殖、干性维持和转移[41]。Raghavan等[24]采用异种球体模型,在体外3D 微环境中将CSCs 与巨噬细胞紧密结合,发现CSCs 和巨噬细胞通过Wnt 信号相互作用,促进早期肿瘤微环境的形成。在该球体模型中,CSCs 通过分泌IL‑10 和Wnt 配体激活M2 巨噬细胞,同时巨噬细胞来源的Wnt 配体(特别是Wnt5b)以及IL‑6 促进CSCs 的富集,抑制巨噬细胞中Wnt5b 的表达,或使用Ruxolitinib、sc144 抑制IL‑6 的下游激活,会导致球体中ALDH+细胞显著减少。重要的是,该研究发现,Wnt 信号通路双向参与了CSCs 与巨噬细胞的相互作用,表明其可作为潜在靶点以降低卵巢癌的干细胞特性、化疗抗性、侵袭性和免疫抑制等[24]。
2.4 其他细胞因子及信号通路
TAMs促进CSCs的特性是通过多种细胞因子、信号通路共同作用的。除以上细胞因子及相关信号通路的作用外,TAMs 分泌的多效生长因子(pleiotrophin,PTN)与CSCs 膜上PTPRZ1 受体结合后激活下游信号通路Fyn‑AKT,从而维持CSCs的特征,促进肿瘤生长及对化疗药物抗性的产生[42]。Gomez等[43]在头颈部鳞状细胞癌的研究中发现,TAMs 增加了透明质酸(hyaluronic acid,HA) 的产生,HA 与CSCs 表面特异性标志物CD44 结合,通过激活PI3K‑4EBP1 信号上调干细胞标记物SOX2 和乙醛脱氢酶1A1 (aldehyde dehydrogenase 1A1,ALDH1A1),强调了TME 中TAMs与CSCs相互协作对维持CSCs特性的重要作用。另外,Yang等[44]研究发现,非小细胞肺癌中TAMs 分 泌 的IL‑10 会 激 活JAK1/STAT1/NF‑κB/Notch1 信号通路,从而增强和促进非小细胞肺癌的CSCs 样特性和肿瘤生长。最近研究人员揭示了TAMs 促进前列腺癌干细胞(prostate cancer stem cells,PCSCs)的潜在机制,发现来自TAMs 的CCL5 与PCSCs 表面的受体CCR5 结合,从而促进β‑catenin的表达及其与PCSCs中STAT3启动子的结合,促进PCSCs 的自我更新和前列腺癌细胞转移[45]。这与先前研究结果一致,即TAMs 可以通过激活STAT3 通路显著促进前列腺癌的进展和ADT(雄激素剥夺治疗)抵抗[46]。另外,TAMs也可通过调节JAK2/STAT3/miR‑506‑3p/FoxQ1通路诱导EMT 来增强结直肠癌的迁移、侵袭和循环肿瘤干 细 胞(circulating tumor cell,CTC) 介 导 的转移[47]。
此外,研究发现了细胞间接触依赖信号在CSCs 生态位中也具重要作用,如TAMs 上的跨膜蛋白LSECtin和乳腺癌细胞表面受体BTN3A3结合促进乳腺癌干细胞的分化和肿瘤的生长[48]。由此可见,巨噬细胞可通过多种机制对CSCs进行调控。
3 TAMs与CSCs的靶向治疗
基于TAMs和CSCs在肿瘤进展中的重要作用,研究人员正在努力寻找靶向CSCs 和TAMs 的方法[49‑51]。靶向CSCs 的临床试验包括SHH、Notch、Wnt、HIPPO、STAT3 和NANOG 通路[49,51‑52]及抗CD44抗体抑制剂[53]等(图2a)。目前,SHH抑制剂vismodegib已被批准用于转移性或局部晚期基底细胞癌[54]。尽管靶向CSCs具有很大前景,但尚未发现显著效果,可能是缺乏真正精准的CSCs 靶点[49,55]。同样,靶向TAMs 的治疗包括:a. 靶向TAMs 的募集;b.靶向TAMs 的极化;c.靶向巨噬细胞的存活等。靶向巨噬细胞募集药物如CCR2、CXCR4、整合素亚单位α4(integrin subunit alpha 4,ITGA4)和ITGA5 抑制剂,靶向巨噬细胞极化的 药 物 如Toll 样 受 体4 (Toll‑like receptor4,TLR4)、TLR7、TLR9 和CD40 激活剂和PI3Kγ 抑制剂,以及靶向巨噬细胞存活的药物如CSF1R 抑制剂正在进行临床试验[50,56](图2b)。与靶向CSCs 相似,靶向TAMs 的治疗也具有一定的局限性,如CSF1R 抑制在胶质母细胞瘤中抗肿瘤效果并不明显,部分原因是胶质瘤细胞中PI3K 信号所导致的耐药性[57]。因此,更有目的地靶向CSCs和TAMs 的相互作用及它们在特定环境中的可塑性,可能会产生更强的效果。例如,在许多肿瘤类型中,IL‑6/STAT3和PI3K对于调节CSCs和巨噬细胞向促肿瘤表型极化都是至关重要的,抑制这些通路取得了显著的抗肿瘤活性[20,26,49‑50](图2c)。此外,选择具有高CSCs 和TAMs 特征的患者可以增强靶向这些途径药物的反应[49‑50]。
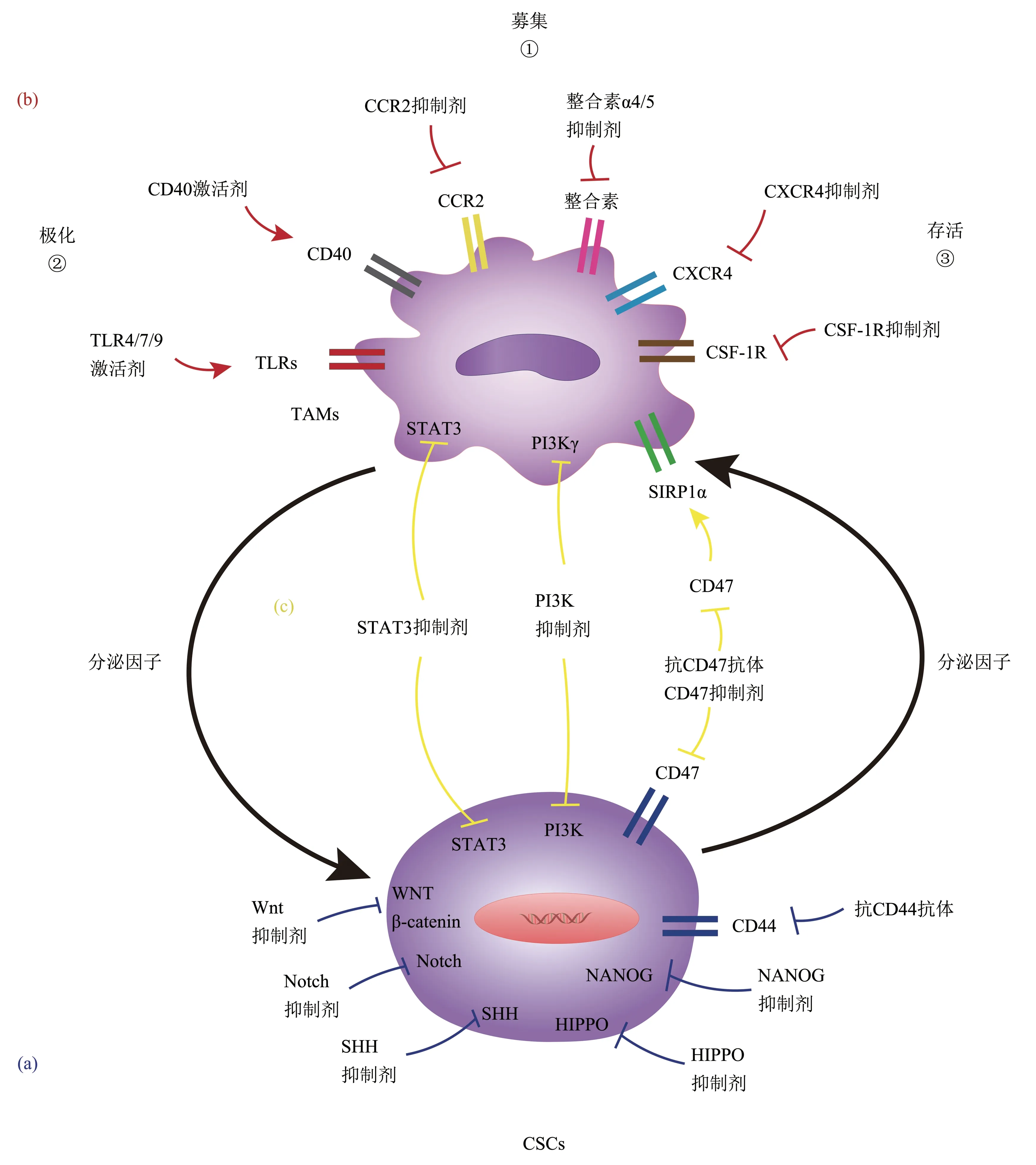
Fig.2 TAMs and CSCs targeting strategies in cancer therapy图2 TAMs与CSCs在癌症治疗中的靶向策略
阻断TAMs 与CSCs 相互作用,或使用联合策略靶向TAMs 和CSCs 是治疗肿瘤非常有前景的疗法。阻断CD47‑信号调节蛋白α(signal regulatory protein‑α,SIRPα)通路可能是阻断CSCs 与TAMs相互作用的有效策略。CD47 是一种在CSCs 和癌细胞上表达的跨膜蛋白,是一种“不要吃我”信号[58]。CD47与巨噬细胞上SIRPα的相互作用抑制TAMs 吞噬作用[59]。抗CD47 疗法在体外增加了巨噬细胞对CSCs 的吞噬能力,在体内减少肿瘤负担[58,60‑61](图2c),当与化疗药物联合作用时,效果 进 一 步 增 强[58]。 CD47 单 抗(Hu5F9‑G4、SFR231、CC‑90002 和IBI188) 和小分子抑制剂(TTI‑621 和ALX148)正在进行临床试验[50,56]。另一个破坏CSCs 与TAMs 相互作用的策略是靶向CSCs与TAMs分泌因子。例如,在GBM和前列腺癌的小鼠模型中,抑制CSCs特异性POSTN及其相关途径[15]或抑制TAMs 分泌的CCL5[45]可阻断CSCs 与TAMs 的相互作用,抑制肿瘤生长,并延长生存期。
由于严重毒性和耐药性的快速进展,标准的化疗对晚期转移性疾病治疗的前景有限。因为CSCs和TAMs 在耐药性的发展中起着关键作用[49,62],因此阻断CSCs 与TAMs 相互作用可以改善对化疗的耐药反应。化疗耐药肿瘤的CSCs 可分泌细胞因子,促进巨噬细胞向促肿瘤表型极化,从而塑造促进肿 瘤 进展 的TME 形成[29],减少TAMs 可降低CSCs 的干性和转移,并提高了胰腺癌的化疗反应性[63]。从机制上讲,TAMs通过释放MFG‑E8促进了CSCs的干性和化疗抗性,故使得CSCs中STAT3和SHH通路激活[64]。因此,靶向CSCs与TAMs相互作用应用于新型癌症治疗以及增强化疗效果等方面具有很大潜力。
4 总结与展望
肿瘤细胞可以改变TME,TME 又反过来作用于肿瘤细胞,促进肿瘤的恶性行为。因此,靶向TME 为癌症治疗提供了新的希望,是当前癌症研究的热点。本综述对TME中CSCs与TAMs相互作用的调控机制进行了阐述,主要包括CSCs 对TAMs的募集和极化,以及TAMs在促进CSCs的形成及维持其生态位等方面的重要作用。因此,CSCs 与TAMs 的相互作用机制为肿瘤治疗提供了潜在的治疗策略。如共同靶向CSCs 和TAMs 中(如STAT3 和PI3K)激活的重要通路,抑制负责CSCs 和TAMs 相互作用的分子(如CD47‑SIRPα),以及抑制共同支持CSCs 和TAMs 的可溶性因子(如IL‑6)等。对CSCs与TAMs相互作用的研究揭示了其相互作用的分子机制在驱动肿瘤发生、转移和化疗耐药性中的关键作用。因此,靶向CSCs 与TAMs 的相互作用可破坏CSC 与TAMs 的相互依赖性,达到更好的肿瘤治疗的效果。
虽然对CSCs 与TAMs 相互作用的机制研究日渐成熟,但是为了寻找更有效和系统的肿瘤治疗策略,还需要更多的深入研究。充分了解TAMs 与CSCs 相互作用的分子机制和信号通路,探寻潜在的抗肿瘤治疗靶点将是研究的主要方向之一。

