基于国产微滴数字PCR的SNP快速检测技术研究*
林培双 王 寒 祝令香 贝 蕾 黄 江 赵雯婷** 李彩霞1,**
(1)贵州医科大学法医学院,贵阳 550004;2)公安部物证鉴定中心,法医遗传学公安部重点实验室,现场物证溯源技术国家工程实验室,北京 100038;3)新羿制造科技有限公司,北京 100038)
单 核 苷 酸 多 态 性 (single nucleotide polymorphism,SNP)是继短串联重复序列(short tandem repeat,STR)之后的第三代法医遗传标记,指由单个核苷酸变异所形成的DNA序列多态性[1]。与STR 相比,SNP 在人类基因组中数量多、分布广、遗传稳定[2],不仅可用于个体识别和亲子鉴定,还能用于刻画生物检材来源人的族群地域、体貌特征等表型[3‑5],从而快速锁定犯罪嫌疑人范围,辅助案件侦查。
法医现场生物检材的DNA 存在微量、降解、污染等问题,因此对检验方法的灵敏度、稳定性、抗抑制性要求较高。目前法医SNP 检验平台包括毛细管电泳(capillary electrophoresis,CE)、质谱、二代测序、芯片检测等,其中微测序结合毛细管 电 泳 检 测(SNaPshot)[6]或 飞 行 时 间 质 谱(MALDI‑TOF MS)[7]是当前法医DNA实验室常用的检验方法,但这两种方法检测时间长达7~10 h,操作步骤繁琐,对抑制剂不耐受,而二代测序和芯片检测对样本DNA 质和量要求高,耗时更长(>24 h),操作复杂且成本更高,很难在法医DNA基层 实 验 室 大 范 围 推 广[8]。数 字PCR (digital polymerase chain reaction,dPCR)在生物医学领域已经展现出灵敏度高、特异性强、操作简便快捷的优 势[9‑11],但 在 法 医DNA 检 验 领 域 的 应 用 研 究较少。
dPCR 主要分微滴式和芯片式两种,其中微滴数字PCR(droplet digital PCR,ddPCR)的应用更广泛[12]。ddPCR 的工作原理为:首先在PCR 扩增反应前将包含模板的常规PCR体系通过“油包水”形式微滴化处理,以实现数万个微反应体系的平行扩增,然后通过探针法检测各微滴终点荧光信号值,最后根据阴阳性统计结果和荧光类型判断SNP分型[13]。这种微滴化处理技术有效地降低了非目标物质干扰,提高目标物质的检测。
国内外研究发现,EPAS1基因上的5‑SNP单倍型在高原与平原人群中的分布有显著差异[14]。本实验室前期构建了5‑SNP 单倍型的SNaPshot 检测体系[15‑16],体系的灵敏度和特异性符合法医学检验需求,但检测周期长,对陈旧、接触及含抑制剂类(环境污染)检材的检出率较低。本研究在国产新羿TD‑1 ddPCR 平台上,利用TaqMan 双探针法,建立了5‑SNP 单倍型的ddPCR 检测体系,从准确性、稳定性、灵敏度、检材适应性及抗抑制性等方面对其性能进行了评估,分析了ddPCR 在法医学检验领域的应用效果和价值。
1 材料与方法
1.1 材料
1.1.1 研究对象
本研究检测70份无关个体DNA样本,来源于国家科技资源共享服务平台计划项目(YCZYPT[2017]01‑3)。采集实验室人员(编号SY)的8种不同类型检材:血卡、血纱布、唾液、口腔拭子、带毛囊头发、烟头和两种接触性检材(瓶口和手机屏幕擦拭物)。9948 标准品DNA 购自苏州新海生物科技股份有限公司。本研究已通过公安部物证鉴定中心伦理委员会审查(编号:2017‑001),所有参与者均签署了书面知情同意书。
1.1.2 主要仪器和设备
微滴数字PCR 仪(中国新羿制造科技有限公司,TD‑1);PCR扩增仪(杭州朗基科学仪器有限公司,A300);微量紫外分光光度计(美国Nano Drop 公司,ND‑2000c);旋涡振荡器(中国其林贝尔公司,QL‑866);高速离心机(德国Eppendorf公司,Centrifuge 5804 R)。
1.1.3 样本DNA提取
采用QIAamp®DNA Mini M48 试剂盒(德国,QIAGEN 公司)提取检材DNA,ND‑2000c 分光光度计定量,并稀释至0.5 μg/L。
1.1.4 SNP位点信息
选取前期已发表文献[16]中EPAS1 基因上5 个SNP 位点,各位点名称、位置、等位基因信息见表1。

Table 1 The information of 5-SNP haplotype of the EPAS1 gene
1.2 方法
1.2.1 引物探针设计与合成
从Ensemble dbSNP 数据库下载各位点基因组序列,分别用Primer Premier 5.0 和Primer Express 3.0 软件设计引物和探针。各SNP 位点设计两条位点特异性TaqMan探针,分别用FAM和VIC荧光标记修饰。引物和探针均由生工生物工程(上海)股份有限公司合成,引物和探针序列信息见表2。

Table 2 The primer and probe information for 5-SNP used in ddPCR
1.2.2 ddPCR体系和程序
ddPCR 反应 体系:2×ddPCR SuperMix (含UNG) 15 μl,10 μmol/L 上 下游 引物 各1.5 μl,10 μmol/L 的FAM 和VIC 标记探针各0.9 μl,DNA模板(基因组DNA)1 μl,蒸馏水补足至终体积30 μl;配置体系加至微滴生成芯片水相孔,180 μl微滴生成油加入油相孔进行微滴生成,然后进行ddPCR 扩增。反应程序设置:95℃10 min;94℃30 s,58℃1 min, 40 个循环;12℃5 min。扩增结束后,使用微滴分析仪进行数据读取。采用Chip Reader 软件分析数据,根据生成数据提取检测位点FAM 和VIC 通道对应阳性和阴性荧光信号均值,计算位点FAM 和VIC 两通道对应AMSI(absolute mean signal intensities)值,即检测位点对应阳性荧光信号均值减去阴性荧光信号均值[17]。
FAM 和VIC 通道判断阳性标准:a. 信噪比,检测位点AMSI值与该位点空白对照背景荧光信号均值比值(ratio 值) >1,排除假阳性信号;b.AMSI>1 000;c.阳性微滴数≥4。同时满足上面3个条件时,该位点对应通道可判断为阳性。
分型标准:a. 杂合子,FAM 和VIC 两通道均满足阳性判断标准;b.纯合子,当仅有一个通道满足阳性判断标准。
1.2.3 SNaPshot检测流程
基于SNaPshot 技术的5‑SNP 分型检测流程、体系和PCR扩增程序均参照文献[15]。
1.2.4 引物探针特异性
测试5个位点均为纯合子的样本9948标准品和102T,5 个位点均为杂合子的样本NY20,各位点均设立空白对照。
1.2.5 体系性能评估
a.准确性。ddPCR 检测26 份样本和9948 标准品DNA,同时委托生工生物工程(上海)股份有限公司进行Sanger测序,比较分型结果的一致性。
b.稳定性。选取杂合样本(编号NY20)对各位点重复检验3次,荧光信号检测在两张芯片内完成,评估在同一芯片和不同芯片检测分析中分型一致性和荧光信号波动情况,荧光值稳定性以变异系数(coefficient of variation,CV)≤25%衡量[18]。
c. 灵敏度。将9948 标准品DNA 梯度稀释为0.5、0.25、0.125、0.062 5 和0.031 25 ng,各浓度重复检测3次,评估5个SNP位点均准确分型时的最低模板用量。
d.法医检材适应性。为验证平台是否适应法医各类型案件检材,采用实验室人员(编号SY)模拟的8 种不同类型检材DNA,含血卡、血纱布、唾液、口腔拭子、带毛囊头发、烟头以及两种接触性检材。其中接触性检材1是瓶口擦拭物,接触性检材2 是手机屏幕擦拭物,均采用干棉签擦拭获取。各类型检材设置3次重复实验。
e. 抗抑制能力。为适应法医现场检材的特殊性[19‑20],选取常见抑制剂血红素(hematin)、腐植酸(humic acid)和靛蓝(indigo),按1.2.2和1.2.3实验流程分别进行检验。血红素浓度稀释至350、700、1 050、1 400 μmol/L;腐植酸浓度稀释至150、200、250、300 μg/L;靛蓝浓度稀释至150、200、250、300 mmol/L;各浓度取1 μl替代原体系蒸馏水。 实验样本选取9948 标准品DNA(0.5 μg/L),每次实验将不加抑制剂体系作为标准阳性对照,并设立空白对照,每个浓度重复检测1次。
f. 样本测试。检测70 份具有明确海拔信息的样本(表3),使用PHASE v2.1.1 软件(10 000 interactions,10‑step thinning interval,和10 000 burn‑ins)分析样本所有组合单倍型[14],评估样本高原适应性。

Table 3 Information of test population samples
1.2.6 统计学分析
应用SPSS 软件对数据进行统计分析,使用Shapiro‑Wilk 检验数据正态性,利用t 检验分析数据;当P<0.05时,表示数据差异具有统计学意义。应用GraphPad Prism和Origin软件绘图。
2 结果与分析
2.1 引物探针特异性
采用5个SNP位点对应的3种基因分型样本和空白对照验证引物探针特异性。各位点引物探针组合仅对其正确分型样本产生阳性扩增信号:9948标准品每个位点仅VIC 通道检测阳性信号,102T样本每个位点仅FAM通道检测阳性信号,NY20样本FAM 和VIC 两通道均显现阳性信号(图1)。图2显示,各样本检测阳性微滴簇聚集紧凑,与背景信号区分明显;空白对照(no template control,NTC)未检出非特异阳性扩增信号,表明引物探针可以特异的区分5个SNP位点的两种等位基因。
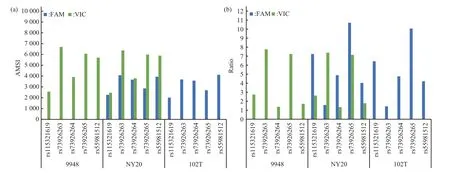
Fig.1 AMSI and ratio data of the specificity verification for each SNP

Fig.2 2D ddPCR flourescence signal map of the specificity verification for each SNPThe Y‑axis presents FAM signal(blue)and X‑axis presents VIC signal(green);the gray dots present double‑negative droplets;the orange dots present double‑positive droplets;NTC presents no template control.
2.2 体系性能评估
2.2.1 准确性
ddPCR 体系共计测试27 份样本DNA 获得135个基因型,所有位点分型均满足阳性判读标准,检出率100%,与Sanger测序结果一致率为100%。
2.2.2 稳定性
杂合样本(编号NY20)各位点3 次重复实验检测总微滴数处于33 389~51 450之间(>30 000个微滴),保证ddPCR 实验结果分析的准确性。表4数据分析显示,FAM 和VIC 通道阳性荧光信号值相对稳定,两通道荧光信号均值的变异系数均≤10%;各位点检测分型结果一致,均判读为杂合子。所以平台微滴生成稳定,构建的体系稳定性及重复性良好。
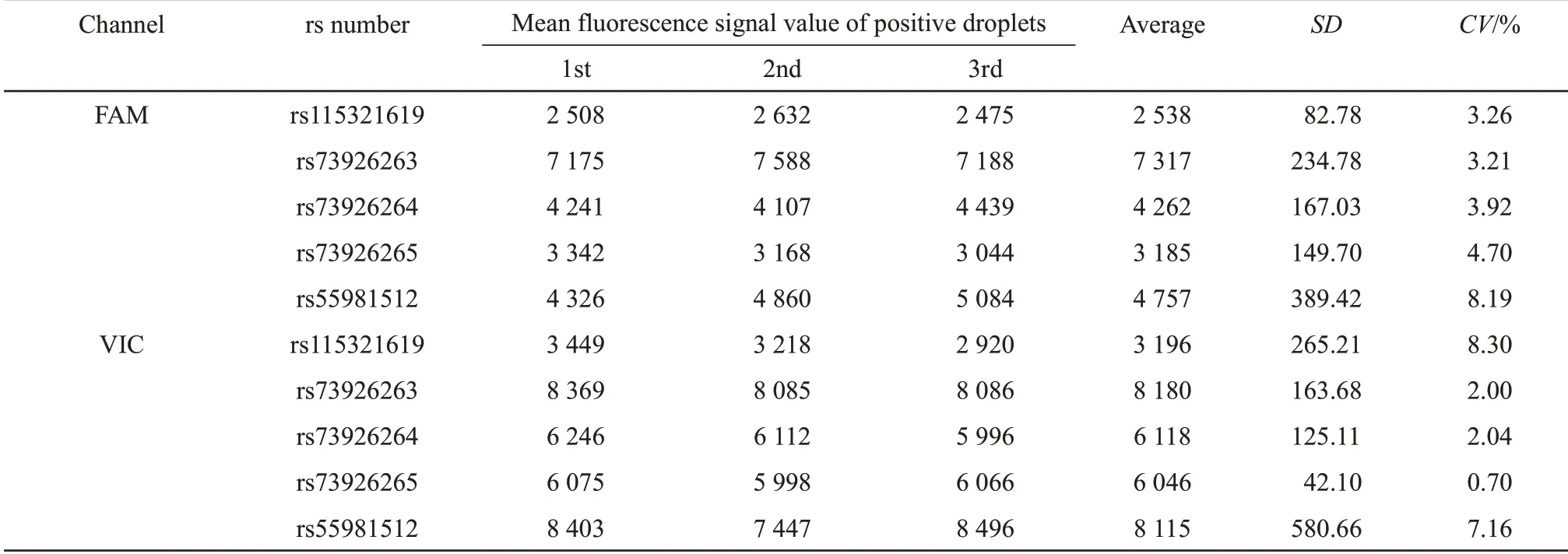
Table 4 Repeatability detection of sample NY20 to each SNP
2.2.3 灵敏度
对0.5、0.25、0.125、0.062 5 和0.031 25 ng 共5 个梯度9948 标准品DNA 进行ddPCR 检测。如图3所示,当DNA模板量≥0.062 5 ng时,各位点检测信号均达阳性标准,且不同DNA 模板量间的检测信号值无显著差异性(P>0.05)。但当DNA模板量为0.031 25 ng时,个别位点检测信号与0.5 ng比较明显降低(P<0.05),且rs73926264、rs55981512两位点信号未达阳性标准。附件表S1显示,阳性微滴数目随着DNA模板量的降低而减少:当DNA模板量为0.031 25 ng 时,rs73926264 位点有1 次未检出阳性微滴,信号丢失,无法判型。因此,ddPCR体系的最低DNA检出量为0.312 5 ng(0.062 5 ng×5个SNP位点)。
2.2.4 法医检材适应性
检测编号SY的8种类型检材是血卡、血纱布、唾液、口腔拭子、带毛囊头发、烟头、瓶口和手机屏幕擦拭物(脱落细胞)。由图4 可见,不同检材位点检测信号强度可能存在差异(P<0.05),但这种信号差异未影响位点分型判读,所有检材仍均检出分型,不同检材各位点分型一致,表明构建ddPCR体系适合多类型法医检材的检测。

Fig.3 AMSI and ratio data for each SNP at different input of reference DNA 9948 in VIC channelAsterisks in each chart denote significantly different measurements compared to the 0.5 ng reference DNA 9948(**P<0.01,***P<0.001).
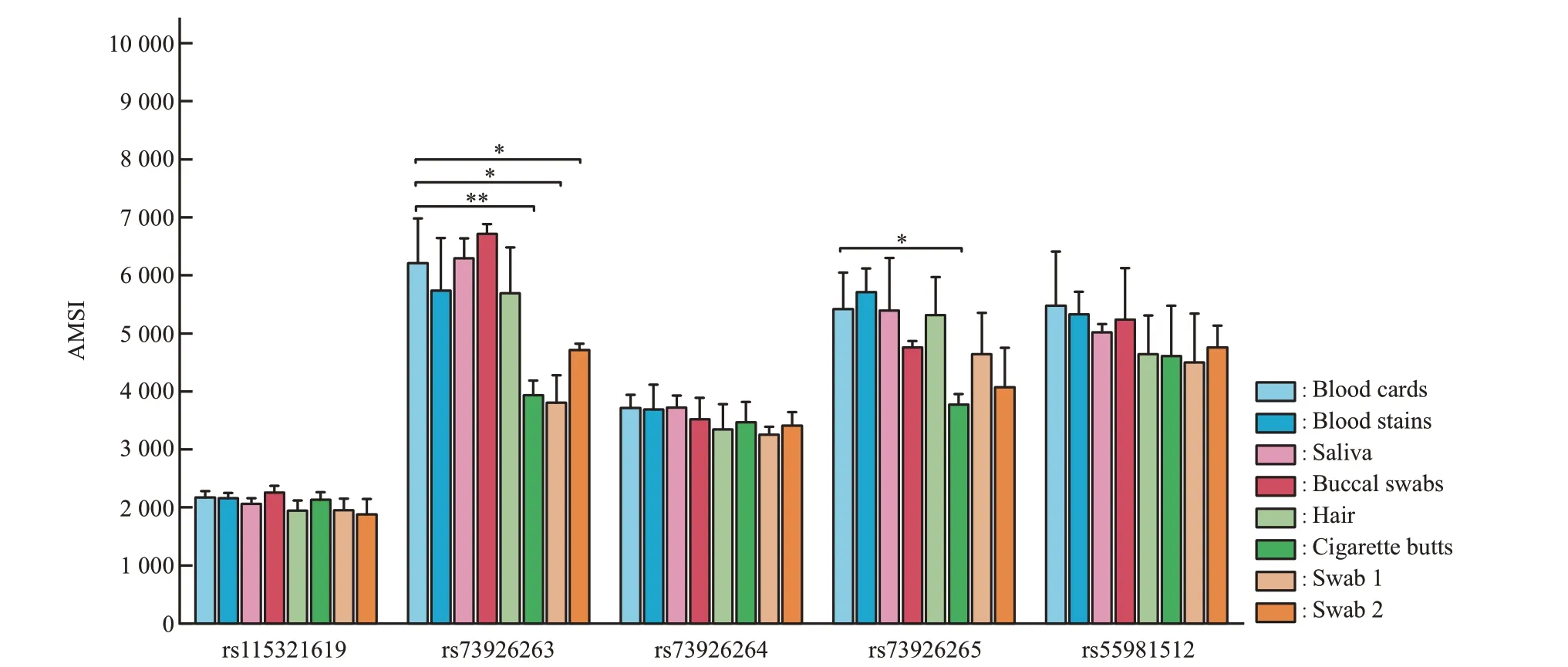
Fig.4 AMSI data for each SNP of sample SY in VIC channelSwab 1 presents bottle mouth swab; Swab 2 presents mobile phone screen swab; asterisks in each chart denote significantly different measurements compared to blood cards(*P<0.05,**P<0.01).
2.2.5 抗抑制能力
基于SNaPshot 和ddPCR 技术分析3 种常见抑制剂对9948 标准品DNA 检测的干扰情况。SNaPshot 检验中,仅rs55981512 位点,在加入150 μg/L腐植酸时,检出1次有效峰型;其他浓度抑制剂检测时,所有位点均未检测信号峰(附件图S1)。ddPCR 检测结果如图5 所示,加入血红素(350~1 400 μmol/L)、腐植酸(150~300 μg/L)和靛蓝(150~300 mmol/L)时,随着抑制剂浓度不断增加,个别位点检测信号与不含抑制剂比较可能出现波动或降低,但各位点阴阳性微滴仍能进行明显区分;对图6数据分析表明,添加与不添加抑制剂的9948标准品DNA的ddPCR检测中,个别位点由于抑制剂浓度升高,虽然生成总微滴数有下降可能,但阳性微滴数目变化无显著差异(P>0.05),表明模板扩增未受抑制剂干扰。所以ddPCR 体系对抑制剂具有较强的耐受性。
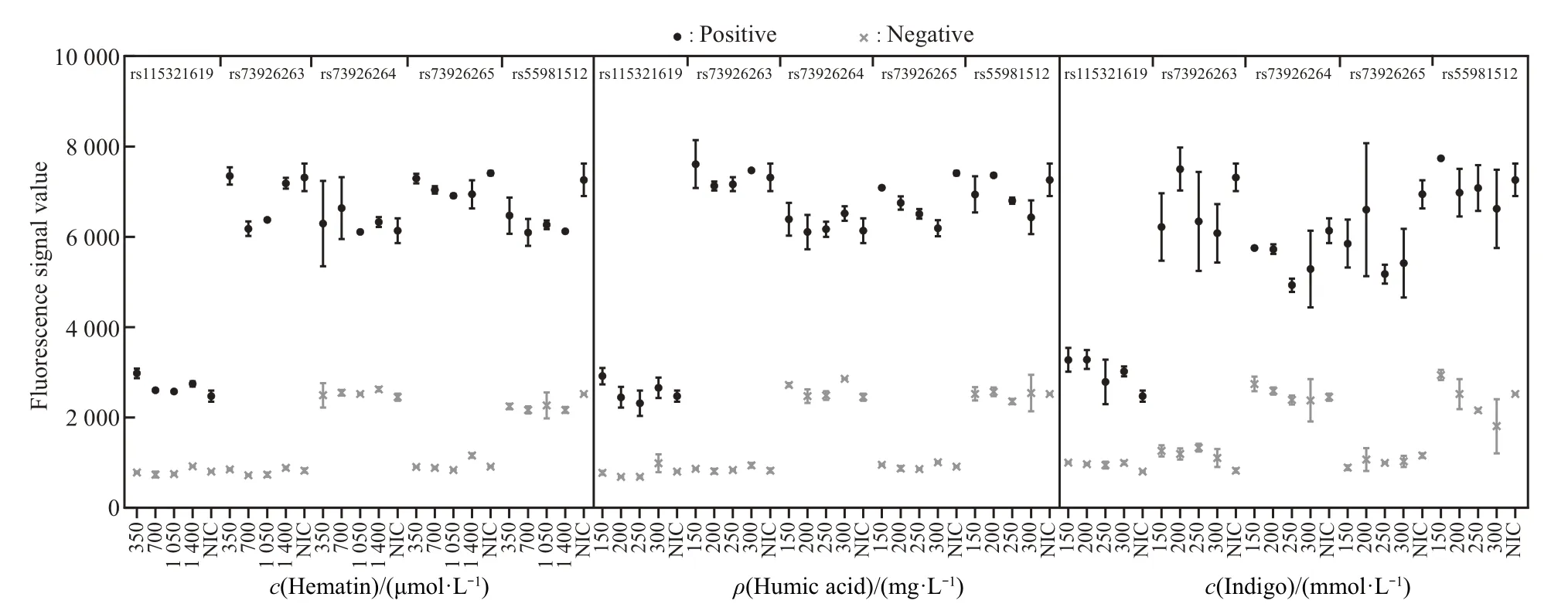
Fig.5 Mean fluorescence signal of the positive and negative droplets in VIC channel for reference DNA 9948 spiked with serial dilutions of the inhibitors for ddPCR detectionNIC presents detecting reference DNA 9948 with no inhibitors control.

Fig.6 The number of positive droplets in VIC channel and total droplets for reference DNA 9948 spiked with serial dilutions of the inhibitors for ddPCR detectionNIC presents detecting reference DNA 9948 with no inhibitors control;asterisks in each chart denote significantly different measurements compared to no inhibition control(*P<0.05,**P<0.01).
2.2.6 样本测试
表6 数据统计显示:5‑SNP 单倍型AGGAA 在42 份高海拔地区样本中频率为75%,在28 份低海拔地区频率仅为1.8%;单倍型GAAGG 在高海拔地区频率为25%,在低海拔地区频率为98.2%。所以,EPAS1 基因上的5‑SNP 高原适应单倍型AGGAA高频分布于高海拔区域,而在低海拔地区分布频率较低。

Table 6 Haplotype frequencies of 5-SNP in test samples
3 讨 论
SNP 遗传标记在法医学领域常用于个体识别、表型特征刻画等。迄今,可供选择的SNP 检测方法众多,法医实验室主要检测方法有基于CE 的SNaPshot、飞行时间质谱(MALDI‑TOF MS)和二代测序。这些方法虽然具有较高的灵敏度和检测通量,但仍存在一定的局限性,例如实验周期长且工作量较大,对陈旧、含抑制剂类(环境污染)样本的检测效果不佳。同时,检测的设备和试剂昂贵,并需要专业人员分析,仅适宜实验室检测,难以满足基层现场快速检测需求。近年来,ddPCR作为一种新兴检测技术,具备快速、单分子检测和强抗干扰能力,在痕量和混杂背景样本检测中展现了极大的优势,被广泛应用于环境、植物和病毒等领域[21‑23],但目前其在法医学研究少[24‑25]。因此,本研究在国产ddPCR 平台构建了5‑SNP 分型检测体系,并对其性能测试结果进行初步探讨。
本研究中,ddPCR 在SNP 分型检测的优势主要体现在:a.实验操作简便,检测速度快。仅需3个步骤,微滴生成(5 min)、PCR扩增(<2 h)和荧光信号检测(25 min),在2.5 h内即可获取检测结果。相比如CE、质谱和二代测序平台,检测效率明显提高。b. 体系构建便捷,结果易判读。ddPCR 主要依据微滴荧光信号强度、数目及荧光类型进行SNP 判型,无需涉及繁琐的体系优化调试;同时在构建体系时设计了较短的PCR 产物(<150 bp),可提高体系对降解检材的检测能力。c. 抗抑制能力突出。在较高浓度抑制剂检测时,ddPCR 可弱化抑制剂对PCR 扩增效率的影响,保证检测结果的准确性和稳定性。本研究实验结果表明,5‑SNP 分型检测体系重复性好、结果准确可靠,最低检测限0.312 5 ng基因组DNA,符合法医现场检测要求[19]。
当前,含抑制剂类样本检测仍旧是法医实践应用中的一大难点。尽管通过纯化可以去除部分抑制剂,但其易损耗样本DNA(回收率10%~80%)并增加污染的风险,因此不适用微量样本分析[26]。目前,法医实验室主流的SNaPshot 和质谱检测对样本纯度要求较高,其中在SNaPshot 检测中,随着抑制剂含量增加,位点检测峰值降低,并伴有异常或杂峰出现,易干扰位点判型[27‑28]。质谱检测对样本质和量要求更高(>10 ng),因而极少应用于现场样本检测[19]。二代测序在法医实际工作中,对DNA的质和量要求较高[29],抗抑制剂能力也在一定程度上限制其发展,商用法医试剂盒(Illumina Beta®Version ForenSeqTMDNA Signature Prep Kit)在MiSeq FGx 法医专用测序仪检测时,200 mg/L 腐植酸或800 μmol/L 血红素会导致体系扩增完全抑制[30]。同时,在法医学常规检测应用中,也需考虑该平台与检材类型(如血液和土壤类样本)的适用性[31]。
ddPCR“微滴式”技术不易受抑制剂干扰[32‑34]。本研究测试了法医学检材中3类常见的抑制剂:血红素、腐植酸和靛蓝,结果显示ddPCR相比SNaPshot 检测对抑制物展现更高的耐受性。但值得注意的是,实验中使用的血红素、腐植酸和靛蓝均较难溶于水,随着抑制物含量增多,难溶性颗粒物可能会堵塞微滴生成芯片上的微流控通道造成微滴生成失败或微滴破裂[35]。因此虽然ddPCR抗抑制能力强,仍建议样本处理时按照常规DNA提取纯化步骤进行操作,以降低颗粒物浓度。
此外,在ddPCR检测中设立空白对照很重要,ddPCR 依据微滴终点荧光信号强度差异,进行阴阳性微滴判定,所以空白对照是阴阳性阈值线设定的重要依据,并可监测体系有无污染情况[36]。尽管不同类型检材个别位点检测信号可能存在差异,尤其是在分析DNA 纯度较差样本时检测信号有降低趋势,但这种信号差异并不会影响微滴阴阳性状态判断,仍可正确获取分型。因此,ddPCR 技术这一优势为法医学陈旧、降解或含抑制剂类(环境污染)等疑难检材的检测提供潜在的应用价值。但是目前(表7),ddPCR 相比法医常用检测技术,仍存在一定的局限性,即检测通量低,在较多位点检测时,灵敏度也将有所降低。因此,在实际应用中位点检测数量是该方法需结合考虑的要点。
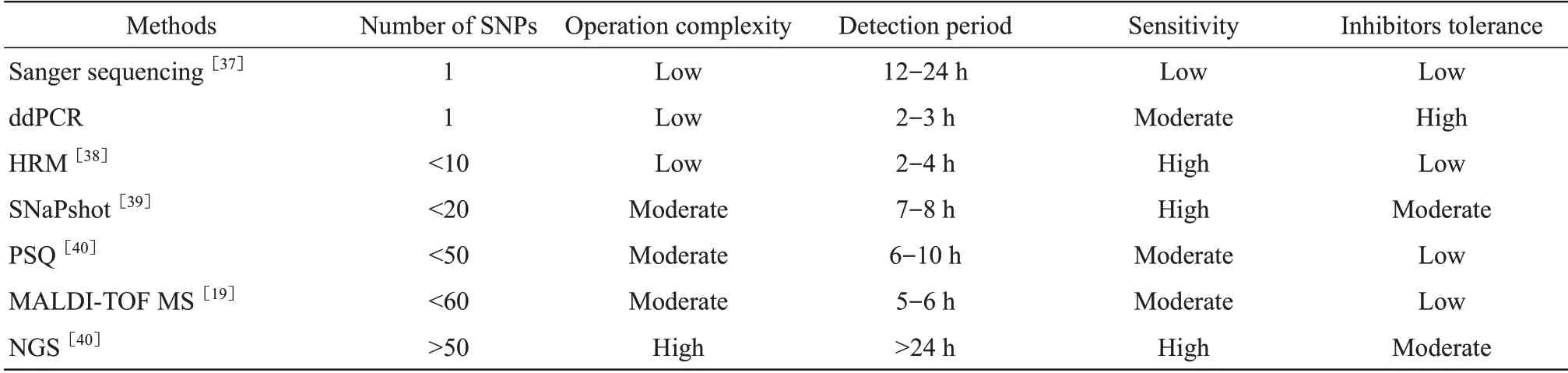
Table 7 Characteristics of commonly forensic used methods for SNP genotyping
4 结 论
基于ddPCR 的SNP 检测体系具有准确可靠、简便快速、抗抑制能力强等优势,适合法医现场生物检材检测。此外,本研究使用的检测仪器、耗材和试剂均为国产,检测成本低、数据安全性高,易于在法医实验室普及。下一步我们将继续探索构建多色荧光通道ddPCR 检测体系,提高SNP 位点单管检测数量,并探索其在RNA、DNA 甲基化等遗传标记检测方面的潜力。
附件 PIBB_20210336_Doc_S1.pdf 见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net)。

