辣椒花药培养影响因素研究及再生植株倍性鉴定
程志芳,史艳艳,李 丽,韩娅楠,董晓宇,常晓轲,姚秋菊
(河南省农业科学院 蔬菜研究所,河南 郑州 450002)
辣椒(Capsicum annuumL.)为茄科辣椒属植物,多是1年生草本,常异花授粉,采用传统育种方式培育一个自交系需要5~6 代,选育效率较低。随着花药培养技术在辣椒遗传育种中的应用,仅需1~2 代即可获得纯合体,缩短了育种年限,提高了育种效率;花药培养再生植株还可以广泛应用于遗传图谱构建[1]、基因定位[2]、转基因育种以及染色体工程[3]等。自1973年王玉英等[4]首次成功获得了辣椒花药培养再生植株后,许多学者进行了相关研究,发现很多因素影响花药培养效率,如培养基种类[5]、预处理时间[6]、碳源[7]、外源添加物[8]和植物生长调节剂[9]等。其中,在碳源研究方面,王仲慧等[9]研究认为,3%蔗糖最适合辣椒花药培养;RAMON 等[10]和杨芷秋[7]研究表明,麦芽糖作碳源的花药培养效率显著高于蔗糖、果糖和葡萄糖;赵激等[5]研究表明,麦芽糖作碳源,胚状体诱导率虽略高于蔗糖,但差异不显著;而静一等[11]研究表明,辣椒花药培养中碳源为不重要因素。在水稻花药培养中,朱永生等[12]研究表明,蔗糖和麦芽糖合并作碳源对提高出愈率和绿苗分化率效果显著,且使用混合碳源比使用单一碳源效果好。而在辣椒花药培养研究中,鲜少采用混合碳源。在外源添加物方面,许多学者研究了活性炭和AgNO3对辣椒花药培养的影响,如黄亚杰等[13]研究表明,5 g/L 活性炭最适合辣椒花药培养,不加活性炭仅形成愈伤组织;陈晓等[14]研究表明,低浓度活性炭之间辣椒花药培养胚诱导率差别不显著,2.5 g/L 活性炭即可;而RAMON 等[10]研究表明,活性炭虽提高辣椒花药培养胚状体诱导率,但会导致不正常胚发生;蔡连华等[15]研究表明,1 mg/L AgNO3显著促进彩色甜椒花药胚状体诱导,最高出胚率为22.4%,但获得的胚状体中大多是畸形胚;而王仲慧等[9]研究表明,50 μmol/L(≈8.49 mg/L)AgNO3可提高胚状体诱导率。植物生长调节剂的应用始终是学者们的研究热点,前人[9,16-17]研究多是利用NAA 与KT 组合,且认为0.5 mg/L NAA+1.0 mg/L KT 组合最适合辣椒花药培养,其中出胚率最高为31.76%[9];另有研究[13-14,18]表明,低浓度2,4-D 与KT 组合也可直接诱导辣椒花药产生胚状体,其中出胚率最高为9.76%[14]。辣椒花药培养再生植株倍性复杂,可能有单倍体、二倍体、多倍体、混倍体和非整倍体等不同倍性水平[19]。不同倍性植株用途不同,因此再生株系的倍性鉴定是其充分利用的前提。目前常用的倍性鉴定方法有形态学鉴定[20]、细胞学鉴定[21-23]及近些年广泛应用的DNA流式细胞仪鉴定法[24-25]。在辣椒花药培养再生植株倍性鉴定方面,付文婷等[26]比较了染色体计数法、DNA 流式细胞仪检测法、形态鉴定法的可靠性,发现DNA 流式细胞仪检测法和染色体计数法吻合度达93%。
尽管在辣椒花药培养方面取得许多进展,但研究混合碳源对辣椒花药培养的影响报道较少,且前人研究中活性炭和AgNO3的最适浓度分别相差较大,植物生长调节剂的种类及其浓度配比不佳进而造成出胚率和成苗率较低,这些问题都限制了辣椒花药培养的应用规模。因此,采用14 个辣椒基因型,比较不同质量浓度蔗糖和麦芽糖碳源组合、活性炭、AgNO3和植物生长调节剂组合4 个因素对辣椒花药培养的影响,并采用流式细胞仪检测法对再生植株进行倍性鉴定,旨在为提高辣椒花药培养效率及再生植株充分利用提供参考依据。
1 材料和方法
1.1 试验材料
2021 年4 月下旬,将供体植株定植在河南省农业科学院河南现代农业研究开发基地露地试验区,5月中下旬至6月中旬采样。参试材料共14个辣椒基因型,其名称及来源见表1。

表1 参试辣椒基因型及其来源Tab.1 Test pepper genotypes and origins
1.2 试验方法
1.2.1 花药培养 摘取辣椒萼瓣等长或花瓣微露出花萼的花蕾(多数小孢子处于单核靠边期),于4 ℃低温预处理1~7 d。接种前剥去顶端25%~50%的花萼,露出青绿色花瓣。然后在超净工作台上用70% 乙 醇 浸 泡 消 毒30 s,再 用0.1% HgCl2消 毒10 min,无菌水冲洗3~4 次,每次3~5 min,最后将花蕾倒入铺有无菌滤纸的培养皿中,盖上盖子防止失水或褐化。接种时用解剖刀在花蕾1/2 处横切,然后捏住花冠部分,将花药敲入培养皿中,用保鲜膜封口。接种后于32 ℃恒温暗培养7 d,之后26 ℃下暗培养直至胚状体长出,将其转入无任何添加物的MS 基本培养基中,培养温度为26 ℃,光周期为12 h/d,直至分化成苗。采用完全随机设计,探究碳源组合、活性炭、AgNO3和植物生长调节剂组合4 个因素对辣椒花药培养的影响。每处理2~3 皿,每皿接种30 个花药,重复3 次。所有试验均采用MS 基本培养基,含8 g/L琼脂,pH值为5.8。
1.2.1.1 碳源组合 基本培养基中分别加入不同质量浓度的麦芽糖和蔗糖(表2),此外,均加入1.000 mg/L 2,4-D、1.50 mg/L KT、4 mg/L AgNO3和2 g/L 活性炭。参试5 个基因型分别为19HG11、19HG16、19HG22、20G159和20G52。

表2 碳源组合处理Tab.2 The carbon source combination treatment g/L
1.2.1.2 活性炭 基本培养基中分别加入1、2、3 g/L活性炭,以不加活性炭为对照,此外,均加入20 g/L麦芽糖、10 g/L蔗糖、1.000 mg/L 2,4-D、1.50 mg/L KT和4 mg/L AgNO3。参试5 个基因型分别为20G52、19HG11、19HG16、19HG09和17-86。
1.2.1.3 AgNO3基本培养基中分别加入2、4、6、8 mg/L AgNO3,以不加AgNO3为对照,此外,均加入20 g/L 麦 芽 糖、10 g/L 蔗 糖、1.000 mg/L 2,4-D、1.50 mg/L KT 和2 g/L 活性炭。参试4 个基因型分别为艳椒808、艳椒485、线椒一号和艳椒465。
1.2.4 植物生长调节剂组合 基本培养基中分别加入不同种类及其质量浓度的植物生长调节剂(表3),此外均加入20 g/L 麦芽糖、10 g/L 蔗糖、2 g/L活性炭和4 mg/L AgNO3。参试5 个基因型分别为星悦、艳椒808、华之秀1号、艳椒425和线椒一号。

表3 植物生长调节剂组合处理Tab.3 Plant growth regulator combination treatment mg/L
1.2.2 倍性鉴定 待再生苗在瓶中长至6~7片叶时打开瓶盖,驯化炼苗3 d,然后用自来水将根部培养基冲洗干净,定植到装有基质的营养钵中,覆盖保湿7 d,期间弱光管理。当苗子定植长出新叶后,取新鲜幼嫩叶片采用流式细胞仪进行倍性鉴定。采用Sysmex 公司的CYStain UV Precise P 试剂盒进行裂解和染色,用PARTEC 公司的CyFlow® Cube8 流式细胞仪进行倍性鉴定。每株系取1~2片约0.5 cm2的新鲜幼嫩叶片,加入300 μL 细胞裂解液,用手术刀片切碎,然后加入1 200 μL染色液,50 μm筛子过滤,收集滤液,避光染色5~10 min 后利用流式细胞仪检测该样品DNA 含量,读取峰值。用二倍体杂交种华之秀二号作对照调试电压,使对照的DNA 峰值在相对荧光强度200 道。每个样本测定1次,根据峰值曲线判断待测样品倍性。DNA 峰值处于相对荧光强度100道、200道、300道和400道分别为单倍体、二倍体、三倍体和四倍体,其余为非整倍体。
1.3 数据统计分析
接种20 d 后每7 d 观察一次胚状体的萌发情况,直至接种80 d 后统计其出胚率与成苗率。出胚率=(出胚数/接种花药数)×100%;成苗率=(成苗数/接种花药数)×100%。方差分析中,采用DPS(9.01)软件进行完全随机设计单因素试验统计分析。
2 结果与分析
2.1 不同质量浓度碳源组合对辣椒花药培养效率的影响
从表4 可以看出,参试5 个辣椒基因型在不同质量浓度碳源组合培养基上花药培养效率均产生差异。其中,M4 可诱导所有参试基因型出胚及成苗,4 个基因型19HG11、19HG16、19HG22、20G159均在M4 上出胚率和成苗率最高,且19HG16、19HG22、20G159三个基因型在M4的出胚率和成苗率均显著高于其他碳源组合。只有基因型20G52在M2 上出胚率和成苗率略高于M4,分别为5.53%和3.33%,但M2 与M4 成苗率差异不显著,且2 个基因型19HG16 和19HG22 在M2 上成苗率为0,因此M2 广适效果较差。综上所述,在辣椒花药培养中,不同基因型所需蔗糖和麦芽糖比例略有不同,但M4(20 g/L麦芽糖与10 g/L蔗糖合并作碳源)适合较广泛的辣椒基因型花药培养,参试基因型最高出胚率为9.43%,最高成苗率为3.85%。
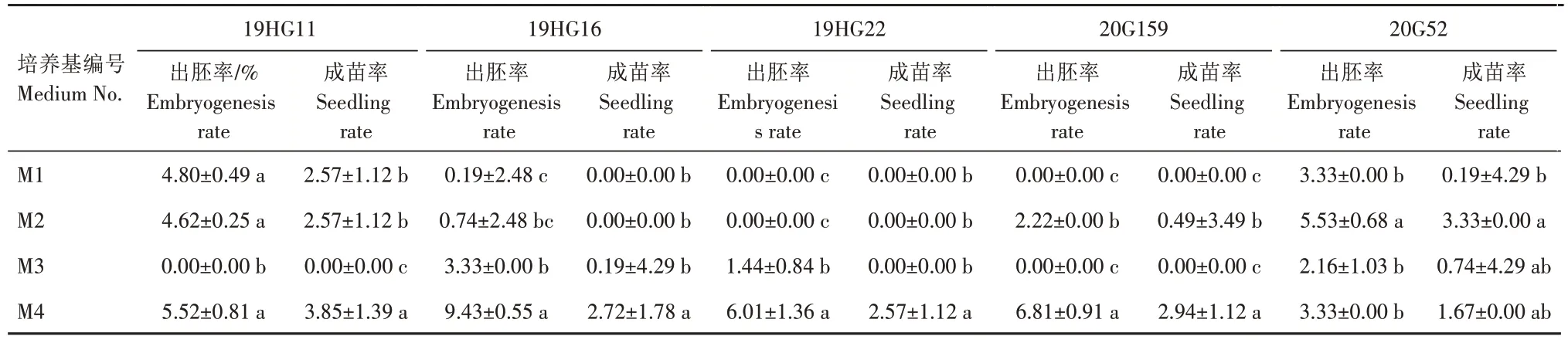
表4 不同质量浓度碳源组合对辣椒花药培养效率的影响Tab.4 Effects of different mass concentrations of carbon sources combination on anther culture of pepper %
2.2 不同质量浓度活性炭对辣椒花药培养效率的影响
从表5 可以看出,添加不同质量浓度活性炭对参试5个辣椒基因型的花药培养效率均有不同的影响,并呈现出随着活性炭质量浓度升高其出胚率和成苗率先升高后降低的规律,且均在2 g/L活性炭时出胚率和成苗率达到最高,其中19HG11、19HG16和19HG09(成苗率例外)3 个基因型均在2 g/L 活性炭时出胚率和成苗率显著高于其他质量浓度。因此,2 g/L 活性炭最适宜辣椒花药培养,参试基因型最高出胚率和成苗率分别为9.43%和3.85%。另外,参试基因型在无活性炭培养基上均未出胚,仅有愈伤组织形成,说明活性炭显著促进了辣椒胚状体的形成。

表5 不同质量浓度活性炭对辣椒花药培养效率的影响Tab.5 Effects of different mass concentrations of activated carbon on anther culture of pepper %
2.3 不同质量浓度AgNO3对辣椒花药培养效率的影响
从表6 可以看出,添加不同质量浓度AgNO3,参试4 个辣椒基因型花药培养效率均产生差异,并呈如下规律:在出胚率方面,艳椒808、艳椒485 和艳椒465 三个基因型均在6 mg/L AgNO3时达最高,分别为13.88%、29.63%、20.55%,线椒一号在4 mg/L AgNO3时出胚率达最高(11.67%)且显著高于其他质量浓度;在成苗率方面,参试基因型均在6 mg/L AgNO3时最高,4 mg/L AgNO3时次之,且同一基因型两者差异不显著,其中,艳椒485 在6 mg/L AgNO3时成苗率高达15.20%。综上所述,在培养基中添加一定浓度的AgNO3有助于辣椒胚状体的形成,6 mg/L AgNO3较广泛地适宜辣椒花药培养。

表6 不同质量浓度AgNO3对辣椒花药培养效率的影响Tab.6 Effects of different mass concentrations of silver nitrate on anther culture of pepper %
2.4 不同质量浓度植物生长调节剂组合对辣椒花药培养效率的影响
从表7 可以看出,不同质量浓度植物生长调节剂对参试5个辣椒基因型的花药培养效率均有不同影响。星悦在5种植物生长调节剂质量浓度下的出胚率和成苗率均以M5 最高,分别为6.09% 和1.67%,且显著高于其他植物生长调节剂浓度组合,因此,M5最适合星悦基因型花药培养。艳椒808在5 种植物生长调节剂浓度下出胚率差异均显著,以M6最高,达16.67%,M5次之,为11.67%。成苗率方面以M5 和M6 最高,均为4.41%,M7、M8 和M9 依次降低,分别为3.33%、2.16%和0.74%。因此,M5 和M6最适合艳椒808基因型花药培养。华之秀1号的出胚率和成苗率均以M5 最高,分别为63.33%和23.88%,且M5 出胚率显著高于其他植物生长调节剂质量浓度组合,因此,M5 最适合华之秀1 号基因型花药培养。艳椒425 在5 种植物生长调节剂浓度下出胚率以M9 最高,达3.33%,且显著高于其他植物生长调节剂质量浓度组合;成苗率以M7 和M9 最高,达1.67%,显著高于其他植物生长调节剂质量浓度组合。因此,M7 和M9 最适合艳椒425 基因型花药培养。线椒一号在5种植物生长调节剂质量浓度下的出胚率和成苗率均以M9 最高,且显著高于其他植物生长调节剂质量浓度组合,分别为20.00%和10.54%。因此,M9 最适合线椒一号基因型花药培养。
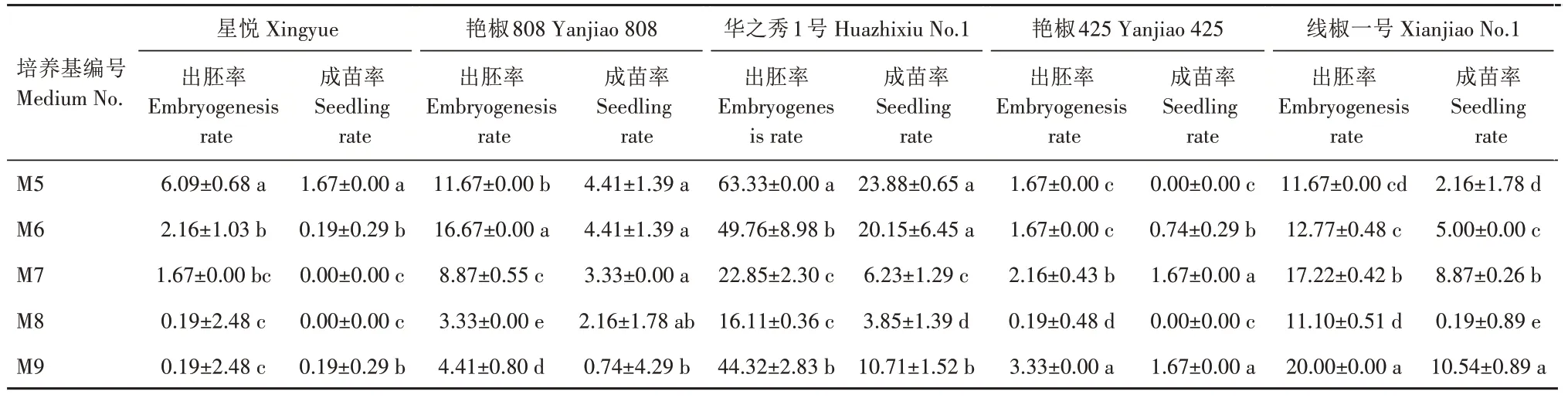
表7 不同质量浓度植物生长调节剂组合对辣椒花药培养效率的影响Tab.7 Effects of different mass concentrations of plant growth regulator combination on anther culture of pepper %
综上分析可见,辣椒花药培养中不同基因型最适植物生长调节剂配比不同,参试的5 个辣椒基因型3 个在M5(1.000 mg/L 2,4-D+1.50 mg/L KT)上花药培养效率最高,最高出胚率和成苗率分别为63.33%和23.88%;2 个在M9(0.001 mg/L 2,4-D+0.05 mg/L KT)上花药培养效率最高,最高出胚率和成苗率分别为20.00%和10.54%。
2.5 再生植株倍性鉴定
参试14 个基因型,共诱导出胚1 095 个,成苗383 株,经流式细胞仪鉴定后,单倍体(图1B)279株、二倍体(图1C)87株、三倍体(图1D)2株、四倍体(图1E)2株、混倍体(单倍体与二倍体,图1F)1株和非整倍体12 株,在再生植株群体中占比分别为72.85%、22.72%、0.52%、0.52%、0.26%和3.13%。

图1 流式细胞仪测定辣椒花药培养再生植株DNA含量分布结果Fig.1 Distribution of DNA content in pepper anther regenerated plants determined by flow cytometry
3 结论与讨论
近年来有研究表明,在花药培养中麦芽糖比蔗糖更益于胚状体发生[27-28]。本研究比较了不同质量浓度麦芽糖和蔗糖碳源组合对辣椒花药培养的影响,参试5个基因型在20 g/L麦芽糖和10 g/L蔗糖合并作碳源情况下花药培养效率较高,最高出胚率和成苗率分别为9.43%和3.85%。且合并碳源的花药培养效率普遍高于单独蔗糖作碳源的效率,适合较广泛的辣椒基因型花药培养,这与张芳等[29]的研究结论相同,而赵激等[5]研究表明,在辣椒花药培养中麦芽糖优于蔗糖,且最高出胚率仅为1.28%,而未研究2种糖类合并作为碳源时的表现。混合碳源比单一碳源效果好的原因可能是因为混合碳源在胚诱导过程中满足了不同发育阶段糖类代谢的不同需求。本研究中未涉及单独麦芽糖碳源时辣椒花药培养的表现,有待进一步探索。
植物花药培养过程中会产生有毒物质,进而降低胚发生率或产生畸形胚。活性炭可吸附培养基中的有害物质和培养过程中释放的酚醌类物质及蔗糖在高压灭菌时产生的5-羟甲基糠醛等,同时也吸附生长调节物质、Fe-EDTA、维生素B6、叶酸和烟酸等其他营养物质,因此,在植物组织培养中活性炭经常用于防褐变和胚诱导等[30]。本研究表明,辣椒花药培养中不加活性炭无胚状体形成,仅形成愈伤组织,2 g/L 活性炭最适辣椒花药培养,参试基因型最高出胚率为9.43%,最高成苗率为3.85%。这与张红肖等[31]和刘独臣[32]的研究结论相同。而王仲慧等[9]和李怡斐等[33]认为,4 g/L 活性炭最适辣椒花药培养,且王仲慧等[9]研究中最高出胚率和成苗率分别为31.76%和20.27%;刘娜[34]研究表明,6 g/L 活性炭出胚率最高,但最高出胚率仅为2.5%。造成这些差异可能有以下原因:参试基因型不同会造成出胚率差异较大,各自研究中采用的基本培养基和试剂级别不同。刘仁祥等[35]研究表明,活性炭对花药培养的促进作用受培养基中大量元素、微量元素平衡程度影响,其试剂级别不同对花药培养出胚率影响亦不同。因此,采用的基本培养基不同和试剂级别不同也会导致活性炭最适浓度亦不同。
有研究表明,AgNO3能明显降低花药褐化,保持花药新鲜,促进胚状体形成与发育[36]。本研究表明,当加入6 mg/L AgNO3时辣椒花药培养效率最高,参试基因型出胚率和成苗率最高分别为29.63%和15.20%。这与刘娜[34]研究结论相同;而李怡斐等[33]认为加入4 mg/L AgNO3最好,出胚率最高为22.70%;王仲慧等[9]认为加入50 μmol/L(≈8.49 mg/L)AgNO3可提高胚状体诱导率,最高出胚率和成苗率分别为10.00%和3.33%。造成这些差异的原因可能与其研究中参试基因型不同和AgNO3梯度设置过大有关。
植物生长调节剂是影响花药培养效率的重要因素,不同种类及其浓度植物生长调节剂对辣椒花药培养产生影响不同,适当的配比有助于胚状体的形成。本研究表明,不同基因型最适植物生长调节剂配比不同。参试5个基因型中有3个在M5(1.000 mg/L 2,4-D+1.50 mg/L KT)上花药培养效率最高,出胚率最高为63.33%,成苗率最高为23.88%;2 个在M9(0.001 mg/L 2,4-D + 0.05 mg/L KT)上花药培养效率最高,出胚率最高为20.00%,成苗率最高为10.54%。即在辣椒花药培养中,无论高浓度2,4-D与高浓度KT 组合或低浓度2,4-D 与低浓度KT 组合均可高效诱导花药出胚,只是2 种植物生长调节剂配比不同和适用基因型不同。这与前人研究结果类似,如黄亚杰等[13]研究表明,MS 培养基加入0.005 mg/L 2,4-D 和0.05 mg/L KT 出 胚 率 最 高 达3.3%;陈晓等[14]研究表明,0.1 mg/L 2,4-D 和0.1 mg/L KT 组合诱导辣椒花药出胚率最高为9.76%;而刘独臣[32]研究表明,0.25 mg/L 2,4-D 和0.5 mg/L KT 组合出胚率最高达20%,且高浓度2,4-D 和KT 组合不仅可促进出胚率较高的基因型较快出胚,同时刺激低浓度2,4-D 和KT 组合时不出胚的基因型出胚,但胚不易成苗。而本研究中畸形胚率并未呈现出与2,4-D 和KT 浓度相关的规律。另外,前人研究中 许 多 学 者[9,16-17]采 用0.5 mg/L NAA 和1.0 mg/L KT组合,出胚率最高达31.76%[9],而本研究中同时采用了3 种植物生长调节剂(M6:0.200 mg/L 2,4-D、0.2 mg/L NAA 和1.00 mg/L KT),2 个基因型(艳椒808 和华之秀1 号)花药培养效率较高,其中,华之秀1号出胚率和成苗率分别高达49.76%和20.15%,这说明2,4-D 和NAA 共同与KT 组合较单独NAA与KT 组合也许更有利于辣椒花药胚诱导,这有待利用相同基因型进一步探索比较。
本研究利用DNA 流式细胞仪鉴定了383 个再生株系的植株倍性,其中单倍体279株、二倍体87株,在再生植株群体中占比分别为72.85%、22.72%。这与前人研究中的占比非常相似,如付文婷等[26]的研究中,单倍体和二倍体株系在再生株系中占比分别为66.70%和20.00%;而陈斌等[19]研究认为,单倍体和二倍体株系分别占70.91%和25.45%。这说明在辣椒花药培养再生植株群体中,通常单倍体占比约70%,二倍体占比20%~25%。本研究还发现,同一花药诱导出的再生植株倍性通常一致。
综上所述,本研究表明,在辣椒花药培养中,不同基因型所需蔗糖和麦芽糖比例略有不同,20 g/L麦芽糖和10 g/L蔗糖合并作碳源适合较广泛的辣椒基因型花药培养;活性炭显著促进了辣椒胚状体的形成,2 g/L 活性炭最适宜辣椒花药培养;AgNO3有助于辣椒胚状体的形成,加入6 mg/L AgNO3时辣椒花药培养效率最高;辣椒花药培养中不同基因型最适植物生长调节剂配比不同,其中1.000 mg/L 2,4-D+1.50 mg/L KT(M5)和0.001 mg/L 2,4-D+0.05 mg/L KT(M9)2 个植物生长调节剂组合适宜较多的辣椒基因型花药培养,只是适用基因型不同。利用DNA 流式细胞仪鉴定了383 个再生株系的植株倍性,发现279 株单倍体、87 株二倍体、2 株三倍体、2株四倍体、1 株混倍体(单倍体与二倍体)和12株非整倍体,其中单倍体和二倍体在再生植株群体中占比分别为72.85%、22.72%。

