基于SNP 标记的4 个品种复烤烟叶鉴别研究
杨金初,童治军,李 萌,赵 旭,徐永明,冯颖杰,杨宗灿,曲 鹏,李 悦,孙九喆,张 轲
(1.河南中烟工业有限责任公司技术中心,河南 郑州 450000;2.云南省烟草农业科学研究院/烟草行业烟草生物技术育种重点实验室/国家烟草基因工程研究中心,云南 昆明 650021;3.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001;4.云南省烟草质量监督检测站,云南 昆明 650106)
烟草品种直接影响卷烟产品的感官质量稳定性,准确、高效地鉴定烟草品种是烟草行业一直关注的问题。尽管我国审定通过的烤烟品种较多,但主栽品种单一化现象比较严重。2014 年,我国栽培面积占比超过5%的品种仅有4个,云烟87、K326和红花大金元3 个品种的栽培面积占总栽培面积的64%[1]。田间可通过株型、叶片形状等形态学指标区分主栽烟草品种,但烟叶经复烤后成为形态、大小均一片烟,无法根据形态鉴别其品种。目前,卷烟企业主要依赖感官评吸区分复烤烟叶品种,其准确性和稳定性均不理想,亟待开发高效、准确、标准化的品种鉴别技术。
DNA 分子标记直接反映作物品种间的遗传差异,且不受样品状态的影响,是理想的烟草品种鉴别方法。目前,烟草领域已报道的分子标记包括随机扩增多态性DNA(RAPD)[2]、扩增片段长度多态性(AFLP)[3]、简单重复序列(SSR)[4]、简单重复序列区间(ISSR)[5]、序列相关扩增多态性(SRAP)[6]、MITE位点间多态性(IMP)[7]及单核苷酸多态性(SNP)[8-13]等。与其他分子标记相比,第3 代分子标记SNP 具有分布广、密度高、稳定性强、多态性好及分型简单等诸多优点。近年来,随着测序成本大幅减低,基于全基因组的SNP 标记开发及应用已成为分子标记研究领域的焦点[14]。张剑锋等[8]利用高密度SNP芯片对不同烟草品种进行了遗传多样性分析,可将24 个品种划分为不同类群;余世洲等[13]基于全基因组重测序SNP位点数据开发了48个核心SNP标记,可用于区分主栽烟草品种的基因型。然而,以上研究中材料多为新鲜烟叶,仅个别研究应用SSR[6,15]、SRAP[6]等第2代分子标记对少量品种的烤后烟叶进行了区分,尚未见应用SNP 标记鉴别烤后烟叶品种的研究报道。为探究SNP 标记在复烤烟叶品种鉴别上的可行性,以卷烟企业常用的4 个主栽烟草品种云烟87、K326、红花大金元及NC102 的复烤烟叶为研究对象,通过全基因组测序质控过滤筛选SNP位点,在此基础上设计等位基因特异性引物,利用等位基因特异性PCR 筛选品种多态性位点,应用多态性SNP 位点构建不同烟草品种复烤烟叶的SNP指纹图谱和分子ID,以期实现复烤烟叶品种的准确鉴别。
1 材料和方法
1.1 供试材料
1.1.1 复烤烟叶 云烟87、K326、红花大金元及NC102 四个品种的复烤烟叶由河南中烟工业有限责任公司提供,均为中部叶,产地均为云南。
1.1.2 仪器 JXSF TPRP-2 组织研磨仪(上海净信实业发展有限公司);NanoDrop 2000 超微量紫外分光光度计(美国Thermo Scientific 公司);Vetiti 型梯度PCR 仪(美国ABI 公司);Mini Bis Pro 型凝胶成像分析系统(以色列DNR凝胶成像系统公司)。
1.2 试验方法
1.2.1 全基因组测序及SNP 位点挖掘 挑选代表性复烤烟叶,用液氮研磨成粉置于1.5 mL 离心管中,依照Rapid Plant Genomic DNA Isolation Kit 试剂盒[生工生物工程(上海)股份有限公司]操作步骤提取基因组DNA,得到的DNA用TE Buffer稀释,-20 ℃保存。通过1.5%琼脂糖凝胶电泳检测DNA 完整性,利用超微量紫外分光光度计测定DNA 浓度和纯度。基因组测序及SNP 位点挖掘均委托生工生物工程(上海)股份有限公司开展,具体流程如下:将基因组DNA 构建文库,利用Illumina HiseqTM高通量测序技术进行全基因组重测序,以Fastqc 和Trimmomatic 软件进行质控和数据处理。采用BWA(Burrows-Wheeler Aligner)程序将测序获得的高质量序列与从NCBI 数据库得到的普通烟参考基因组(https://www.ncbi.nlm.nih.gov/genome/? term=common+tobacco%5Borgn%5D)进行比对。将基因组质控后的高质量序列匹配到参考基因组,利用SAMTOOL 软件转换格式,采用GATK 软件过滤(设定条件:mindDP=5,mac=3,maf=0.5)获得SNP 位点,利用ANNOVAR软件对过滤得到的SNP进行注释。
1.2.2 等位基因特异性PCR 引物设计 基于过滤得到的高质量SNP 位点,截取突变位点前后上游或下游100 bp 左右无SNP 位点突变的序列,利用引物设计软件设计引物,每个位点设计3 条引物,即1 条通用引物Primer-R 和2 条特异性引物Primer-FA、Primer-FB。Primer-FA 和Primer-FB 的3′末端碱基分别与SNP 位点的碱基互补或者相同。挑选其中53 个SNP 位点设计、合成了不同错配类型的引物570 条,多态性位点35、45 和51 引物信息如表1所示。
SNP 引物设计原则:引物长度12~30 bp;引物GC 含量45%~60%;退火温度55~70oC;在特异引物3′端第2 位或第3 位人工引入强错配或中等错配碱基,其中强错配类型有A/G 和C/T 2 种,中等错配类型有A/A、T/T、G/G和C/C 4种;对于强错配或中等错配都筛选不出差异的位点,再考虑无错配和弱错配方式,弱错配方式有A/C 和G/T 2 种。2 条特异性引物FA与FB除3′端突变碱基与人工错配碱基不同之外,其他碱基均相同,以此分别设计不同错配类型的特异性引物。
1.2.3 等位基因特异性PCR 反应扩增体系 等位基因特异性PCR(Allele specific PCR,AS-PCR)反应体系10 μL:2×TaqMaster Mix Ⅱ5 μL,DNA 模板0.5 μL,10 μmol/L Primer-R 与Primer-FA 或FB 各0.25 μL,ddH2O 4 μL。PCR 扩增程序:95 ℃预变性3 min;95 ℃变性30 s,各退火温度退火30 s,72 ℃延伸30 s,共35 个循环;72 ℃延伸5 min,最后4 ℃保存。
1.2.4 SNP 位点验证与基因分型 利用1.5%琼脂糖凝胶电泳检测PCR 扩增产物,自动凝胶成像仪观察结果并且拍照。根据PCR 产物大小是否与预期一致验证SNP 位点,依据目标条带的有、无对4个品种进行基因分型。
1.2.5 品种鉴别 从SNP 位点中筛选出多态性位点,构建不同品种的指纹图谱库。将不同类型等位基因型转化为0/1 矩阵,通过构建不同烟草品种的分子ID进行品种鉴别。
2 结果与分析
2.1 4个品种复烤烟叶样品全基因组重测序
采用高通量Illumina HiSeqTM测序技术对4 个品种的复烤烟叶样品进行全基因组重测序,共获得24.3 Gb 的原始数据(Raw data)。经过质量控制和数据过滤,得到21.5 Gb 高质量的纯净数据(Clean data)作为分析基础,平均每个样品的数据量为5.4 Gb。每个样品的数据信息如表2所示,碱基错误率低于1%(Q20)的碱基平均占比97.67%,碱基错误率低于0.1%(Q30)的碱基平均占比90.21%,GC分布正常。4个样品平均获得高质量序列数47 670 156条,平均47 517 800条序列可以比对到烟草参考基因组上,平均比对率为99.68%,满足后续试验要求。
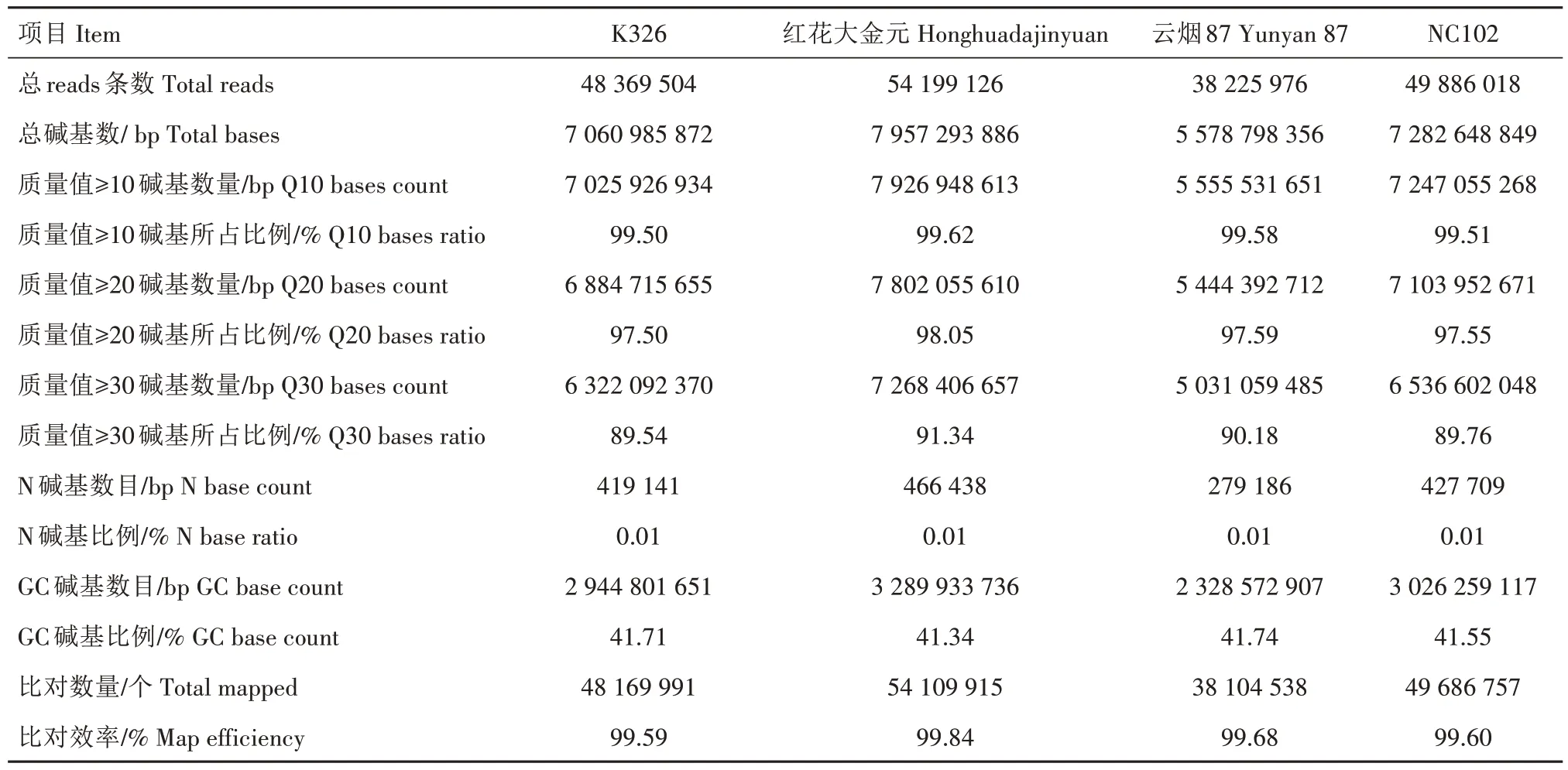
表2 4个品种复烤烟叶样品全基因组重测序数据质量统计Tab.2 Quality statistics of whole genome resequencing data of redried tobacco leaves from four varieties
2.2 SNP位点的分类、注释与比对
应用GATK 软件共得到27 137 个SNP 位点,其中20 757 个为转换,6 380 个为颠换,转换与颠换的比率为3.25。变异类型以C/T 和G/A 较多,分别占比38.24% 和38.25%,C/A 和G/T 变 异 分 别 占 比11.89%和11.62%。参照参考基因组基因功能对SNP 位点功能进行注释,发现SNP 在基因间区的比例最大(92.28%),其次为外显子区(3.17%)、内含子区(2.79%)和其他区域(1.77%)。
品种间SNP 位点相似度统计结果如图1 所示,4个品种相同的SNP 突变点为23 275 个,占比85.8%;K326、云烟87 和红花大金元相同的SNP 突变位点为641个,占比2.4%;K326、云烟87和NC102相同的SNP 突变位点为790 个,占比2.9%;云烟87、红花大金元和NC102 相同的SNP 突变位点为625个,占比2.3%;红花大金元、云烟87 和NC102 相同的SNP突变位点为1 806个,占比6.7%。

图1 4个品种复烤烟叶SNP位点韦恩图Fig.1 Venn diagram of SNP sites of redried tobacco leaves from four varieties
2.3 SNP位点验证和基因分型
从云烟87、K326、红花大金元及NC102 复烤烟叶提取的基因组DNA 质量浓度分别为2 633.0、727.2、1 365.9、617.9 ng/μL,OD260/OD280值 分 别 为1.81、1.81、1.81、1.90,质量达到等位基因PCR 扩增要求。红花大金元、云烟87、K326 及NC102 复烤烟叶在53 个SNP 位点上的基因分型分别如图2—5 所示。PCR 产物电泳条带均与引物设计预期一致,表明通过高通量测序和GATK软件挖掘出的SNP位点可靠性较好,筛选出的SNP 位点质量较高。经比对发现,53 个SNP 位点中杂合突变C/T 较多,仅在35、45、51位点出现纯合突变。
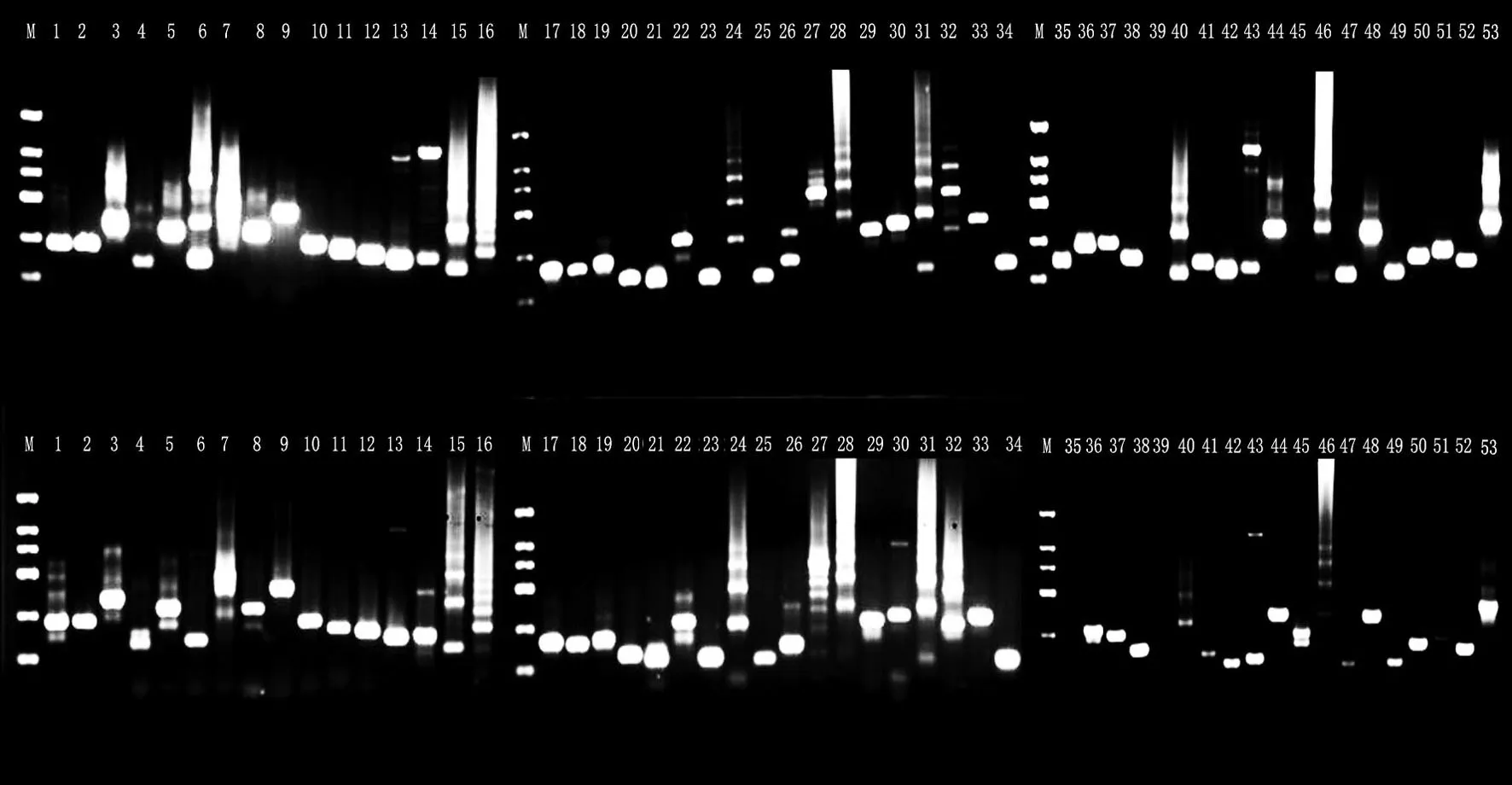
图2 红花大金元复烤烟叶53个SNP位点基因分型结果Fig.2 Geno typing of 53 SNP loci of Honghuadajinyuan redried tobacco leaves

图3 云烟87复烤烟叶53个SNP位点基因分型结果Fig.3 Geno typing of 53 SNP loci of Yunyan 87 redried tobacco leaves
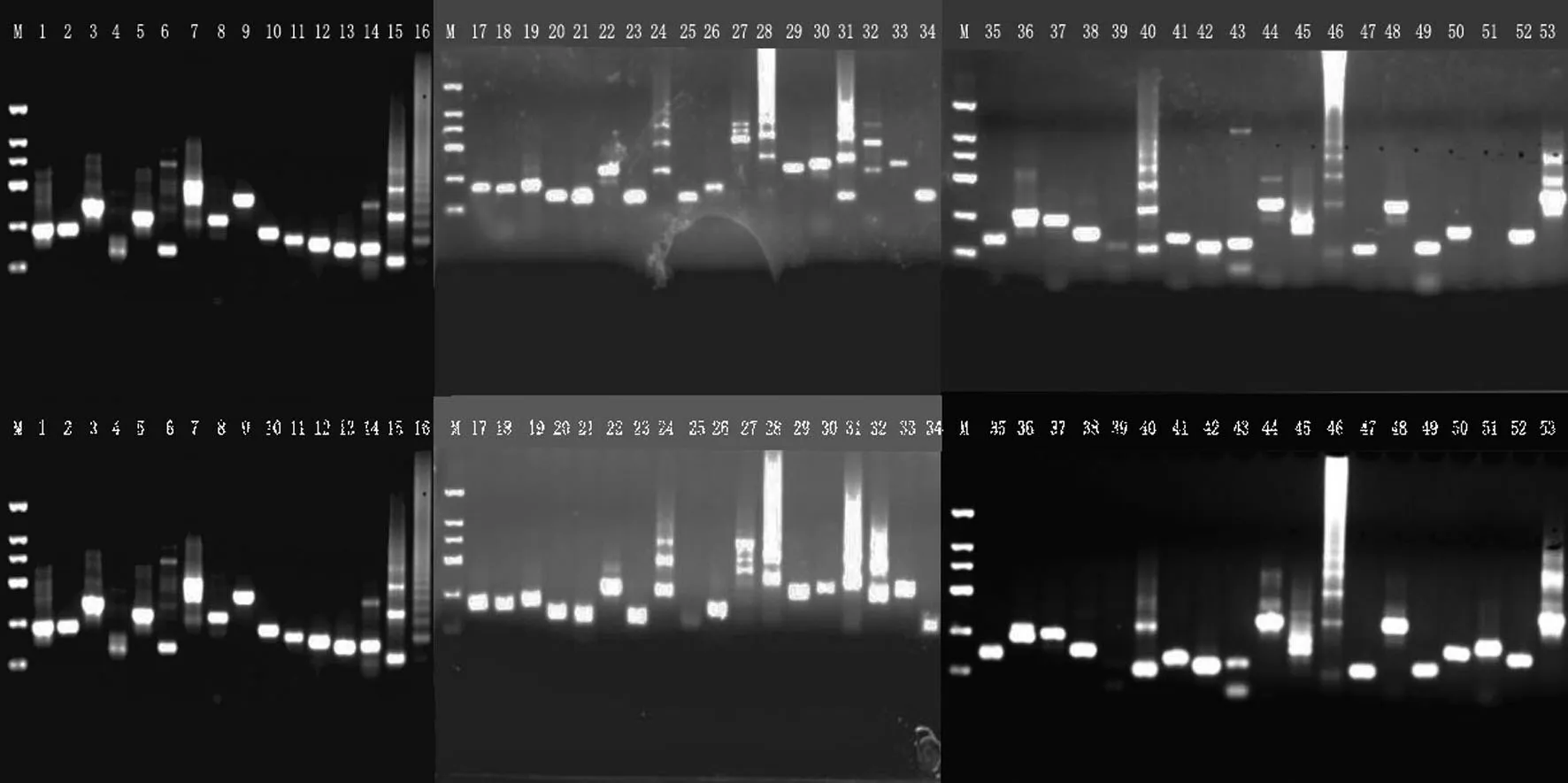
图4 K326复烤烟叶53个SNP位点基因分型结果Fig.4 Geno typing of 53 SNP loci of K326 redried tobacco leaves
2.4 SNP标记鉴别复烤烟叶品种
在53个SNP位点中,35、45、51位点在品种间具有多态性(图2—5),可通过基因分型区分4 个烟草品种。云烟87 在35 位点FA 与FB 引物均无条带,在45、51 位点的基因型为C/T、C/T;红花大金元在35、45、51 位点的基因型为T/T、C/C、T/T,K326 为C/T、C/T、C/C,NC102为C/T、C/T、C/T。将T记为0,C记为1,无条带记为-,可将不同类型等位基因型转化为0/1 矩阵,从而构建不同烟草品种的分子ID。在35、45、51 位点,红花大金元的分子ID 为001100、K326 为101011、NC102 为101010、云 烟87 为--1010,可有效鉴别4个品种的复烤烟叶。
3 结论与讨论
本研究以我国4个主栽烤烟品种的复烤烟叶为供试材料,利用全基因组重测序技术获得21.5 Gb数据,共检测出27 137 个SNP 位点。本研究筛选出的SNP位点较以往报道偏少[9-10],推测可能与本研究所用复烤烟叶基因组DNA 严重降解有关[16]。为验证筛选出SNP位点的准确性,挑选53个SNP位点设计了PCR 引物对复烤烟叶进行基因分型,发现所有位点扩增产物大小均与预期结果一致,表明测序质量较高,发掘出的位点可靠性较好。
应用多态性高、稳定性好的SNP 位点构建指纹图谱和分子ID 是可操作性较好的植物品种鉴别方法[17-23]。目前,SNP 相关研究所用材料均为新鲜植物样本,尚无应用加工后植物材料的研究报道。前人研究结果显示,新鲜与烤后烟叶的SSR 指纹图谱有较大差异[6,15],从新鲜烟叶基因组DNA 开发出的SNP 位点可能在烤后烟叶中缺失或无多态性。为探索SNP 分子标记在烤后烟叶上品种鉴别的可行性,本研究应用53 个SNP 位点对4 个品种的复烤烟叶进行了基因分型,发现其中3 个位点具有品种多态性,通过构建指纹图谱和分子ID 可准确区分4个品种的复烤烟叶。需要指出的是,随着区分烟草品种的增多,所需SNP 位点也会相应增加,未来可利用本研究挖掘的候选SNP 位点进一步进行多态性筛选,构建更加完善的复烤烟叶SNP 分子ID,实现更多复烤烟叶品种的分子鉴别。
烟叶经打叶复烤后成为形态、结构大小类似的片烟,目前尚无准确、高效的品种鉴别方法。本研究应用3 个多态性SNP 位点,通过等位基因特异性PCR及电泳构建4个烟草品种复烤烟叶的指纹图谱和分子ID,首次开发了基于SNP 分子标记的烤后烟草品种鉴别技术。与前人报道通过高密度SNP 芯片进行烟草品种鉴别的方法[8]相比,本研究中的方法所需仪器设备简单、结果分析直观,对一线检测人员的知识背景和试验技能要求较低,更适于在卷烟生产企业推广应用。

