人工智能与分子模拟在药物设计中的研究进展*
张民权,龚铭城,陈泽锴,陈振华,周良良
(江西科技师范大学药学院,江西省药物分子设计与评价重点实验室,南昌 330013)
药物设计是一种高风险的研究,实验周期长、投资成本高、失败率高[1]。药物分子通常是与蛋白质等生物大分子的靶点特异性结合发挥药理作用,并且为了药物的利用率和安全性,必须设计合适的药物载体,仅通过实验手段很难从微观角度进行药物分子设计并高效地筛选出与其最适合的载体材料。人工智能(artificial intelligence,AI)与分子模拟技术的融合为药物设计研究带来了新的契机,分子模拟能够构建复杂的分子模型,解释生物体系中药物分子的运动过程[2],产生大量的数据信息,而AI技术能够提取分子模拟计算结果中的有效信息[3],并反馈给人工神经网络进行学习。2种技术互补的特性为两者在药物设计研究领域的结合提供了许多可能,近几年相关的研究成果也在不断增多。
本文综述联用AI与分子模拟技术在药物分子设计与药物载体材料设计领域的研究成果,为未来药物设计研究提供新的方法和思路。
1 传统计算机模拟
随着现代计算机技术的发展,计算机模拟已经广泛应用于药物研究领域。通过模拟虚拟现实环境突破了现实实验的局限性,提高了药物研究效率。传统计算机模拟有一些不足,如模拟结果缺乏统一可信的测量尺度,准确度较低,不同的软件可能出现不同的结果,并且人为因素对模拟结果的影响是巨大且无法避免的。
2 AI简介
AI是研究使计算机来模拟人的某些思维过程和智能行为的一门综合科学。经过几十年的发展,AI已经成为人工神经网络(artificial neural networks,ANN)[4]、机器学习(machine learning)[5]特别是深度学习(deep learning)[6]等技术的总称,包含有随机森林(random fost)、决策树(decision tree)、支持向量机(support vector machines,SVM)[7]等AI算法。AI 基于多层神经网络结构,具有较强的独立学习能力和逻辑推理能力,能够模拟人脑的思维过程。AI 技术弥补了传统计算机模拟的缺点,增加了AI 筛选、评价与学习的过程,降低了人为因素对模拟结果的影响,并且可以将模拟结果与众多数据库中的信息进行比对,提高了模拟结果的可信度,有效提升了计算机模拟效率,扩大了模拟范围。
AI技术可优化现有药物设计模式[8],辅助分子模拟技术进行分子对接、药物筛选、先导物的优化等药物设计方法[9],揭示药物的作用机制,探索对应的分子运动的规律,提出合理的药物设计优化方案。
3 分子模拟简介
分子模拟从空间上可分为量子、分子、介观等多个尺度,可以满足不同实验条件下的计算机模拟。量子尺度多用于大分子、酶、蛋白质等参与的化学反应[10],分子尺度多用于微观尺度的聚合物单链[11],介观尺度多用于较大的嵌段共聚物和共混体系等[12]。根据不同的实验需要选择适合的空间尺度,不仅可节约运算资源还可以避免实验中复杂的操作以及多变的外界环境的影响。
分子模拟技术目前已经开发了多种适用于不同尺度的模拟方法,如1976年WARSHEL和LEVITT提出的把量子力学和分子力学相结合的方法[13],适用于微观尺度的耗散粒子动力学(dissipative particle dynamics,DPD)和介观尺度分子模拟中的粗粒化分子动力学(coarse-grained molecular dynamics,CGMD)等。常用力场有CHARMM、AMBER、GROMOS和COMPASS力场。
用分子模拟技术计算出大量数据,通过AI 技术对数据进行挖掘,并建立相应模型,再利用分子模拟技术进行模拟分析,并将模拟结果反馈给AI 神经网络,这种研究方法符合未来药物设计研发从计算机辅助药物设计(computer-aided drug design,CADD)向人工智能辅助药物研发(artificial intelligence drug discovery &design,AIDD)转变的要求。
4 利用AI 与分子模拟进行合理的药物设计
近年以来,药物发现临床研究的淘汰率高达90%[1]。研究表明,美国制药公司花费大量成本在临床药物试验上,如果失败则会给公司带来巨大的经济损失,极大地限制了药物的研发和患者得到新疗法救治的机会[14]。而且基于结构的药物设计的难点是目标蛋白实际上呈现出一种变化的状态[15],极大地限制了药物研究的质量和效率,而通过AI预测筛选临床前候选药物可能只需要1年左右[16]。
随着计算机计算能力的提高以及AI 技术的逐渐发展,药物设计研发进入成熟合理化的阶段,针对酶、受体、离子通道等特异性靶点,设计出结构合理、高效长效无毒的药物分子。通过分子模拟,能直观形象地观察到药物分子之间的相互作用过程,判断药物分子与受体结合的可能位点,预测药物活性。
4.1分子对接(molecular docking) 分子对接是一种分析构象和取向(统称为“姿态”)的方法[17]。通常,分子对接所关注的结合位点是已知的,如所需要的蛋白质结构可以到蛋白质结构数据库(protein date bank,PDB)中搜索寻找。但对靶向区域的信息了解较少的情况下,有2种常用的方法:通过算法预测最有可能的结合位点和进行“盲对接”模拟。例如Moldock分子对接算法,它的评分功能是分段线性电位(piecewise linear potential,PLP)的拓展,采用这种算法可以准确地识别大部分复合物的正确结合模式[18]。具体分子对接操作流程见图1(图中蛋白质分子来自PDB)。

图1 分子对接流程
RANDOUX等[19]使用一种分子探针对原子热点进行采样生成片段热点图,直观地显示出分子生长的位置。但是,当进行“盲对接模拟”时,在所有的目标结构中筛选出合适的姿态需要巨大的计算消耗,所以,将AI 技术运用到分子对接中,可以大大减小时间成本。XUE等[20]利用AI 技术和糖尿病患者皮肤的测序结果筛选出曲古抑菌素A和靶组蛋白脱乙酰酶4,分子对接模拟出两者的相互作用,揭示两者之间有效的结合情况,预测出其疗效和安全性。SERRANO等[21]提出一种基于Q网络的Q-N分子对接方法,这种方法在Q-learning的基础上,通过结合ANNs和强化学习(reinforcement learning,RL)训练强化实现评分功能,并可以将模拟结果拓展到其他配体配对。
AI技术能够高效地预测分子对接可能的结合位点,解决了分子对接时资源耗费大的问题,达到了计算资源与计算准确度的平衡。
4.2药物筛选 计算机辅助药物筛选主要分为3类:基于受体、配体、蛋白质-配体相互作用,即虚拟筛选(virtual screening)。根据药物相似性概念的规则,如GHOSE等[22]、VEBER等[23]提出的规则,通过AI 技术进行预筛选,减少了实际需要筛选的药物分子数,发现先导化合物的效率大大提高,同时可对药物分子的可能活性进行预测,对潜在的化合物进行评价。进行虚拟筛选具体步骤见图2。

图2 虚拟筛选流程
ELEND等[24]联用AI 和分子模拟技术以Mpro为药物靶点设计了一种严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)主要蛋白酶抑制剂,先使用AI 算法筛选出针对Mpro的潜在候选药物列表,再使用分子模拟技术筛选出与Mpro结合的最有效的配体。ZHANG等[25]先利用AI 技术检索筛选出对SARS-CoV-2有效的化合物,对这些化合物的吸收、分布、代谢和排泄的计算机模型进行功能评估,再采用网络药理学预测药物体内效应,最后使用Autodock进行分子对接模拟,筛选出合适的靶点-配体。GONG等[26]利用AI 技术筛选出10种化合物作为糖尿病候选治疗药,并使用机器学习和ANN预测化合物与二肽基酶-4的结合情况,最后筛选出最优的化合物进行分子动力学模拟,对化合物的性能进行验证。
联用AI与分子模拟技术,解决了传统虚拟筛选的不准确和低效率等问题[27],并且可以将模拟结果反馈给ANN,通过不断的识别学习,产生具有相似性质的新分子。
4.3先导化合物的优化 尽管AI和分子模拟技术能有效地避免化合物选择性不够、药效强度不够、毒副作用等问题,但这还不足以证明所得化合物可以直接用于临床,需要对先导化合物进行结构修饰。DOMENICO等[28]在OLIVECRONA等[29]提出的Agent网络基础上,优化了分子线性输入规范(simplified molecular input line entry system,SMILES)生成算法,通过对神经氨酸酶、乙酰胆碱酯酶、SARS-CoV-2主要蛋白酶以及所对应的化学库进行研究,利用AI技术多目标优化了生成的化合物,为药物设计提供了一个效率更高更透明的框架。TANG等[30]利用高深度Q-learning网络和基于片段的药物设计,根据SARS-CoV-2的3CLpro靶点,自动生成靶向3CLpro的新化合物得到一个有效的先导化合物库,再通过AI模型进行功能评分,筛选出最优结构的化合物。
多项研究表明,在药物分子设计的步骤流程中,联用AI 技术和分子模拟的方法已经成为药物设计中重要的组成部分。AI 技术可以根据学习到的实验信息不断提出可以被验证的有效的假设,有效地预测潜在的生物活性化合物,2种方法联用比使用传统计算机模拟进行药物设计成本更低,效率更高。
5 利用AI与分子模拟技术寻找合适的药物载体
药物在供临床使用前,需要制备符合给药途径的剂型,发挥最大的作用和疗效。合适的药物剂型可以促进药物在人体内的吸收和分布,降低药物的毒副作用等。通过整合分子模拟、AI、化学信息学等技术,能够成功预测重要的药物目标,提供可靠的关于药物与载体交互的信息,选择最佳的药物-载体[31-33]。
5.1药物粒子设计 药物粉体的功能性质与粒子结构有关[34],可以通过粒子设计原理控制制备工艺参数得到重组粒子,实现粒子的功能设计。利用分子模拟技术模拟粒子与辅料之间的结合过程,得到参数反馈给AI 神经网络进行机器学习,优化工艺过程参数,筛选出最适合的药物和辅料。粉体的粒子设计技术主要结合方式见图3。

图3 不同粉体粒子设计的表面结合作用
HATHOUT等[35]利用高斯过程模拟聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]纳米粒子的组成和理化性质描述符,推导出最优参数,选用阿司匹林和白藜芦醇作为测试药物,将实验所测得的结合能与预测的结合能作对比,计算的百分比偏差为(12.38±2.10)%。WHITELAM等[36]通过研究粒子表面分子自组装的粗粒度计算模型证明神经进化学习算法可以识别材料粒子的自组装性能,能够定向设计所需特性的材料。
ALEXIADIS等[37]将“粒子”的概念进一步扩展,把人工神经元抽象为“粒子”,产生了一种新的“粒子神经元对偶”的AI 计算方法,这种算法兼顾了计算对粒子的建模能力和对数据的学习能力,通过对肠道膜和内容物的力学建模,成功地模拟出肠道的蠕动过程,为以后验证药物的活性提供了新的方法和思路。
5.2凝胶 水凝胶能够容纳小分子、聚合物等材料,具有生物相容性好、可降解等特点,是一种广受关注的制剂类型[38]。水凝胶交联分为物理交联和化学交联2种,通常化学交联更为紧密,见图4。
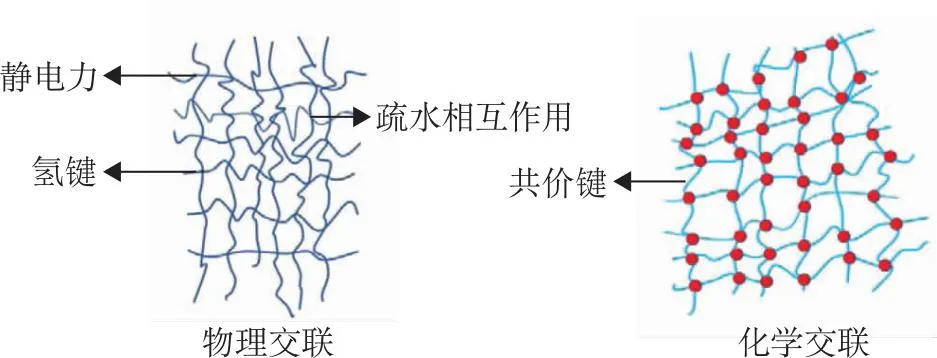
图4 水凝胶交联方式示意图
MOUHTADY等[39]提供了一种AI分析新策略,通过主成分分析法评估了35种不同水凝胶的吸附性能,根据不同使用场景筛选出不同的最适凝胶类型。LI等[40]利用分子模拟研究聚(N-异丙基丙烯酰胺)凝胶的相变机制,分析模拟数据,发现这种多孔凝胶溶胀性能与交联剂聚乙二醇呈正相关,适合充当药物制剂中的释放剂。WANG等[41]利用多功能水凝胶对慢性创面进行智能监测,根据卷积神经网络(convolutional neural networks,CNN)进行的高精度伤口模型,分析出伤口的实时状态。
通过AI筛选、分子模拟分析数据得到最优性能的材料和最适合的使用方法,这种多功能水凝胶和AI 的新型组合治疗模式,为未来在对疾病的治疗、反应和实时报告提供了重要的方法,是治疗方式的一大进步。
5.3胶束 胶束是以表面活性剂或两亲性高分子在水中自组装形成的药物载体材料[42],具有靶向性好、生物相容性高和毒副作用小等特点,是有效的基因药物载体。胶束又分为胶束和反胶束,见图5。

图5 载药胶束结构
RAO等[43]利用计算机分析拟合的胶束化学模型,研究了Co(II)、Ni(II)、Cu(II) 和 Zn(II) 与L-天冬氨酸在不同pH胶束介质中的形态,并通过计算机程序解释了不同二元复合物在胶束中的稳定性常数及其与介质摩尔分数的变化关系。TANG等[44]用聚乙二醇基反胶束研究活性染料在非水性介质的性能,并通过计算机配色进行分析,建立了校准染色数据库。LIU等[45]提出了一种用于评估胶束电动毛细管色谱分离质量的方法——Q方法,该方法使用ANN模拟和优化分离的选择性和色谱分析时间,对ANN进行训练,并与传统方法所得结果进行对比分析,建立了一套新的评价标准。实验证明[46],这套标准也适用于其他的分离方法。
通过将AI分子模拟技术与实验设计相结合,不断地完善对胶束的研究,能够有效筛选或制备出最适合的聚合物胶束,解决了胶束不稳定、载药量低等缺点带来的问题。
5.4脂质体 脂质体是一种将药物包封在类脂双分子层内形成的囊泡[47]。药物脂质载体结构见图6。

图6 脂质体结构
但脂质体存在包封率低、不稳定等缺点。ROUCO等[48]利用FormRules®v4.03 和INForm®v5.01 AI 软件对负载疏水性药物的纳米脂质体模型进行充分表征得到相关参数并进行优化,成功地对数据库建模,获得了一种可重复的、稳定的纳米脂质体合成方法。HATHOUT等[49]利用分子模拟和高斯过程机器学习模拟和预测固体脂质纳米颗粒的载药情况,再通过姜黄素固体脂质颗粒进行实验验证AI 和分子模拟技术预测的准确性,并使用高斯过程分析数据,不断优化分子模拟过程。METWALLY等[50]先通过分子模拟技术构建出包含三棕榈素的脂质纳米颗粒模型,研究药物与不同聚合物系统的相互作用,所得的结果通过姜黄素作为模型药物进行实验验证,再使用AI 神经网络筛选确定对药物负荷的影响因素,对药物载体和药物的结合进行优化。
通过对药物合成、分子模拟过程、药物与载体结合不断优化,能够有效地提高脂质体稳定性和包封率,在增强疗效、降低毒副作用的同时又减小了实验成本。
AI与分子模拟技术在脂质体方面的应用相对较多[51-54],数据库种类较为齐全,是未来最具有发展潜力的一种药物载体之一。
6 结束语
AI与分子模拟技术改变了药物研发的方式,大大降低了药物设计的成本,提高了药物研发的效率。计算机辅助药物设计的快速发展预示着药学研究开始进入分子水平的精准药物设计时代。但生物医药领域的复杂性高,药物相关数据类型多样,对各种化合物的表征预测数据较为匮乏,国际上AI 药物设计也处于初级阶段。随着计算机算法与计算能力的不断提高,AI 技术所构建的数据库不断完善,未来对药物设计研究中质量和效率的把控更加准确,开发出安全有效、精准治疗的最适合患者的药物,是药物研发从CADD向AIDD转变的最重要的环节。

