淫羊藿苷对男性生殖系统的药理作用研究进展及文献可视化分析*
张静益,李俊君,方春燕,蒲诗云,张凤,杨薆黎,俞旭君,
(1.成都中医药大学临床医学院,成都 610075;2.成都中医药大学附属医院代谢性疾病中医药调控四川省重点实验室,成都 610075;3.成都市第五人民医院/成都中医药大学附属第五人民医院第二临床医学院,成都 611137)
随着我国社会经济发展和人口结构改变,男性生殖系统疾病如男性不育症、阴茎勃起功能障碍(erectile dysfunction,ED)、良性前列腺增生症(benign prostatic hyperplasia,BPH)、前列腺癌等患病率正逐年上升,患者常常合并其中的一种或多种疾病,但其病因尚不明确。大量研究表明,衰老、遗传因素、生活方式、环境污染等均参与上述疾病发病过程。而在治疗方式上,除了改善生活方式外,目前可选择的治疗药物及其效果十分局限[1-3]。中国传统医学在治疗生殖系统疾病方面有着丰富的理论和实践经验,《黄帝内经》认为“肾主生殖”,生殖功能由肾中精气所主导,肾精促进机体生殖繁衍,是人体生命活动之源。肾精充盈,肾气旺盛,则生殖有道[4]。淫羊藿是中国传统补益中草药之一,最早记载于《神农本草经》,又名“仙灵脾”“刚前”,其性温,味辛、甘,归肝肾两经,具有温阳补肾、强筋健骨的功效。其主要有效成分为淫羊藿苷(icariin),为淡黄色针状结晶,化学式为C33H40O15,相对分子质量676.66[5]。淫羊藿苷具有保护心血管系统、调节骨代谢和改善勃起功能等广泛的生物活性[6]。大量分子药理学研究表明,淫羊藿苷对多种男性生殖系统疾病均有显著改善作用[7],但笔者尚未见文献有研究对其药理作用机制进行深入总结。
文献计量学及可视化分析作为新兴的研究方法,通过对已发表文献进行定量、定性分析,并在进行一定的数据处理和图形绘制后,直观地揭示关键领域研究热点及研究趋势,并预测未来研究热点,可有效弥补文献综述的不足[8]。
因此,笔者结合文献计量学及可视化分析,从不同层面系统地总结淫羊藿苷对男性生殖系统的药理作用及机制研究进展,以期为淫羊藿苷在改善男性生殖健康的深层次研究、新药研发、临床应用提供相关的参考依据。
1 调控细胞增殖与凋亡
细胞增殖与凋亡在男性生殖系统疾病发生发展及损伤修复过程中起着重要作用[9]。NAN等[10]用淫羊藿苷5、10、15、20、25 μmol·L-1(24 h)在体外处理睾丸支持细胞,发现其呈剂量依赖性激活ERK1/2信号通路,从而诱导体外睾丸支持细胞增殖。大量研究表明线粒体途径(内在途径)是淫羊藿苷在男性生殖系统中影响细胞凋亡的主要途径。HE等[11]发现淫羊藿苷80 mg·kg-1(6 周)可显著上调高脂饮食(high fat diet,HFD)以及链脲佐菌素(streptozotocin,STZ)诱导的糖尿病大鼠睾丸B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)蛋白表达,下调Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)和半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)的表达水平,提高增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、沉默信息调节因子1(sirtuin 1,SIRT1)活性及缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)表达,通过激活SIRT1-HIF-1α信号通路、增强睾丸细胞增殖、抑制线粒体依赖性细胞凋亡来改善糖尿病大鼠生殖功能障碍。近期研究发现,淫羊藿苷1 μg·mL-1(3 h)可有效降低活性氧(reactive oxygen species,ROS)并恢复线粒体膜电位水平,从而减少邻苯二甲酸二(2-乙基已基)酯[di(2-ethylhexyl)phthalate,DEHP]诱导的睾丸Leydig细胞凋亡[12]。在有关附睾的研究中发现淫羊藿苷100 mg·kg-1(6 周)灌胃给药可以降低实验性精索静脉曲张模型大鼠附睾上皮细胞凋亡指数[13]。在阴茎组织中,淫羊藿苷1、5、10 mg·kg-1(3 个月)通过下调STZ诱导的糖尿病大鼠转化生长因子-β1(transforming growth factor-β1,TGF-β1)、磷酸化信号转导蛋白(phosphorylated-Smad,P-Smad)表达,以改善糖尿病大鼠阴茎平滑肌和内皮细胞的凋亡[14]。WANG等[15]在体外氧化应激模型模拟的糖尿病性勃起功能障碍(diabetes mellitus-induced erectile dysfunction,DMED)海绵体微环境中发现淫羊藿苷100 μmol·L-1(12 h)显著抑制脂肪间充质干细胞(adipose tissue derived mesenchymal stem cells,ADSCs)ROS的产生,并且可以通过激活磷酸化的信号转导与转录激活因子3(signal transducer and activator of transcription,STAT3)及其上游调节磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,从而上调Bcl-2表达,下调Bax、Caspase-3表达水平,表明淫羊藿苷可以通过激活PI3K/Akt-STAT3信号通路抑制氧化应激介导的凋亡,从而增强ADSCs对DMED模型大鼠的疗效。以上研究证明淫羊藿苷的促增殖、抗凋亡作用是其改善男性生殖系统疾病的主要机制。
但与上述研究不同的是,淫羊藿苷在BPH以及前列腺癌模型中表现出抑制增殖及促凋亡的作用。在代谢综合征(metabolic syndrome,MetS)诱发的大鼠BPH模型中,淫羊藿苷25、50 mg·kg-1(5 周)通过上调大鼠前列腺组织中Bax mRNA表达及下调Bcl-2 mRNA表达,以促进细胞凋亡[16]。miR-7是miRNA的重要成员,主要通过抑制细胞增殖和刺激细胞凋亡来抑制肿瘤,并在多种肿瘤细胞中表达下调,是肿瘤的应激源[17]。HAN等[18]研究发现淫羊藿苷50 μmol·L-1(12 h)显著提高人类良性前列腺上皮细胞(benign prostatic hyperplasia cell line,BPH-1)凋亡率,并发现淫羊藿苷通过上调BPH-1和正常前列腺上皮细胞(RWPE-1)的miR-7表达水平,抑制PI3K、Akt、ERK1/2蛋白的磷酸化和原癌基因丝氨酸/苏氨酸蛋白激酶1(protooncogene serine/threonine-protein kinase 1,RAF1)的表达,进一步增强凋亡因子Bax、Cleaved-Caspase-3、Cleaved-Caspase-9的蛋白表达,从而抑制细胞增殖、加速细胞凋亡。HUANG等[19]用淫羊藿苷代谢产物淫羊藿素处理前列腺癌细胞PC-3发现,其诱导的线粒体膜电位去极化介导的细胞凋亡或坏死主要发生在其干预的早期阶段5~50 μmol·L-1(24 h),并呈剂量依赖,而在48 h时凋亡信号显著减少。在通过注射人前列腺癌细胞株(LNCaP)构建的前列腺癌原位移植瘤SCID小鼠模型中,淫羊藿苷40、80 mg·kg-1(5 周)通过抑制雄激素受体信号通路中雄激素受体(androgen receptor,AR)蛋白的磷酸化以及增强磷酸酶与张力蛋白同源物表达,将癌细胞阻滞于S期,从而抑制LNCaP增殖[20]。
2 抗氧化损伤
氧化应激由体内ROS等自由基与抗氧化系统失衡导致,可引起细胞结构功能损伤,从而影响疾病的各阶段。氧化应激是导致精子细胞功能障碍及男性不育的主要原因[21]。ZHAO等[22]研究表明,淫羊藿苷2、6 mg·kg-1(4 个月)可提高自然衰老大鼠睾丸超氧化物歧化酶(superoxide dismutase,SOD)活性,降低丙二醛(malondialdehyde,MDA)水平。同时在体外实验中发现,淫羊藿苷0.5、1 μmol·L-1(20 h)显著抑制D-gal诱导分泌功能减弱的TM4细胞衰老模型ROS的产生。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)通路是机体内重要的抗氧化途径[23]。在自然衰老大鼠模型中,淫羊藿苷2、6 mg·kg-1(4 个月)通过激活Nrf2信号通路,将Nrf2转移到细胞核并诱导HO-1、醌氧化还原酶-1(nadph:quinone oxidoreductase-1,NQO1)等下游靶分子保护基因转录,从而减轻氧化应激[24]。此外,该团队已证实淫羊藿苷0.5、1 μmol·L-1(20 h)可以通过Nrf2/HO-1信号途径抵抗D-半乳糖诱导的小鼠睾丸支持细胞株15P-1氧化应激损伤[25]。另有研究发现,淫羊藿苷75 mg·kg-1(35 d)显著上调尼古丁诱导的雄性小鼠生殖毒性模型睾丸中SOD1、SOD3 mRNA表达,并抑制SOD酶活性的降低和MDA水平的升高[26]。但值得注意的是,适当剂量的淫羊藿苷50、100 mg·kg-1(35 d)可以提高睾丸的SOD活性,降低MDA水平改善脂质过氧化,而大剂量的淫羊藿苷200 mg·kg-1(35 d)反而可能会增加睾丸的氧化应激来损害生殖功能[27]。在生殖系统其他器官中,淫羊藿苷仍可发挥其作用,例如在BPH模型大鼠前列腺组织中,淫羊藿苷25、50 mg·kg-1(5 周)可显著降低其MDA水平并减少氧化氢酶(catalase,CAT)和谷胱甘肽(glutathione,GSH)的消耗[16],从而减少氧化应激损伤。阴茎海绵体组织中四氢生物蝶呤(tetrahydrobiopterin,BH4)可以维持内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)处于耦合状态,当BH4被还原时,eNOS二聚体被破坏成单体,NO不能正常合成,产生超氧化物。超氧化物与NO反应形成过氧亚硝基阴离子(peroxynitrite,ONOO-)后通过促进BH4氧化为BH2,加速eNOS解偶联并抑制NO产生,从而介导一系列过氧化损伤[28-29]。LONG等[30]研究表明在原发性高血压大鼠(spontaneously hypertensive rat,SHR)模型中,淫羊藿苷10 mg·kg-1(4 周)明显提高大鼠阴茎海绵体组织BH4、鸟苷三磷酸环化水解酶1(guanosine triphosphate cyclic hydrolase 1,GTPCH1)、二氢叶酸还原酶(dihydrofolate reductase,DHFR)浓度,降低还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)、BH2浓度,说明淫羊藿苷通过提高阴茎海绵体组织GTPCH1水平刺激GTP途径的BH4合成;并通过提高DHFR(补救途径)的水平,加速BH2向BH4的转化。
淫羊藿苷调控细胞增殖、凋亡、抗氧化损伤具体作用机制见图1。

图1 淫羊藿苷作用机制(a)
3 抑制前列腺细胞迁移、侵袭和调控细胞周期
癌细胞的迁移、侵袭及细胞周期是影响前列腺肿瘤发展的重要因素。研究表明,淫羊藿苷呈浓度依赖性抑制前列腺癌细胞系Du145与PC3细胞的活性,淫羊藿苷40 μmol·L-1(48 h)显著下调Du145与PC3中Notch-1、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、MMP-9和发状分裂相关增强子1(Hes-1)蛋白表达,说明淫羊藿苷可能通过下调Notch-1通路,抑制前列腺癌细胞的生长、迁移与侵袭[31]。此外,淫羊藿苷能够调控细胞周期启动子(cyclin)、周期蛋白依赖激酶(CDK)、细胞周期抑制剂等细胞周期相关蛋白的含量,诱导细胞周期阻滞。据报道,淫羊藿苷代谢产物淫羊藿素5~30 μmol·L-1在PC-3前列腺癌细胞中引起剂量依赖性G1期阻滞,且能显著上调2种细胞周期蛋白依赖性激酶抑制剂p27Kip1和p16Ink4a表达,增加视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)的表达,并降低p-pRb、Cyclin D1、CDK4表达水平[19]。以上研究表明,淫羊藿苷可能通过Cyclin D1/CDK4/p16Ink4a通路抑制PC-3细胞的生长。在BPH组织中,BPH-1和RWPE-1迁移可加快BPH进程[32-33]。淫羊藿苷50 μmol·L-1(12 h)通过上调BPH-1和RWPE-1的miR-7表达水平,降低细胞周期调节蛋白D1(cell cycle regulatory protein D1,Cyclin D1)、MMP-2、MMP-9表达,增加p53、p21蛋白表达,从而抑制BPH-1和RWPE-1迁移并阻滞细胞周期[18]。此外,ALJEHANI等[16]的研究也表明淫羊藿苷25、50 mg·kg-1(5 周)显著降低MetS引起的大鼠BPH前列腺组织Cyclin D1蛋白的表达。对于前列腺癌原位移植瘤SCID小鼠,淫羊藿苷40、80 mg·kg-1灌胃给药(5 周)可以将前列腺癌LNCaP细胞阻滞于S期,检测到G0/G1期比例明显降低,S期比例明显提高[34]。以上研究均为淫羊藿苷成为针对前列腺癌、BPH潜在有效的化学预防及治疗剂提供了理论参考。
4 促进睾酮合成与分泌
睾酮是影响男性生殖功能最为重要的激素,参与男性生殖器官发育、精子发生、阴茎勃起、性欲维持等一系列过程[35]。胆固醇是合成睾酮的起始分子,胆固醇从线粒体外膜到内膜的跨膜转运是睾酮产生的重要步骤,它受包括外周型苯二氮受体(peripheral benzodiazepine receptor,PBR)和类固醇合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)在内的胆固醇跨膜转运调节剂的调节[36]。类固醇生成因子1(steroidogenic factor 1,SF-1)是核受体超家族的成员之一,与DNA反应元件结合可以调节CYP11、3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)等类固醇合成酶和StAR基因的转录[37-38],类固醇合成酶在睾酮合成过程中发挥重要作用[39]。
研究表明,淫羊藿苷改善睾酮分泌的机制与其促进胆固醇的跨膜转运和上调Leydig细胞SF-1及其下游类固醇合成酶的表达有关,而Esr1/Src/Akt/Creb/Sf-1信号通路可能是淫羊藿苷促进睾酮合成的关键通路。CHEN等[27]研究发现,适当剂量的淫羊藿苷50、100 mg·kg-1(35 d)可以通过上调雄性大鼠StAR、细胞色素P450C17(cytochrome P450C17,CYP17A1)和PBR表达,促进胆固醇的跨膜转运来增加睾酮合成。此外,在睾丸Leydig细胞中,淫羊藿苷1 μg·mL-1(3 h)显著抑制DEHP诱导的SF-1、类固醇合成酶(CYP11、3β-HSD和17β-HSD)蛋白表达的降低,并提高SF-1、CYP11和3β-HSD mRNA的表达水平[12]。且在进一步体外实验中发现淫羊藿苷1 μg·mL-1(3 h)显著提高睾丸Leydig细胞p-Akt和磷酸化环磷酸腺苷反应元件结合蛋白(phosphorylated cyclic AMP response element binding protein,p-Creb)表达,并可拮抗Akt抑制剂MK2206对Leydig细胞中CYP11a1和HSD3b mRNA表达及睾酮合成的抑制作用;而将睾丸Leydig细胞暴露于Creb抑制剂KG501后,由于KG501直接靶向Creb结合蛋白(creb-binding protein,Cbp)的KIX结构域,Creb结合位点被阻断,淫羊藿苷预处理并未增加其睾酮合成。该团队通过生物信息学分析预测得出雌激素受体1(estrogen receptor 1,Esr1)可能是淫羊藿苷激活Akt的起始靶点,它通过作用于Esr1激活酪氨酸激酶(c-Src)以诱导p-Akt发挥其药理作用;体内实验结果同样表明,淫羊藿苷100 mg·kg-1(14 d)逆转了DEHP诱导的p-Src、p-Akt和p-Creb水平的降低,从而改善睾酮合成[40]。
淫羊藿苷抑制前列腺癌细胞迁移及侵袭、调控细胞周期、促进睾酮合成具体作用机制见图2。

图2 淫羊藿苷作用机制(b)
5 改善阴茎勃起功能
NO-环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)通路在阴茎勃起过程中起关键调控作用,NO可将GTP转化为cGMP,并作用于钙离子通道,从而松弛阴茎海绵体平滑肌,促进血液流入阴茎动脉和海绵窦间隙,产生并维持阴茎勃起[41-42],而磷酸二酯酶5(phosphodiesterase 5,PDE5)催化cGMP水解,可逆转上述过程。
5.1淫羊藿苷对PDE5、cGMP的影响 据报道,淫羊藿苷可显著抑制PDE5的表达,并呈剂量依赖性提高阴茎海绵体中cGMP浓度[43]。ED是前列腺根治切除术及盆腔根治性手术常见的并发症,由于术中海绵体神经受损,使PDE5抑制剂的靶点通路受到干扰,故PDE5抑制剂虽然作为此类患者的首选用药,但其治疗效果并不理想[44]。XU等[45]在双侧海绵体神经损伤的大鼠模型中发现,淫羊藿苷1.5 mg·kg-1(4 周)治疗可显著增加大鼠阴茎海绵体组织内cGMP浓度以及阴茎海绵体内压(intracavernous pressure,ICP)/平均动脉压(mean arterial pressure,MAP),并发现淫羊藿苷促进内源性干细胞分化为雪旺细胞。
5.2淫羊藿苷对一氧化氮合酶(nitric oxide synthase,NOS)的影响 NO由NOS催化合成,NOS有3种亚型,即eNOS、神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)。
在SHR模型中,LI等[46]发现淫羊藿苷2.5 mg·kg-1联合灯盏花素80 mg·kg-1(4 周)可明显上调其阴茎组织eNOS和nNOS表达水平,并升高ICP/MAP。LIU等[47]研究发现淫羊藿苷10 mg·kg-1(4 周)显著上调SHR阴茎海绵体热休克蛋白90(heat shock protein 90,HSP90)和钙调蛋白的表达,从而提高eNOS活性、下调小窝蛋白-1(caveolin-1,Cav-1)表达并抑制二者的相互作用,其中Cav-1在血管内皮细胞膜存在丰富,能够与eNOS稳定结合,抑制其活性从而实现其对下游蛋白分子活性的负向调控。在结扎双侧髂内动脉诱导的动脉性ED大鼠模型中,淫羊藿苷5、10 mg·kg-1(28 d)显著升高eNOS表达并轻度升高iNOS表达水平,但nNOS的表达无明显增加[48]。这与LI等[46]研究结果部分矛盾,分析其原因:在SHR中,长期较高的阴茎动脉血流灌注导致阴茎局部组织扩血管系统处于抑制状态,其中包括各种类型NOS基础分泌受到抑制,故应用淫羊藿苷处理后其对各类型NOS均有显著促进作用,且该研究联合应用灯盏花素,也可能在其中发挥重要作用;而在结扎双侧髂内动脉诱导的动脉性ED大鼠模型中,阴茎局部组织血流灌注锐减,严重的缺血、缺氧可能在侧支循环建立之前造成神经组织难以修复的损伤,导致nNOS变化不显著,但随着侧支循环的建立,血管内皮细胞仍可在淫羊藿苷的作用下分泌eNOS。
X线放射治疗(放疗)是前列腺癌的重要治疗方法,约50%接受前列腺放疗患者3~5年内出现ED[49]。这可能是由于电离辐射促进线粒体相关膜(mitochondria-associated membranes,MAMs)形成,从而使海绵体血管内皮细胞线粒体呼吸受到间接抑制,ATP产生减少,最终导致eNOS/NO信号通路抑制[50-51]。DENG等[52]研究表明淫羊藿苷10 mg·kg-1(9 周)通过抑制前列腺放疗大鼠MAMs相关蛋白I型1、4、5-三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptor type I,IP3R1)、磷酸呋喃酸分簇蛋白2和脂肪酸辅酶A连接酶4表达,使MAMs形成减少,从而提高p-eNOS/eNOS改善大鼠勃起功能受损。另有研究发现,淫羊藿苷50、100、200 mg·kg-1(21 d)呈剂量依赖性地升高雄性小鼠下丘脑多巴胺和5-羟色胺的浓度,并增加阴茎组织中eNOS、PI3K的表达,提高p-Akt/Akt比值,表明淫羊藿苷改善勃起功能的机制与调控PI3K/Akt/eNOS/NO信号通路和下丘脑-垂体-性腺轴密切相关[53]。
5.3其他 糖尿病男性中患ED的比例显著高于非糖尿病男性,而常用的PDE5抑制剂在严重的DMED中见效甚微[54]。LIU等[14]用淫羊藿苷1、5、10 mg·kg-1(3 个月)治疗STZ诱导的糖尿病大鼠,发现淫羊藿苷显著增加血小板内皮细胞黏附分子1(platelet endothelium cell adhesion molecules-1,PECAM-1)和血管性血友病因子(von willebrand factor,vWF)表达,提高尼克酰胺腺嘌呤二核苷酸磷酸阳性染色率,表明淫羊藿苷可以修复糖尿病引起的阴茎海绵体内皮细胞损伤,并且可能具有神经保护特性,从而促进糖尿病大鼠神经损伤后的神经再生和勃起功能恢复。此外,淫羊藿苷10 mg·kg-1(4 周)显著降低SHR血小板计数(PLT)、平均血小板体积和血小板分布宽度以及内皮微粒、内皮祖细胞、玻连蛋白受体水平,其中ICPmax/MAP与血小板分布宽度和玻连蛋白受体强负相关,与平均血小板体积、内皮微粒、内皮祖细胞呈中度负相关,提示淫羊藿苷可能通过降低血液中内皮微粒的含量,抑制血小板的活化来改善SHR的勃起功能[55]。
6 淫羊藿苷对男性生殖系统影响相关文献可视化分析
为更全面了解目前研究热点以及未来研究趋势,笔者通过文献计量学的方法纳入2001年1月1日—2022年11月1日Web of Science核心合集数据库中收录的淫羊藿苷对男性生殖系统影响的相关文献(发表文献类型为“Articles”或“Review Articles”的英文文献),并利用CiteSpace 6.1.R3 Basic、VOSviewer 1.6.18版软件对该领域研究成果进行可视化。
利用Web of Science的检索结果分析及引文报告功能,发现淫羊藿苷对男性生殖系统影响相关研究的发文量及被引用量呈逐年上升趋势,中国为该领域发文量及被引用量最多的国家;北京大学(PEKING UNIVERSITY)为发文量及被引用量最多的机构;Xin ZC为发文量最多的作者;“A novel anticancer agent,icaritin,induced cell growth inhibition,G(1) arrest and mito-chondrial transmembrane potential drop in human prostate carcinoma PC-3 cells”是被引用次数最多的文献。
采用VOSviewer软件进行关键词共现聚类分析,关键词图谱中节点的大小代表关键词出现频率,频率越高,说明其研究热度越高[56]。如图3所示,去除无实际意义高频词后,出现频率最高的关键词分别是:淫羊藿苷(icariin)、勃起功能障碍(erectile dysfunction)、体外(in-vitro)、凋亡(apoptosis)、氧化应激(oxidative stress)、西地那非(sildenafil)。关键词图谱中4种不同颜色的簇分别代表4个不同的主题聚类,红色簇主要由淫羊藿苷(icariin)、凋亡(apoptosis)、氧化应激(oxidative stress)、睾酮(testosterone)、增殖(proliferation)组成。该集群主要探讨淫羊藿苷对男性生殖系统作用的相关机制,上述机制在前文皆有论述。绿色集群主要包括海绵状神经损伤(cavernous nerve injury)、激活(activation)、勃起功能(erectile function)、模型(model)、一氧化氮合酶(nitric oxide synthase),此集群主要探究在体内实验中淫羊藿苷改善ED的分子机制。此外,体外(in-vitro)、磷酸二酯酶-5(phosphodiesterase-5)、环磷酸鸟苷(cGMP)、细胞(cells)、生长(growth)是蓝色集群的主要组成部分,本集群主要证明淫羊藿苷在体外对PDE5及阴茎海绵体中cGMP浓度的影响。黄色簇主要由勃起功能障碍(erectile dysfunction)、西地那非(sildenafil)、提取(extract)、男性(men)、双盲(double-blind)组成,在这个集群中,通过一系列临床实验来描述淫羊藿苷改善ED的疗效。

图3 淫羊藿苷与男性生殖系统研究关键词共现可视化图(VOSviewer)
突现关键词是指在某段时间内大量出现的关键词。CiteSpace突现关键词功能可用于探索研究领域的潜在热点并预测该领域的学术研究趋势及研究前沿[57]。如图4所示,2001—2014年的研究热点主要围绕ED展开,oxidative stress(氧化应激)则是最新的突现关键词。文献计量分析与文献回顾表明氧化应激可能是未来淫羊藿苷与男性生殖系统相关研究的潜在研究热点。
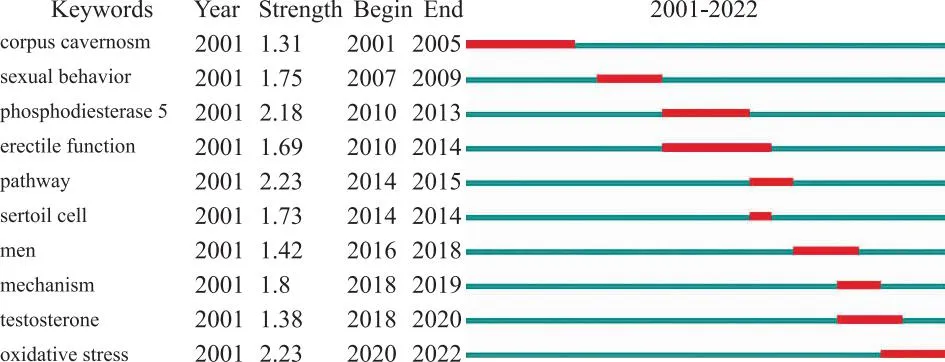
红线代表该关键词突现的时间段,绿线为出现的全部时间段。
7 结束语
淫羊藿苷不同于传统西药针对单一靶点,其参与多条信号转导途径对男性生殖系统各个组成部分均有影响,主要有调节细胞增殖与凋亡、抗氧化损伤、调控细胞周期、抑制肿瘤细胞迁移和侵袭、调节睾酮合成与分泌、改善阴茎勃起功能等。根据文献计量学分析结果,目前对于淫羊藿苷的研究热点在其改善阴茎勃起功能方面;同时,淫羊藿苷改善男性生殖系统氧化应激的作用逐渐成为未来研究趋势。但目前淫羊藿苷对男性生殖系统作用的机制尚不完全明确,且由于其水溶性及细胞膜渗透性较差(10-7cm·s-1),口服生物利用度低(12.02%)等缺点[58],削弱了其潜在的价值,故现阶段研究主要局限于细胞及动物模型,缺少大量临床研究数据的支持[59]。未来可通过网络药理学、生物信息学、多组学分析等对淫羊藿苷的药理作用进行更为全面深入地研究,同时在保证安全有效的前提下逐渐开展临床试验,进一步阐释其在体内的吸收、分布及代谢等规律,探索新型制药及载药方式,还应结合中医“异病同治”理论,分析其多靶点、多途径作用之间的相关性及交互影响,促进淫羊藿苷在男性生殖健康领域发挥更重要作用。

