基于单细胞测序和芯片数据分析强直性脊柱炎合并克罗恩病的肠黏膜免疫浸润和炎症微环境
罗锡庆, 古洁若
中山大学附属第三医院风湿免疫科、广东省免疫疾病临床医学研究中心(广东广州 510630)
强直性脊柱炎(ankylosing spondylitis,AS)是一种常见的以附着点炎症、新骨形成为特征的主要侵犯脊柱和骨盆骶髂关节的炎症性风湿免疫疾病[1]。约60%的AS患者存在无症状的肠道炎症,行肠镜检查发现多见于近端结肠和回肠末端部位的微小炎性病灶存在[2],或宏基因组测序结果显示肠道菌群失调[3],不仅对炎症因子表达产生了影响,还引发肠黏膜免疫细胞浸润状态产生改变[4],但患者无明显胃肠道不适的主诉,处于亚临床肠炎的状态尚未达到炎症性肠病(inflammatory bowel disease,IBD)的诊断标准。随着病程的进展,引起肠道易激惹的症状,如大便次数增加、腹泻,有约7%~10%[5-6]的严重患者可能演变为具有临床表现的肠炎,发展为IBD如典型的克罗恩病(Crohn′s disease, CD)或溃疡性结肠炎(ulcerative colitis, UC)[7],目前以累及回盲部的CD最为常见。根据在镜下观察的病理特点可以把具有临床表现的肠炎进一步分为急性和慢性两种表型,其中,急性炎症表型以中性粒细胞浸润为主;而慢性炎症表型则以单核、淋巴细胞浸润为主,同时具有病理结构破坏且类似于CD的表现。肠黏膜免疫细胞的变化在IBD的发生和发展过程中是一个重要的方面,肠黏膜免疫细胞相互作用导致了肠道炎症的进一步发展和加重[8]。因此,在IBD的治疗过程中,免疫调节剂、生物制剂等治疗方法都致力于控制这些免疫细胞的数量和活性,从而减轻炎症反应,控制肠道炎症。同时,肠道和外周血免疫细胞的变化也可以作为IBD的临床诊疗当中的重要参考指标之一,通过检测免疫细胞的类型和数量来判断IBD的病情严重程度和预后等信息[9]。成人和儿童IBD患者的外周血和肠黏膜中都发现了活化的CD4+和CD8+T细胞[10]。在AS合并IBD的病理生理过程中,CD8+T细胞可能发挥关键作用。首先,CD8+T细胞在肠道黏膜屏障的维持和病原体清除中具有重要功能[11]。在IBD中,肠道黏膜屏障受损,导致肠道细菌穿越黏膜进入组织,进一步加重炎症。CD8+T细胞的异常激活可能导致肠道黏膜屏障损伤,加剧炎症反应[12]。其次,CD8+T细胞分泌多种炎症性细胞因子,如肿瘤坏死因子-α(TNF-α)和γ-干扰素(IFN-γ),参与炎症反应的调节[13]。在AS和 IBD的病理过程中,这些炎症性细胞因子可能导致组织损伤和炎症。此外,CD8+T细胞与其他免疫细胞如Th17和Treg细胞以及抗原呈递细胞如树突状细胞和巨噬细胞[14]存在相互作用,参与AS合并IBD的病理过程。细胞毒性CD8+T细胞和产生白细胞介素(IL)-17的CD8+细胞(又称Tc17细胞)参与IBD的发病机制[14]。CD8+T细胞在AS合并 IBD的发病机制中可能扮演着重要角色。它们参与肠道黏膜屏障的损伤和修复过程、炎症性细胞因子的产生以及与其他免疫细胞的相互作用,共同促进炎症反应的持续和加重[15-18]。深入研究CD8+T细胞在这些疾病中的作用和相互关系,有助于揭示病因学,并为开发针对特异性T细胞亚群的治疗策略提供理论依据。因此,为了解析AS患者合并肠炎机制,本研究使用GEO数据库中的芯片数据初探AS合并亚临床肠炎、AS合并CD的肠组织中免疫细胞浸润情况及主要炎症信号通路激活情况,并使用AS合并肠炎的肠黏膜及外周血的单细胞测序数据集进行分析验证肠炎中的主要炎症信号通路活性,为AS关节外并发症监测、后续治疗提供新思路。
1 资料与方法
1.1 主要数据 为了获取AS患者的肠黏膜组织的基因表达芯片、测序与其临床数据,使用关键词为“脊柱关节炎、强直性脊柱炎”和“肠炎”,在美国国立生物技术信息中心 (National Center for Biotechnology Information,NCBI)的GEO数据库中进行检索。检索公式具体如下: (Ankylosing spondylitis OR spondyloarhtritis OR Spondylarthropathy) AND (inflammatory bowel disease OR Crohn′s disease OR ulcerative colitis OR colitis),共获得4个GSE数据集,分别为GSE163314、GSE92472、GSE14442、GSE10080,其中GSE92472为全血组织来源且样本量少没有设定生物学重复,GSE10080为从健康人群中提取PBMC细胞并使用IL-23刺激相互对照的数据集,均为非肠道组织数据予以排除,GSE163314为单细胞测序包含AS的肠黏膜数据,GSE14442为AS合并CD的肠黏膜芯片数据。最终纳入GSE14442、GSE163314为主要研究数据。临床数据主要通过以下方式获得:(1)通过作者上传的基因表达matrix文件中提取。(2)通过数据集相对应文献的全文及补充材料获得。见表1。
1.2 芯片数据处理分析流程
1.2.1 芯片数据处理 从GEO平台下载双色芯片GSE14442 表达矩阵,该数据为CD患者和包括AS的脊椎关节炎患者肠道活检中的基因芯片数据。根据作者数据处理说明,选择Channel 1荧光标记为Cy5作为背景矫正,Channel 2荧光标记为Cy3作为检测值并进行数据预处理后获取表达矩阵,通过提供的平台文件将基因探针注释为基因官方名。
1.2.2 免疫细胞的评估 CIBERSORT是一种基于去卷积的工具,它使用支持向量回归方法来分析基因表达数据,以推断混合细胞类型样本中每种细胞类型的比例。该工具基于标准化的基因表达数据,能够评估22种类型免疫细胞浸润的比例。利用CIBERSORT 算法评估浸润免疫细胞的类型及丰度,选择 CIBERSORT中P≤0.05的结果进行下一步分析。
1.2.3 基因集富集分析验证炎症相关通路 使用基因集富集分析GSEA揭示AS合并CD组与AS组之间的基因集在INTERFERON_GAMMA_RESPONSE、INFLAMMATORY_RESPONSE、TNFA_SIGNALING_VIA_NFKB等的AS炎症相关的基因数据集中富集情况。
1.3 单细胞数据分析流程
1.3.1 使用Seurat对单细胞数据进行质控预处理 通过read10X加载GEO数据库下载的基因表达数据,创建Seurat对象。每个单细胞中检测到的不同基因的数量设定>200且<4 000,单细胞中所有基因的表达量之和设定为<10 000以选择非零表达基因的细胞,并对线粒体基因比例>10%的细胞进行去除,以获得可靠稳健的分析结果。随后对全部的数据表达量进行NormalizeData标准化、ScaleData归一化。使用FindIntegrationAnchors进行多个样本整合,并去除干扰因素。
1.3.2 细胞降维以及聚类 Findmarkers 方法用于计算每个样本中最显著的2 000个高度可变基因,将其视为关键基因,以便在后续的主成分分析(principal component analysis,PCA)中进行降维处理。在此过程中,主成分的数量设定为30个,同时为每个测试数据集生成弯头图。根据弯头图的结果,综合判断采用前20个主成分对细胞进行分类和聚类预测。为了实现单细胞聚类的二维平面可视化,采用了 t-SNE 和 UMAP降维算法直观地展示细胞聚类的结果。
1.3.3 使用参考标记基因进行重新聚类并细胞类型注释 使用singleR注释工具的免疫细胞参考数据集MonacoImmuneData进行初步的细胞亚群分类,并参照Cellmarker数据库中不同细胞类型的标志性基因,分析其在聚类结果的表达来进行手动细胞类型注释。
1.3.4 差异基因计算 通过应用 Seurat 软件包中的FindAllMarkers函数,计算各种细胞类型之间的差异表达基因(logfc.threshold=0.25, min.pct=0.1)。
1.3.5 单细胞基因集打分 单细胞基因集打分(single-cell gene set scoring)是一种专门针对单细胞转录组测序数据设计的分析方法,旨在量化特定基因集在单细胞层面上的表达水平或活性。这一策略利用一组预先确定的基因集,与特定的生物过程、信号传导途径或细胞功能紧密相关,进而对单细胞数据进行评估。借助单细胞基因集打分,能够在单细胞分辨率上深入探讨各种细胞亚群之间在功能上的差异,揭示细胞状态的动态演变以及在疾病进展过程中所发挥的分子机制,有助于解析细胞间的异质性以及病理生理过程。本研究使用irGSEA(integrated rank-based gene set enrichment analysis)整合性方法对标记好细胞类型的亚群利用基于单个样本的基因表达排名的基因集分析方法 “AUCell”“UCell”“singscore”“ssgsea”四种算法进行基因集打分,从而在降低批次效应影响的同时,计算每个细胞在基因集上的表达水平、活性评分,更为有效地挖掘稳定可靠的基因集。随后综合全部算法的结果并进行可视化分析,揭示细胞之间在功能水平上的差异和相关性。
1.3.6 炎症信号通路相关基因表达情况 从分子特征数据库(Molecular Signatures Database,MSigDB)中获取相关炎症信号通路的gmt文件制作炎症信号通路相关基因表格。使用FindMarkers函数对单细胞数据集的AS合并CD组以及AS不合并CD组进行差异基因分析获取差异基因列表。对炎症信号通路相关基因表格以及差异基因列表进行合并查看相关炎症信号通路中主要基因的表达差异。
2 结果
2.1 基本情况
2.1.1 芯片数据分组 在分析中,首先对患者进行筛选,选择具有临床表现的SpA样本,根据临床信息中组织学检查包括正常肠黏膜、急性炎症、慢性炎症以及CD特征性的病理特点如狭窄(stricturing)、溃疡(penetrating)分为脊柱关节炎不合并肠炎(SpA)、脊柱关节炎合并亚临床肠炎(SpA-subCD)、脊柱关节炎合并临床肠炎CD(SpA&CD),其中脊柱关节炎不合并肠炎根据是否累及中轴关节分为中轴型SpA(SpA-A)和外周型SpA(SpA-P)两种情况。见表2。
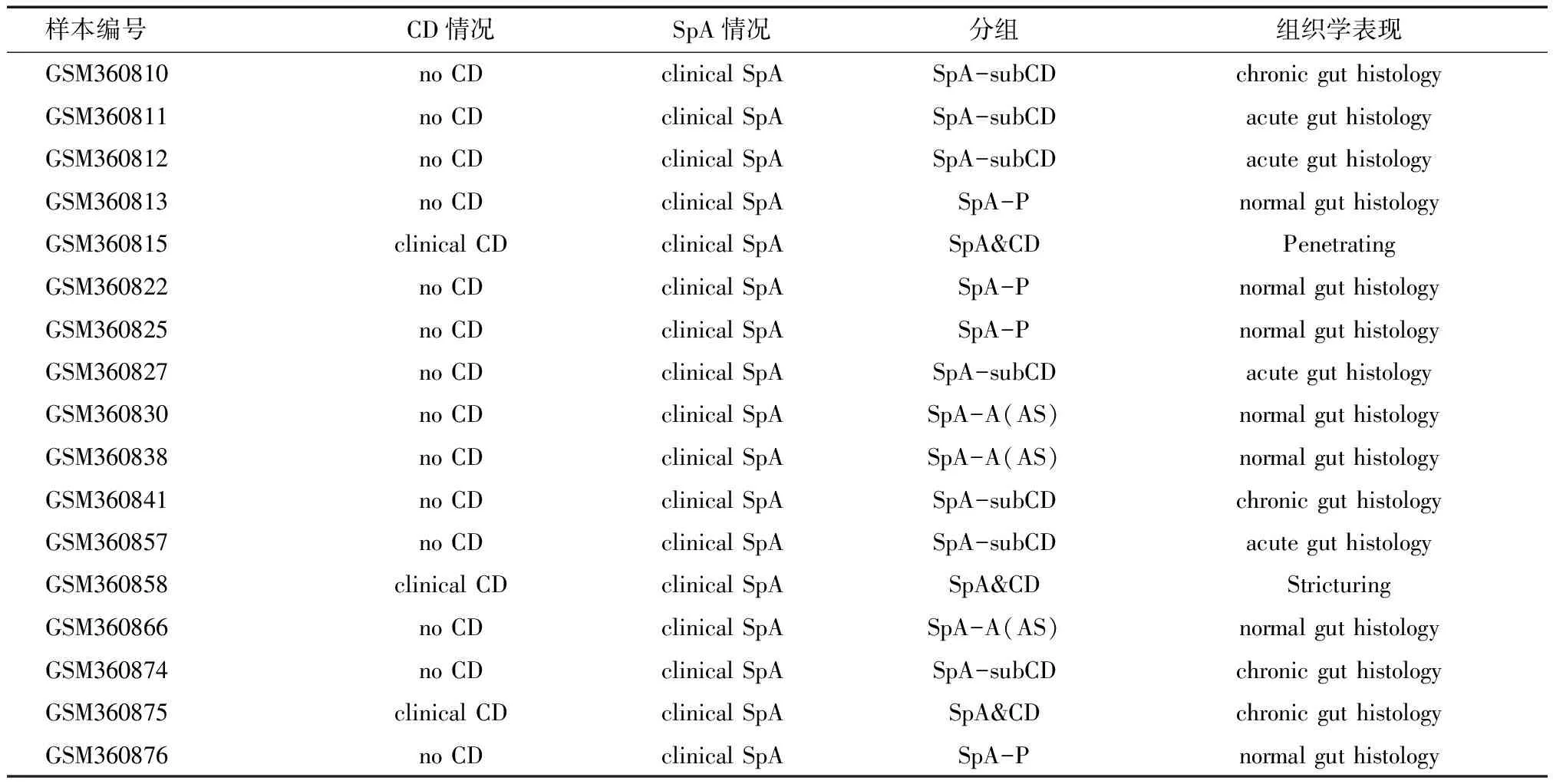
表2 纳入分析芯片数据基本信息表
2.1.2 单细胞测序数据分组情况 从GEO数据集GSE163314中选取SpA(该研究中全部为中轴型,即AS)有无合并CD的样本,包括外周血和肠黏膜的数据,共有4例患者,其中2例为SpA合并CD定义为SpA&CD,两例为SpA不合并CD定义为SpA,具体分组如表3所示。
分区装表计量法(District Meter Area,简称DMA),其工作原理是将检测管网分成多个区域,利用每个区段安装的水表计量区段用水量,在夜间无居民用水或用水量非常少时,这个时候的用水量可以作为该区段的漏水量。通过关闭区段内的阀门,对比用水量变化即可确定漏水管段。当漏水管段确定后再用听音法即可确定漏水具体位置。
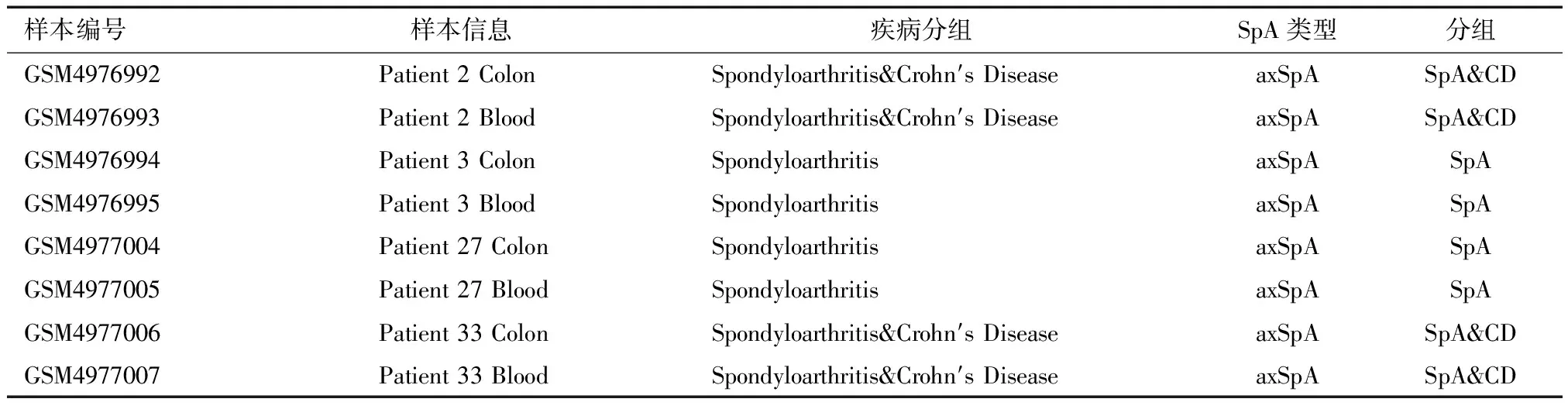
表3 纳入分析单细胞测序数据基本信息表
2.2 芯片数据分析 采用 CIBERSORT 反卷积法进行计算,输出每个样本中不同免疫细胞亚群的百分比,图1展示了22种免疫细胞在各个样本中的含量丰度。以P<0.05为筛选条件对芯片进行筛选,CD8+T淋巴细胞、未活化的记忆 CD4+T细胞、静息状态下CD4+T记忆细胞含量在AS肠黏膜组织中不同程度增加。见图2。
通过箱线图(图3)直观地比较SpA患者发生亚临床肠炎、临床肠炎的肠组织免疫细胞亚群的差异。中轴型及外周型SpA患者CD4+、CD8+T淋巴亚群在未发生肠炎时,CD4+、CD8+T淋巴亚群占比较低。但当发生肠炎时,随着病情的进展,未活化的记忆 CD4+T细胞、静息状态下CD4+T记忆细胞、CD8+T淋巴细胞含量逐渐增加。在巨噬细胞、单核细胞、B淋巴细胞、NK细胞亚群中无明显差异变化。
使用GSEA算法验证在AS合并CD的患者以及AS肠黏膜芯片基因表达矩阵中INTERFERON_GAMMA_RESPONSE、INFLAMMATORY_RESPONSE、TNFA_SIGNALING_VIA_NFKB这三个与炎症相关的信号通路的富集情况(图4)发现, INTERFERON_GAMMA_RESPONSE、INFLAMMATORY_RESPONSE、TNFA_SIGNALING_VIA_NFKB均能在GSEA分析中明显富集(矫正后P<0.05),而IL17-PATHWAY则无明显富集(矫正后P>0.05)。
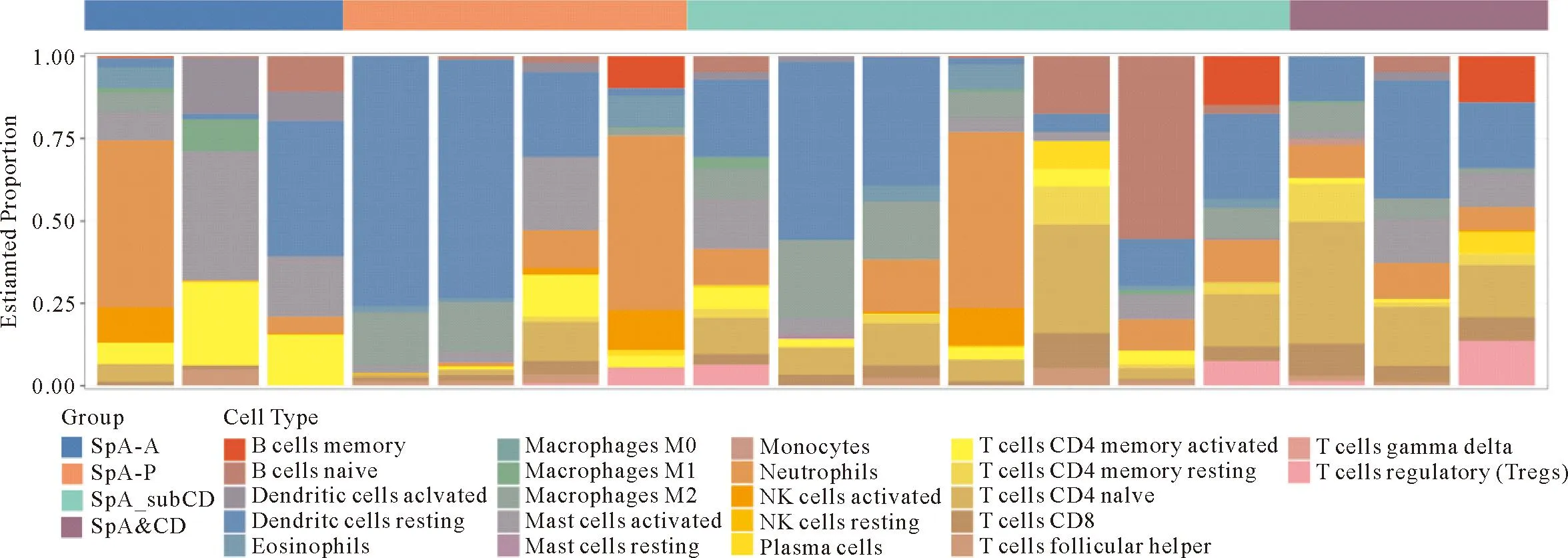
图1 22种免疫细胞在SpA合并肠炎的芯片数据中的浸润丰度情况
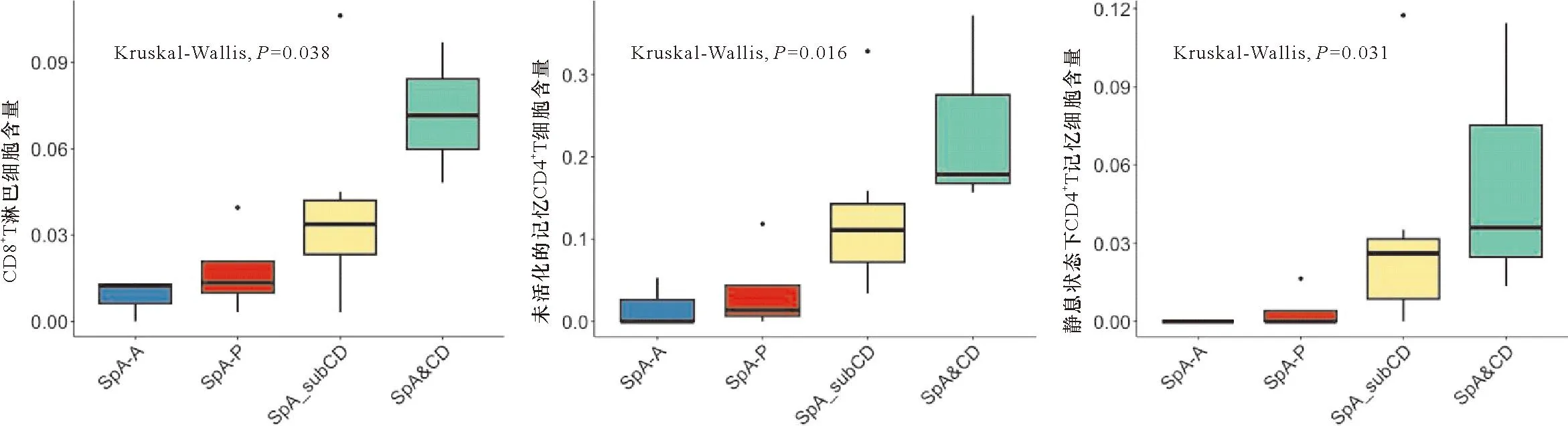
图2 AS肠黏膜组织芯片中T淋巴细胞异常浸润免疫细胞的类型

图3 箱线图比较不同类型SpA发生肠炎的肠黏膜细胞浸润比例
2.3 单细胞测序数据分析 通过对单细胞测序数据质控,获得了外周血数据集有18 404个免疫细胞,肠黏膜有4 412个免疫细胞,共22 816个高质量免疫细胞的数据。通过对单细胞测序数据进行降维和聚类,得到可视化肠黏膜、外周血免疫细胞的 t-SNE聚类图和UMAP聚类图(图5、6),可见细胞总共分为若干Cluster细胞亚群,肠黏膜数据被分为7群细胞,而外周血数据被分为10群细胞。肠黏膜数据每一个Cluster的细胞数量分别为1453(0)、822(1)、643(2)、616(3)、416(4)、385(5)、75(6)。外周血数据每一个Cluster的细胞数量分别为3727(0)、3080(1)、2890(2)、2637(3)、1809(4)、1763(5)、934(6)、732(7)、675(8)、157(9)。
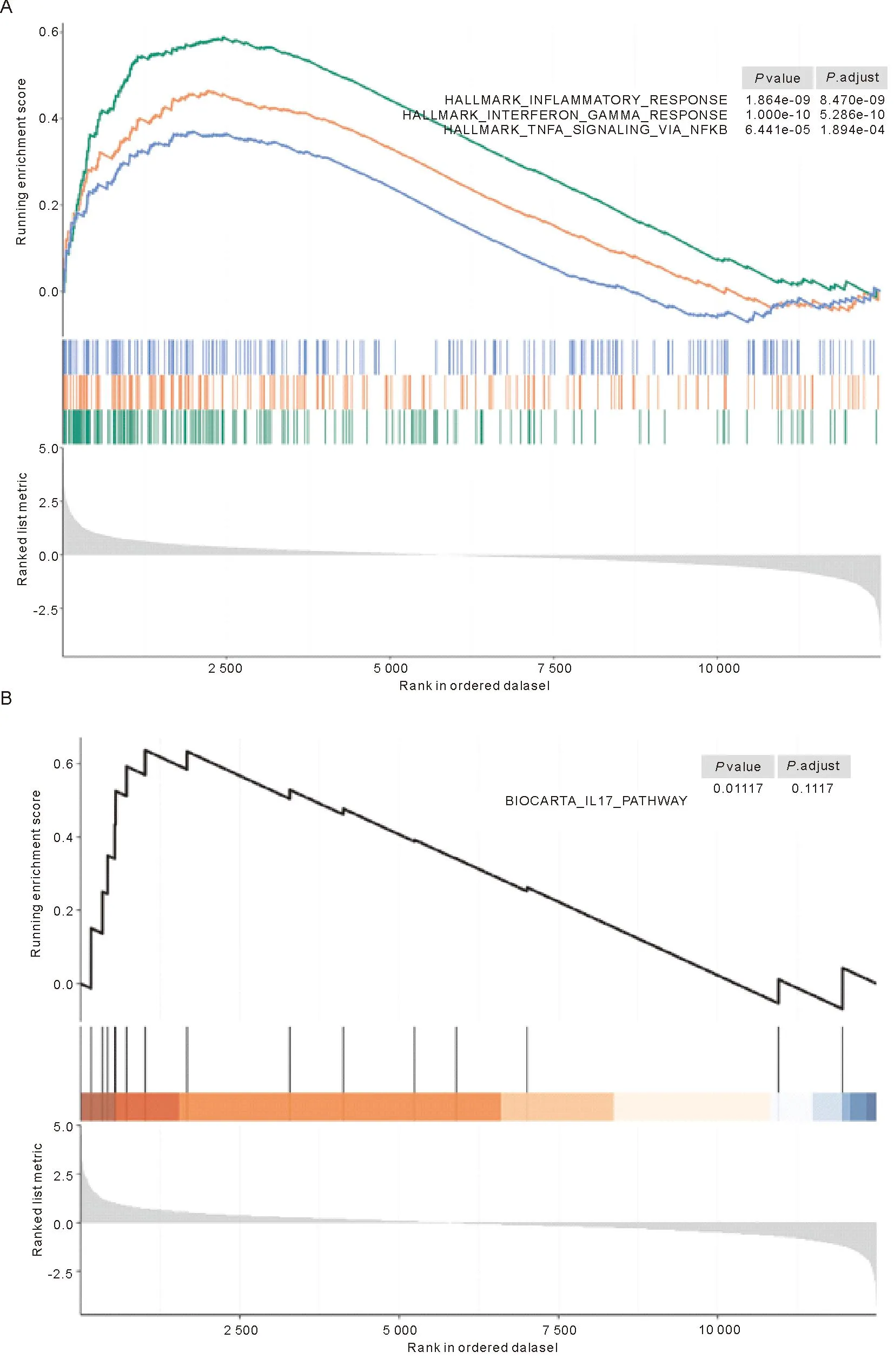
注:A-绿色:INTERFERON_GAMMA_RESPONSE;A-红色:INFLAMMATORY_RESPONSE;A-蓝色:TNFA_SIGNALING_VIA_NFKB;B-黑色:IL17-PATHWAY
使用SingleR中的MonacoImmuneData作为对比参考数据,结合淋巴细胞的特异性标记物在数据集中的表达情况(图7、8),肠黏膜的单细胞数据的Cluster1、Cluster5高表达CD3E、CD8A,鉴定为肠黏膜CD8+的T淋巴细胞亚群并进行提取标记用于后续单细胞基因集打分。同理,对比图5、6,外周血的单细胞数据的Cluster2、Cluster8同时高表达CD3E、CD8A,鉴定为外周血CD8+的T淋巴细胞亚群并进行提取标记用于后续单细胞基因集打分。

注:A:使用t-SNE降维后的细胞分布图;B:根据样品分组的细胞分布图;C:使用UMAP降维后的细胞分布图;D:根据样品分组的细胞分布图。图例中,0~6表示聚类的7个亚群,C表示肠黏膜样本
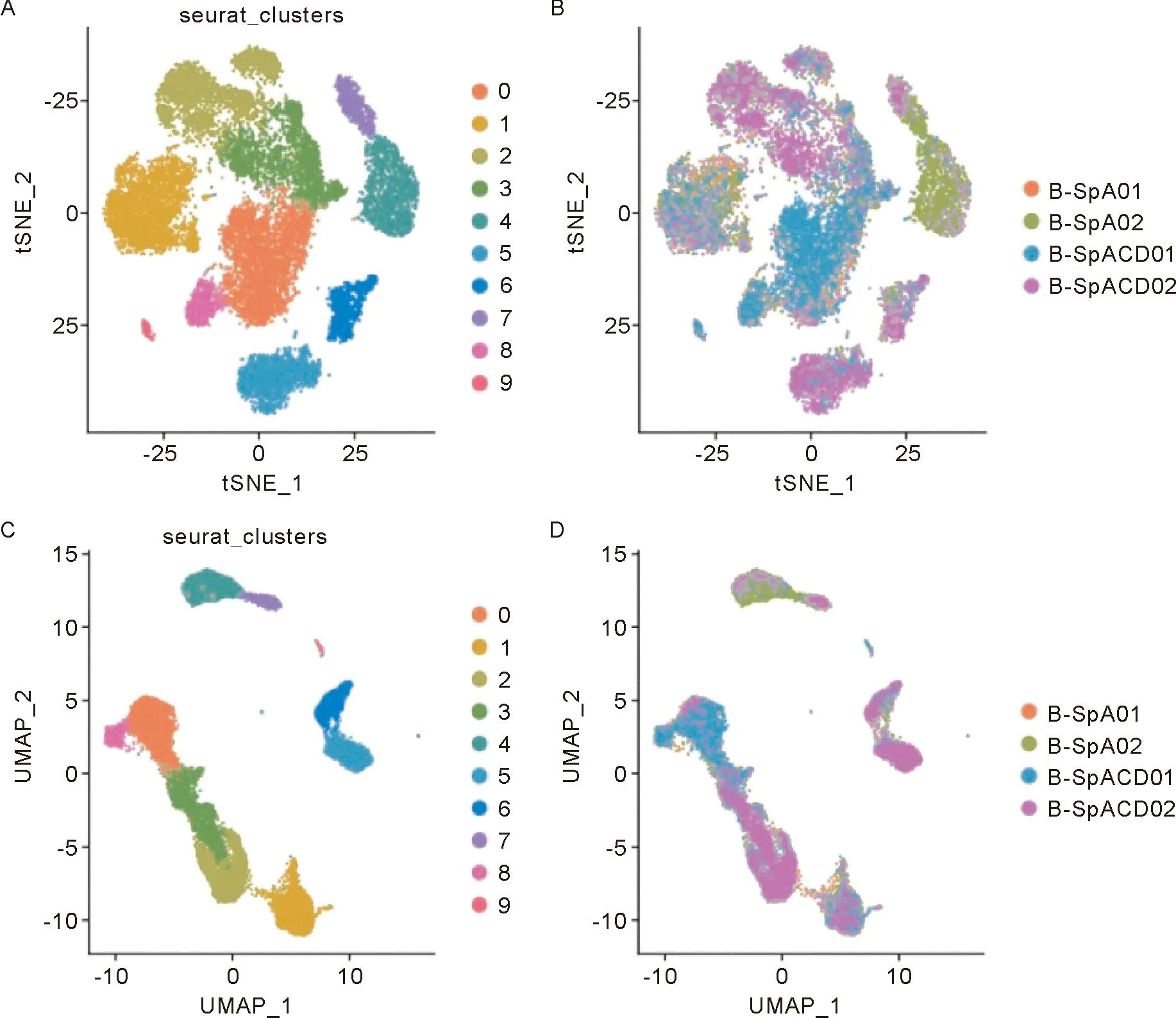
注:A:使用t-SNE降维后的细胞分布图; B:根据样品分组的细胞分布图;C:使用UMAP降维后的细胞分布图;D:根据样品分组的细胞分布图。图例中,0~9表示聚类的10个亚群,B表示外周血样本
对提取CD8+T细胞的外周血、肠黏膜不同疾病组(SpA、SpA&CD)中进行CD8+T细胞的占比情况分析。发现在外周血中CD8+T细胞中SpA&CD的平均占比为21%,高于SpA平均占比18%;而在肠黏膜中CD8+T细胞SpA的平均占比为30%,高于SpA&CD平均占比23%,鉴于该数据的肠黏膜提取免疫细胞获取的细胞数较外周血样本明显较少,仍有待更多的数据进行验证:肠黏膜SpA01 为359个免疫细胞,SpA02 为2 964个免疫细胞,SpA&CD01为846个免疫细胞,SpA&CD02为1 482个免疫细胞;外周血SpA01 为6 098个免疫细胞,SpA02 为6 041个免疫细胞,SpA&CD01为4 988个免疫细胞,SpA&CD02为3 974个免疫细胞。
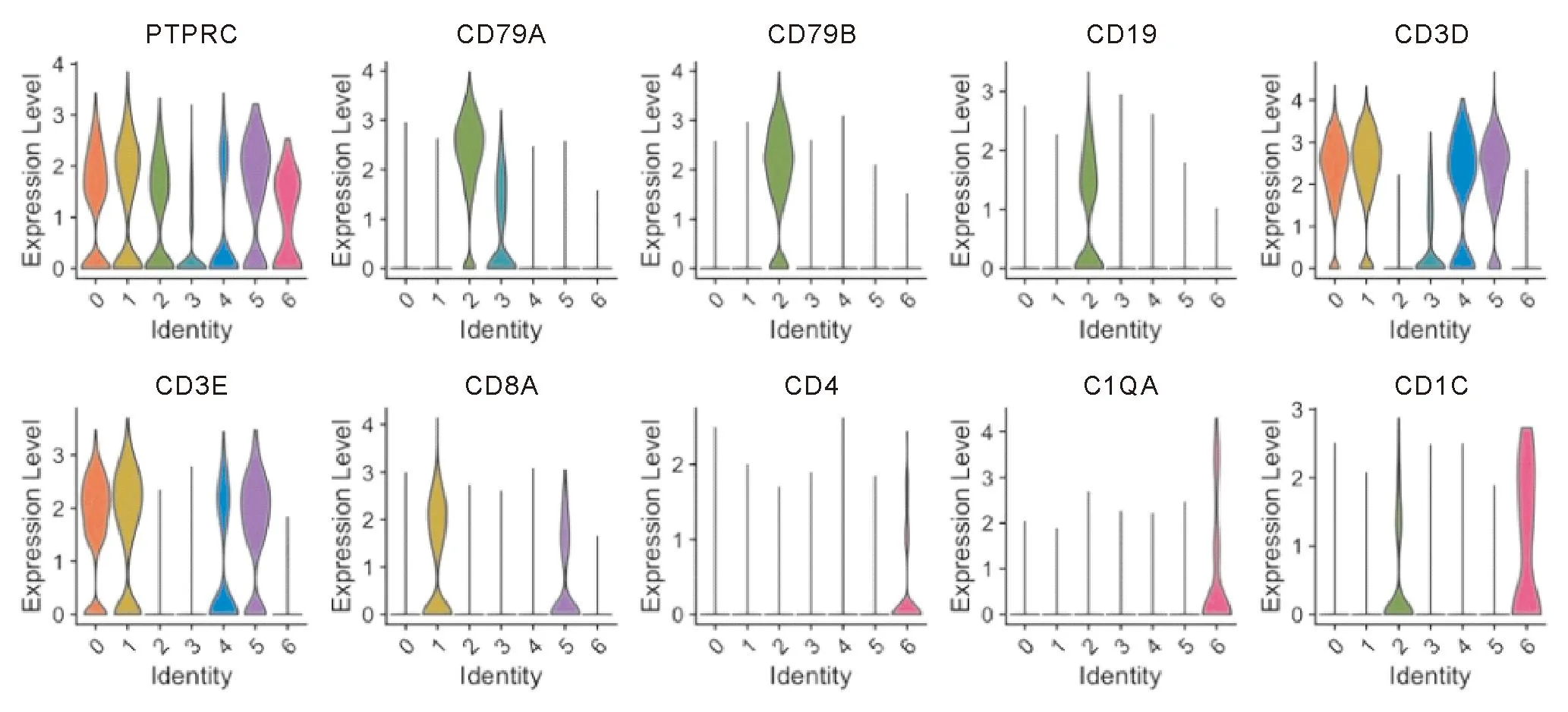
图7 小提琴图展示常见免疫细胞特征表达标记物在肠黏膜样本中不同Cluster中的表达情况
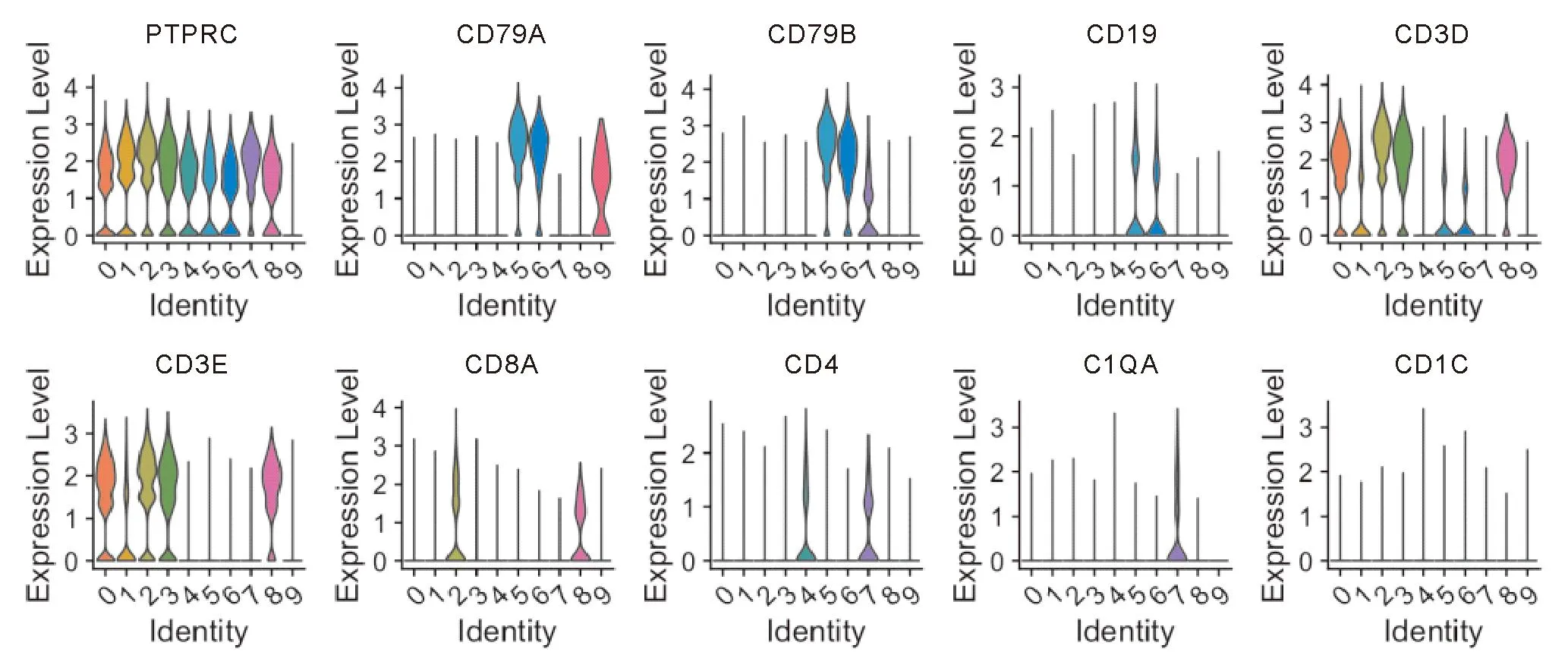
图8 小提琴图展示常见免疫细胞特征表达标记物在外周血样本中不同Cluster中的表达情况
对提取的肠黏膜和外周血的CD8+T淋巴细胞进行单细胞基因集富集评分(图9),综合四种算法的结果,发现TNF-α信号通路、IFN-γ信号通路、以及炎症反应信号通路在AS合并CD的患者中较AS无 CD的患者的通路活性均有不同程度的升高,其中在肠黏膜的分布更加明显。然而,IL-17信号通路在肠黏膜中无明显升高,而在外周血中则与TNF-α信号通路、IFN-γ信号通路类似具有升高的趋势,提示TNF-α信号通路、IFN-γ信号通路、IL-17A信号通路在外周血CD8+T细胞中活跃。而在肠黏膜中,主要是TNF-α信号通路、IFN-γ信号通路可能参与了AS合并肠炎的发生、发展进程。
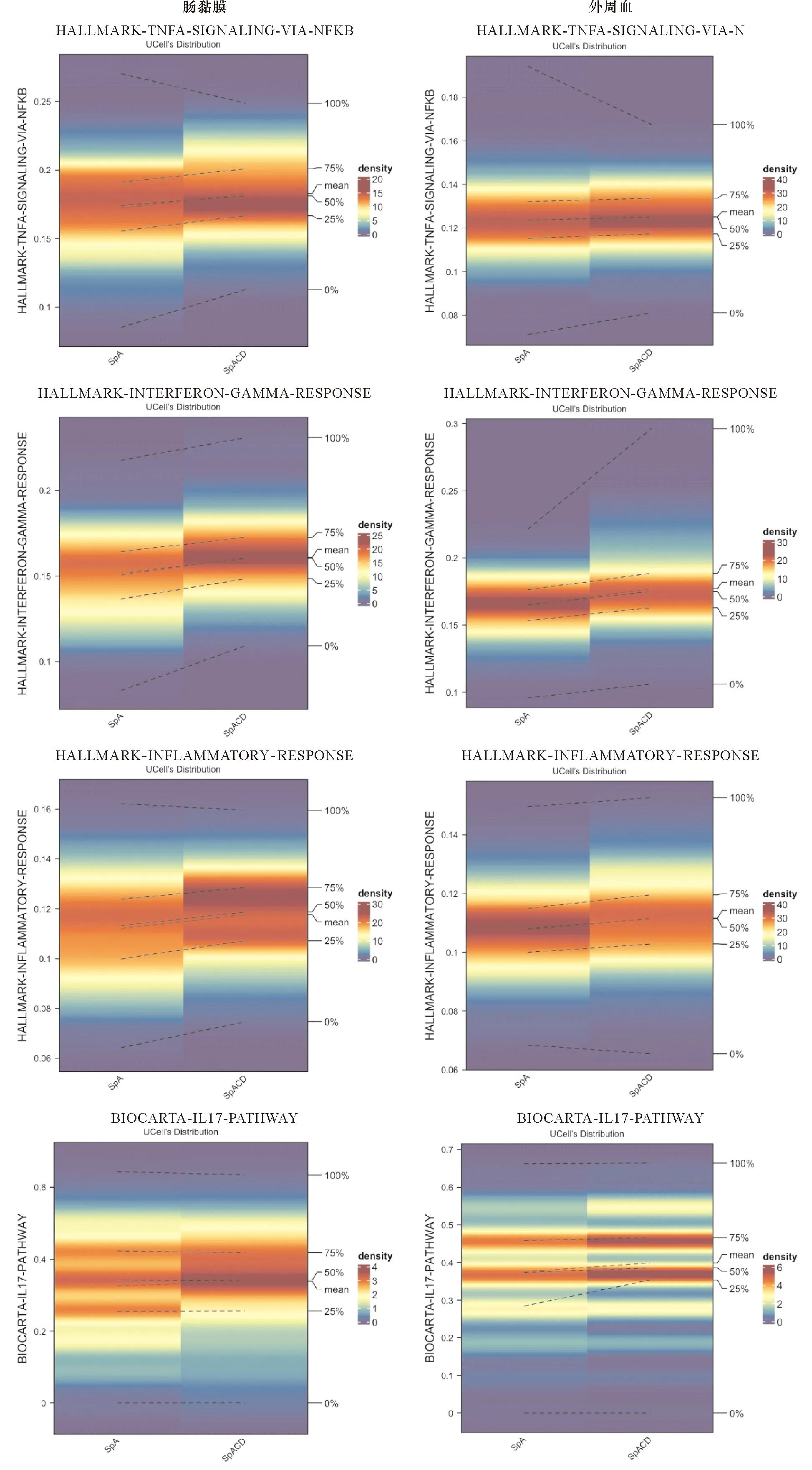
注:纵坐标表示富集的分数,图例中不同的颜色表示P值,富集程度越高颜色越红
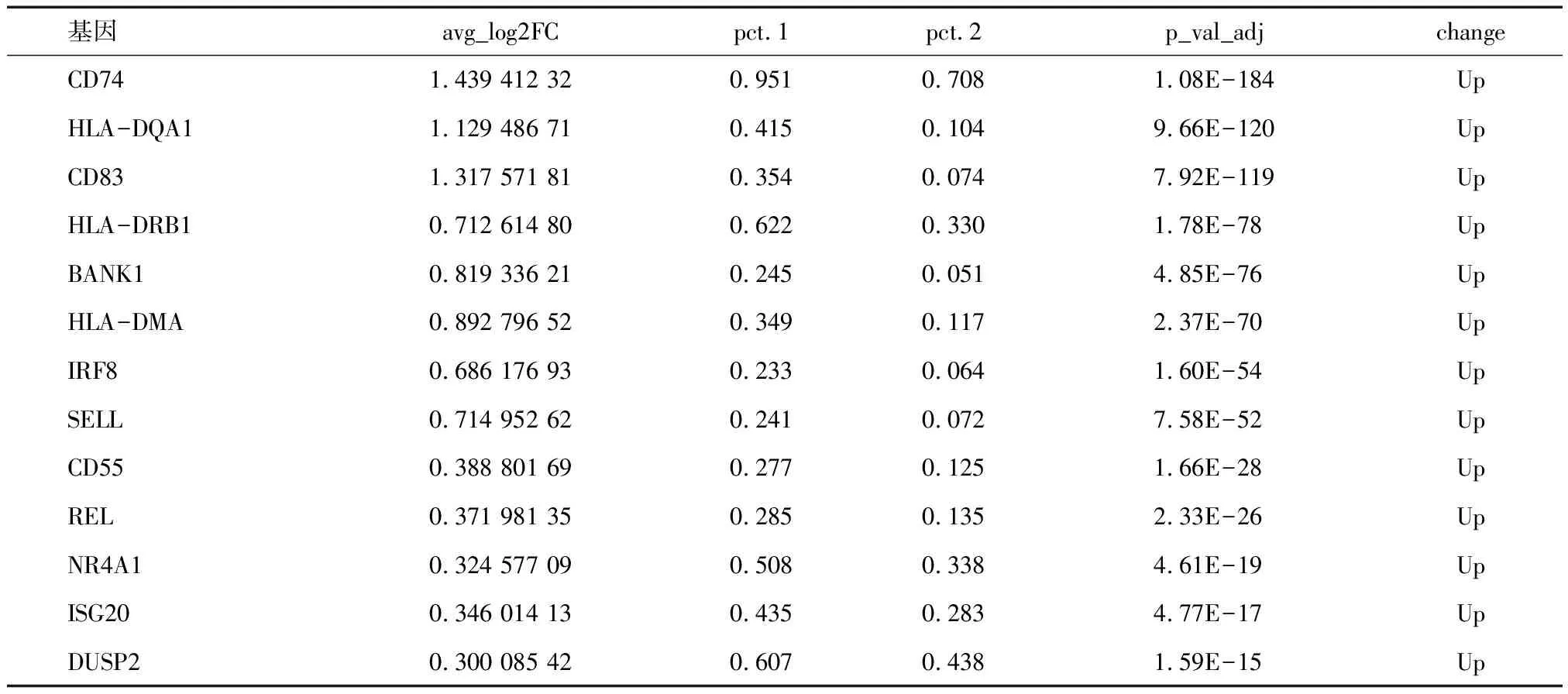
表4 肠黏膜单细胞数据集中相关炎症信号通路中差异基因
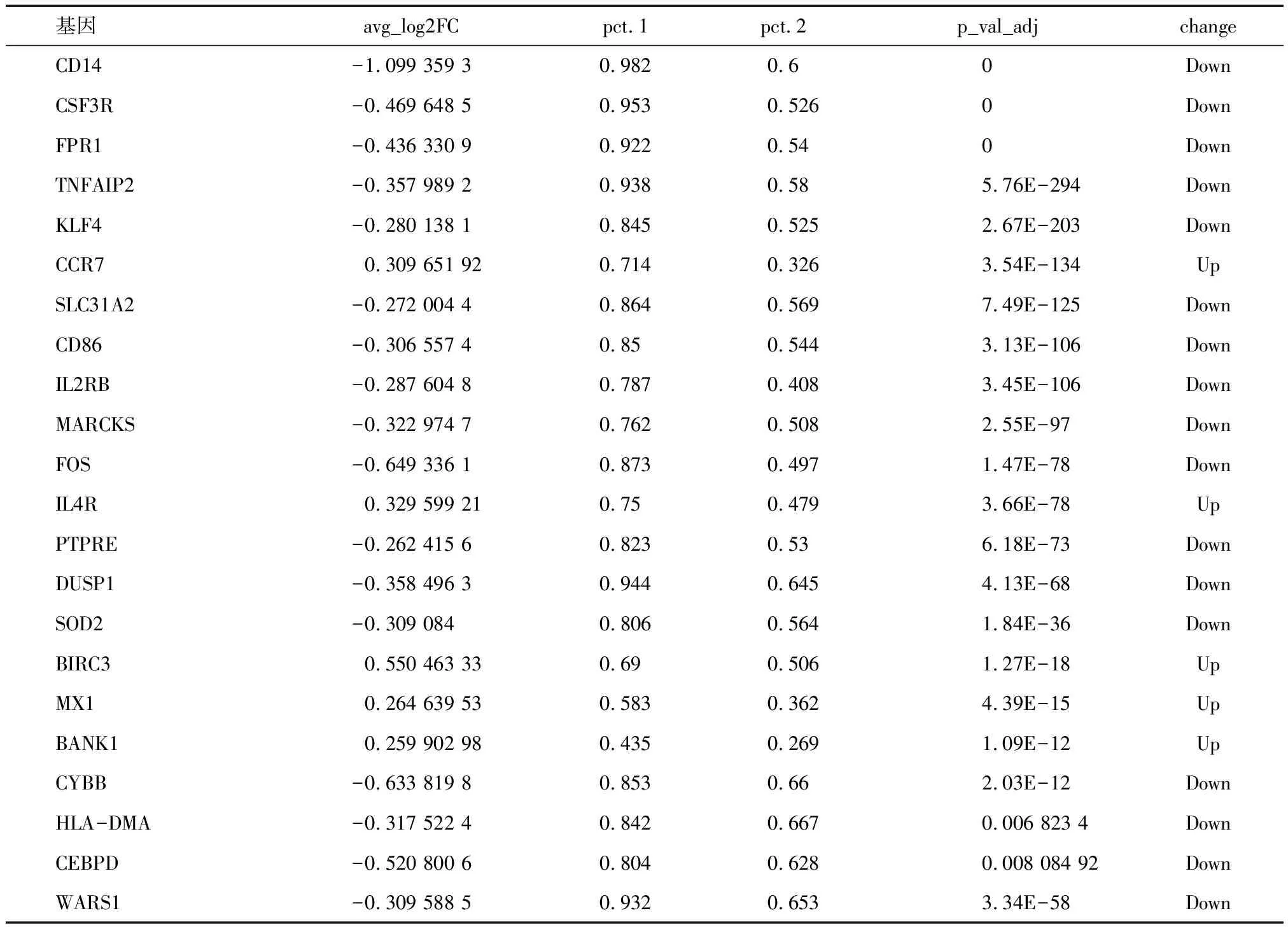
表5 外周血单细胞数据集中相关炎症信号通路中差异基因
3 讨论
AS作为一种常见的自身免疫病,其发病机制目前尚不明确。其中,多种免疫细胞的功能紊乱和数量比例异常是AS发生关节外并发症如肠炎的发病重要因素[19-20]。既往研究大多集中在骶髂关节的关节炎症部位,且主要基于RNA测序或基因芯片技术,研究AS关节组织整体基因表达模式改变,极少对关节外并发症之一的肠炎的肠组织转录组进行阐述。在细胞亚群研究方面,既往研究多关注于AS外周血免疫细胞比例及功能,而对肠黏膜中免疫细胞的研究较少。Yang等[21]发现,与健康对照组相比,活动期AS的免疫细胞的中央记忆和幼稚CD4+T细胞、CD8+T细胞比例增加,并且给予TNF-α拮抗剂治疗后,可以负调节CD4+T细胞比例,但对CD8+T细胞无明显改善。Jiang等[22]研究发现AS患者的免疫细胞外周血分布中,在CD4+T亚群中,幼稚CD4+T细胞、中枢记忆CD4+T淋巴细胞和衰竭CD4+T细胞核的比例显著增加,但终末分化CD4+T和效应记忆CD4+T细胞的水平在AS中显著降低;AS患者的幼稚CD8+T细胞、中枢记忆性CD8+T淋巴细胞、效应记忆性CD8+T细胞和耗尽的CD8+T细胞水平升高,但相对而言,终末分化的CD8+T细胞水平降低。Hanson等[23]对外周血的CD4+T细胞、CD8+T细胞进行T细胞受体免疫测序,发现AS患者相对于健康对照组的CD4+T细胞、CD8+T细胞具有更高的TCR多样性。Komech等[24]具有特征性T细胞受体β链基序的CD8+T细胞在AS患者的血液和滑膜液中存在,并在滑膜液中扩增。Qaiyum等[18]也发现成熟的CD8+T细胞在AS滑膜液中富集,具有表达整合素相关基因β7、CD103、CD29、CD49a。Gracey等[16]研究AS患者中CD8+T细胞的毒性特征发现,在AS患者的外周血中相对于健康对照组,CD8+T细胞比例下降却在关节滑膜液中比例增加,在刺激情况下会释放更多的细胞毒素,包括Perforin、Granzyme B和Granulysin,对目标细胞的杀伤作用更强。这些发现提示CD8+T细胞亚群可能在AS的病理过程中发挥关键作用。Xu等[25]通过单细胞RNA-seq和ATAC-seq分析发现参与AS进展的致病基因NF-κB起源于CD8+T细胞,CD8+T细胞中的NF-κB、FOS、JUN和JUNB在AS组中存在差异。
在GEO公共数据的GSE163314原研究中,作者研究了外周血中表达颗粒酶B的成熟T细胞在识别AS合并CD、AS和CD之间的差异性。研究中的颗粒酶B是一种由NK细胞和CD8+T细胞释放的具有毒性作用的分子,在炎症和自身免疫性疾病中发挥着关键作用。通过对患者血液样本进行分析,作者发现AS合并CD患者中循环颗粒酶B阳性的CD4+T细胞、CD8+T细胞的数量明显高于AS和CD患者。此外,与研究中的健康对照组相比,作者发现所有疾病组中CD4和CD8谱系的PD-1+T细胞都有增加的趋势,有一部分个体的终末耗竭T细胞增加,提出CD4+和CD8+细胞毒性T细胞都可能参与AS合并 CD的发病机制。这些发现提示循环颗粒酶B+T细胞水平可作为一种潜在的生物标志物,有助于区别AS合并CD与 AS和 CD。该研究还探索了IFN-γ信号通路在CD8+T细胞中富集情况,但尚未对与AS发生、发展密切相关的TNF-α信号通路、IL-17信号通路的活性进行研究。
为了验证CD8+T细胞数量比例在监测、诊断AS合并肠炎的作用。本研究选取了具有临床信息的肠黏膜芯片数据,使用了CIBERSORT的反卷积算法进行肠黏膜免疫细胞的“数字流式”分析。通过免疫浸润中的细胞比例对比分析发现CD8+T淋巴细胞在肠黏膜中浸润是 SpA合并CD最显著特征。并且在肠炎的炎症程度方面与免疫浸润的程度相关。我们从初步的比例分析发现了SpA合并CD 多种免疫细胞类型的改变,包括CD4+记忆T淋巴细胞的亚群、CD8+T淋巴细胞亚群。在正常的机体内,记忆性T细胞对抵抗病原微生物再次入侵、发生高效迅速的免疫应答具有重要作用,如记忆CD4+T淋巴细胞在体内呈现缓慢逐步的减少,而CD8+记忆T淋巴细胞则能在体内保持稳定的数目。推测在AS合并肠炎中,CD4+的记忆T细胞可能会受到肠道菌群紊乱、失衡,组织内慢性炎症的影响而出现数量的异常[26]。而在激活的CD4+记忆T细胞亚群的数量则呈现缓慢减少的趋势。而AS患者组织中如肠黏膜、葡萄膜等部位的CD8+T细胞的浸润分布及激活炎症信号通路活性的目前研究较少。在IBD的研究中发现,结肠固有层含有大量组织驻留的CD8+T细胞,这些细胞可能导致IBD的组织损伤[12]。Rosati等[27]发现一类新型非常规T细胞亚群在CD患者的肠道组织中显著增加,表现出与CD8+T细胞的亚群有关的独特转录特征,提示这些细胞可能在CD的发病机制中发挥作用。
随后,本研究使用芯片数据在AS合并CD以及AS之间进行GSEA分析发现TNF-α信号通路、IFN-γ信号通路相关通路在AS合并CD的肠黏膜组织中均明显富集,IL-17A信号通路则无明显富集。单细胞测序数据的基因集活性评分发现CD8+T细胞的TNF-α信号通路、IFN-γ信号通路、IL-17A信号通路的通路活性在AS合并CD的患者中较AS无合并 CD的患者在外周血中均有不同程度的升高。而在肠黏膜中IL-17A信号通路激活并不明显。单细胞测序数据的基因集活性评分验证了芯片数据中GSEA评分的结果。 TNF-α信号通路、IFN-γ信号通路参与了AS合并肠炎的发生、发展进程,而IL-17A作为肠黏膜屏障的保护性因子仅起到辅助作用。随后我们对炎症信号通路中主要基因进行差异分析,发现一些参与抗原结合呈递的人类白细胞抗原(HLA)如HLA-DQA1、HLA-DRB1、HLA-DMA等基因在肠黏膜中上调,提示肠黏膜中可能存在了抗原性物质如自身抗原导致T细胞和B细胞的免疫识别和活化;参与信号传导、转录调节和细胞因子产生的分子如CD74、CD83、IRF8、REL、NR4A1、DUSP2等基因在肠黏膜中上调,参与调节细胞因子、趋化因子与细胞功能。参与化学趋化性和细胞迁移的分子如SELL在肠黏膜中上调, CCR7基因在外周血中表达上调与白细胞的定向运动和组织定位有关。其中,BANK1在AS合并CD组较AS无合并CD组中肠黏膜与外周血免疫细胞中表达上调。BANK1是一种参与B细胞受体信号传导的蛋白质,影响B细胞的活化、分化、抗体产生和记忆细胞形成,调节自身免疫反应,研究发现BANK1的基因多态性与系统性红斑狼疮(SLE)[28]、类风湿关节炎(RA)[29]和干燥综合征(SS)[30-31]等疾病的遗传易感性有关。然而,有研究对BANK1的三个易感SNP包括rs10516487、rs17266594、rs3733197进行炎症性肠病的关联分析,但未观察到 BANK1基因具有显着关联[32]。但AS合并CD的发病机制与典型的CD之间目前认为不完全相同,仍需更多的研究对BANK1基因与AS合并CD的关系进行深入研究。
然而,本研究存在以下不足:(1)用于数据分析的AS合并肠炎的相关数据集数量及样本量较少;(2)没有收集临床样本对CD8+T细胞进行流式细胞术检测细胞亚群数量及功能验证。未来研究将会通过肠镜检查纳入AS合并肠炎和AS无肠炎的患者进行流式细胞检测T细胞分群,对CD8+T淋巴细胞进行分选后鉴定相关炎症通路的核心基因、蛋白的表达情况进行验证。
总的来说,CD8+T细胞增多作为判断AS合并CD的参考指标值得进一步研究,或许可用于评估AS患者肠道病变的情况。基因集活性打分分析显示在AS合并CD的患者中肠黏膜组织中TNF-α信号通路、IFN-γ信号通路活性升高,但在IL-17信号通路激活并不明显。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:罗锡庆负责完成数据分析、论文撰写;古洁若为项目构思、指导论文修改。

