卵巢储备功能减退和卵巢早衰模型小鼠的差异蛋白质组学研究
李晓荣, 仲佳雯, 秦岭, 高婷, 罗玉雪, 马小红△
1宁夏医科大学总医院生殖医学中心(宁夏银川 750004); 2宁夏医科大学中医学院(宁夏银川 750004); 3宁夏医科大学银川市中医医院(750003)
卵巢储备功能减退(decrease ovarian reserve, DOR)以及卵巢早衰(premature ovarian failure,POF)都属于卵巢功能下降。DOR是指卵巢内卵母细胞数量减少和(或)质量下降,同时伴有抗苗勒管激素水平降低、窦卵泡数减少、FSH水平升高[1],患者生育能力受损,严重者可进一步发展为卵巢早衰。卵巢早衰是是指40岁之前的女性,由于遗传、医源性、自身免疫、环境等因素,卵泡发育停止或过早卵巢功能不全,导致卵巢功能丧失[2]。根据调查显示,POF作为一种常见的妇科疾病,在我国的发病率为1%~3%[3],而且每年都在增加。POF患者会出现不孕、更年期综合症、骨质疏松、心脑血管、神经等系统疾病和增加的死亡风险[4],严重影响女性的身心健康。如今人口老龄化趋势日渐严重,出生率日渐降低,国家大力推广“三胎政策”提高生育需求,但是女性生殖能力较前却有所下降且呈现年轻化趋势。因此,生育需求与生育能力的矛盾日渐突出。DOR和POF是引起生育能力降低的重要因素,二者病因比较复杂而且发病机制尚不清楚。蛋白质的改变是生命功能障碍的直接因素。因此,蛋白质是一系列生理病理发生的最终执行者,那么对相关疾病进行蛋白质层面的研究,有助于揭示其发病的机制并为治疗提供相应的分子靶点。目前蛋白组学已经广泛应用于各个学科中,2019年6—10月我们从蛋白质组学方面来找到与疾病相关的关键因素,进一步研究其病理机制,揭示关键因素的调控机制,全面了解疾病的发生和发展。
1 材料与方法
1.1 主要试剂和仪器 环磷酰胺、碘代乙酰胺、二硫苏糖醇、尿素、三乙基碳酸氢铵(Sigma);白消安(APExBIO);蛋白酶抑制剂(Calbiochem);胰酶(Promega);乙腈、超纯水(Fisher Chemical);三氟乙酸(Sigma-Aldrich);甲酸(Fluka);BCA试剂盒(碧云天);TMT标记试剂盒(Thermo);双目正置荧光显微镜(德国徕卡)。
1.2 实验动物 选取SPF级6周龄动情周期正常的C57BL/6雌性小鼠36 只,体重18~25 g,由北京维通利华实验动物有限公司提供(实验动物许可证号:SCXK(京)2016-0011)。在宁夏医科大学实验动物中心动物屏障环境内饲养。本实验经宁夏医科大学实验动物中心实验动物福利伦理审查委员会审查同意伦理编号为(IACUC-NYLAC-2022-038)。
1.3 模型构建 所有小鼠均经过一周的适应性饲养,然后通过阴道涂片法观察其动情周期,选取具有正常动情周期的36只雌性小鼠按随机数字表法分为对照组12只(A组)、DOR组12 只(D组)、POF组12只(B1组)。POF组采用一次性腹腔注射120 mg/kg的环磷酰胺+12 mg/kg的白消安,DOR组一次性腹腔注射60 mg/kg的环磷酰胺+6 mg/kg白消安,对照组给予同等剂量的生理盐水,给药后持续观察动情周期7 d,以动情周期紊乱为造模成功。阴道涂片方法参考文献[5]。小鼠的动情周期包括动情前期、动情期、动情后期和间期,正常周期为4、5 d,各期判断标准:动情前期:大量椭圆形的有核上皮细胞;动情期:大量片状无核角化上皮细胞;动情后期:可见白细胞、有核上皮细胞和无核角化上皮细胞;动情间期:出现大量白细胞,体积相对较小。具体见图1。

图1 光学显微镜下小鼠动情周期变化(×20)
1.4 蛋白质组学分析
1.4.1 蛋白提取、酶解 从-80℃中取样,将组织样本置于预冷的液氮研钵中,加入液氮充分研磨至粉末状,加入四倍体积的粉状裂解缓冲液超声波裂解。4℃,12 000g离心10 min,将上清液转移至新离心管中,最后使用BCA试剂盒测定蛋白含量。将二硫苏糖醇加入蛋白质溶剂中,调节至5 mmol/L的最终含量,并在56℃下还原30 min,然后加入碘乙酰胺,调节至11 mmol/L的最终含量,并在室温下避光孵育15 min,最后,将样品种的尿素含量稀释至2 mol/L以下。将胰蛋白酶与蛋白质按1∶50的配比混匀,在37℃的温度下酶解一晚。接着,将胰蛋白酶与蛋白质按1∶100的配比混匀,继续酶解4 h。
1.4.2 TMT标记、HPLC分级 经StrataXC18(Phenomenex)脱盐后,将胰蛋白酶溶解的肽放在0.5 mol/L TEAB中,并根据TMT操作说明进行标记。采用Agilent300ExtendC18色谱柱,其粒径为5 μm,内径为4.6 mm,长度为250 mm,通过pH反向HPLC技术对肽段进行分级。
1.4.3 液相色谱-质谱联用分析 使用EASY-nLC1000超高性能液相系统分离肽。肽段经超高性能液相系统分离后注入NSI离子源,电离后进入QExactivePlus质谱仪进行分析。使用高分辨率Orbitrap检测和分析肽母离子及其二级碎片。使用DDA程序进行数据采集。
1.4.4 数据库搜索及生物信息学分析 使用Maxquant(v1.5.2.8)获取二级质谱数据。数据库系统为Mouse_swissprot _10090,并使用反库运算来减少随意配对导致的假阳性率。此外,还需要在数据库系统中增加常见污染文库,以减少蛋白质鉴别数据受到的干扰。利用费歇尔精确双端检验方式,我们可以对差异表达基因的GO和KEGG通路进行富集研究,如果P值低于0.05,则表明该蛋白表达差异是显著的。
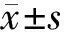
2 结果
2.1 模型评价 造模后DOR组和POF组小鼠与对照组相比,精神相对萎靡,食欲减退,皮毛光泽度下降,体质量减轻,且POF组体质量下降较DOR组明显;DOR组和POF组小鼠的动动情周期规律;显微镜下观察到DOR组小鼠卵巢组织中较多闭锁卵泡,黄体较多,情周期不规律,动情间期和后期持续,很少有动情前期和动情期。对照组小鼠原始卵泡和各级卵泡均少见,POF组中可见闭锁卵泡较DOR组更多,对照组中见少量闭锁卵泡,黄体存在,可见原始卵泡,次级卵泡和成熟卵泡数量较DOR组和POF组多。见图2。
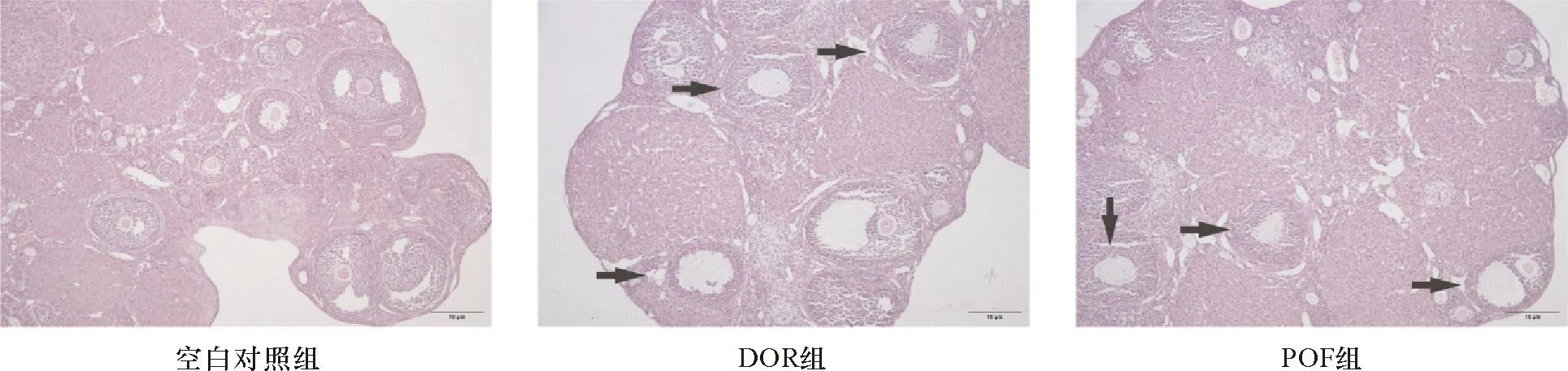
注:箭头所指为闭锁卵泡
DOR组和POF组小鼠血清中E2和AMH水平低于对照组(P<0.05),FSH水平高于对照组(P<0.05);POF组小鼠血清中E2和AMH水平低于DOR组(P<0.05),FSH水平高于DOR组,但差异无统计学意义(P>0.05),见表1。

表1 小鼠血清激素水平比较(n=7)
2.2 差异表达蛋白质谱分析 在本实验中通过质谱分析共得到779 205.0张二级谱图。利用蛋白质理论数据检索质谱二次谱后,有效谱数为225 650,共鉴定出7 485.0个蛋白,其中6 621.0个蛋白包含定量信息。以1.2倍为差异表达变化阈值,以t检验P值<0.05为显著性阈值,发现DOR组与对照组相比有149个显著差异的蛋白,其中77个蛋白表达上调,72个蛋白质下调;与对照组相比,POF组发现了148个显著差异的蛋白质,其中60个蛋白质上调,88个蛋白质下调。将这些显著差异蛋白制成火山图如图3,部分差异蛋白信息如表2、3,二者重叠的表达差异蛋白有23个:D2HGDH、PHF24、BCR、ATP9A、TPD52、PODXL、TRIM24、MATN2、BICD1、GPX7、PDXK、MOCS2、RSRP1、H2AFY、HIST1H1E、RPL18、PIP5K1A、CD9、EPN3、ENO2、CTSA、HIST1H1C、PON1。
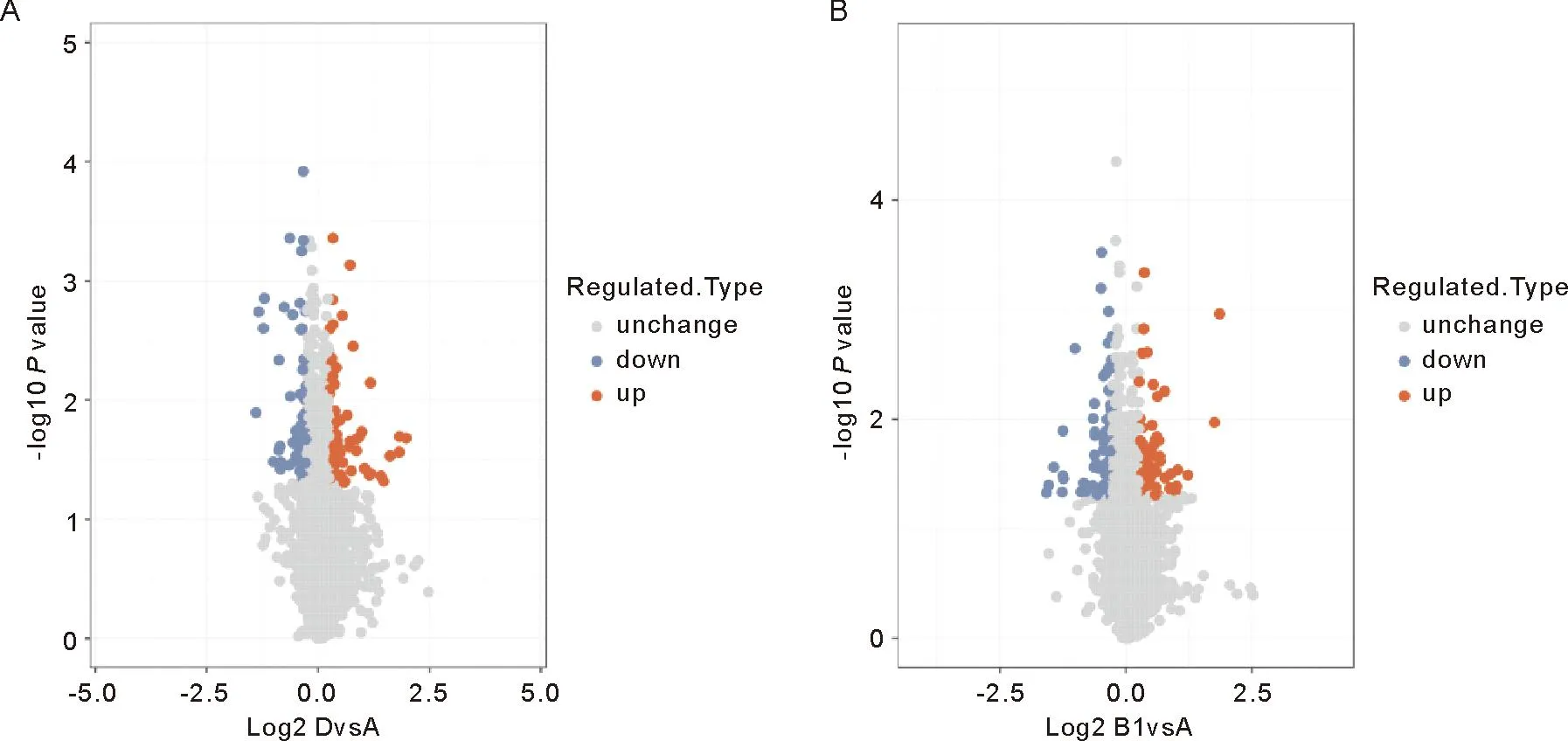
注:A:DOR组;B:POF组。横轴为Log2对数变换后的蛋白质相对定量值的值,纵轴为-Log10对数变换后显着性检验的P值。红点表示显着差异表达的上调蛋白,蓝点表示显着差异表达的下调蛋白
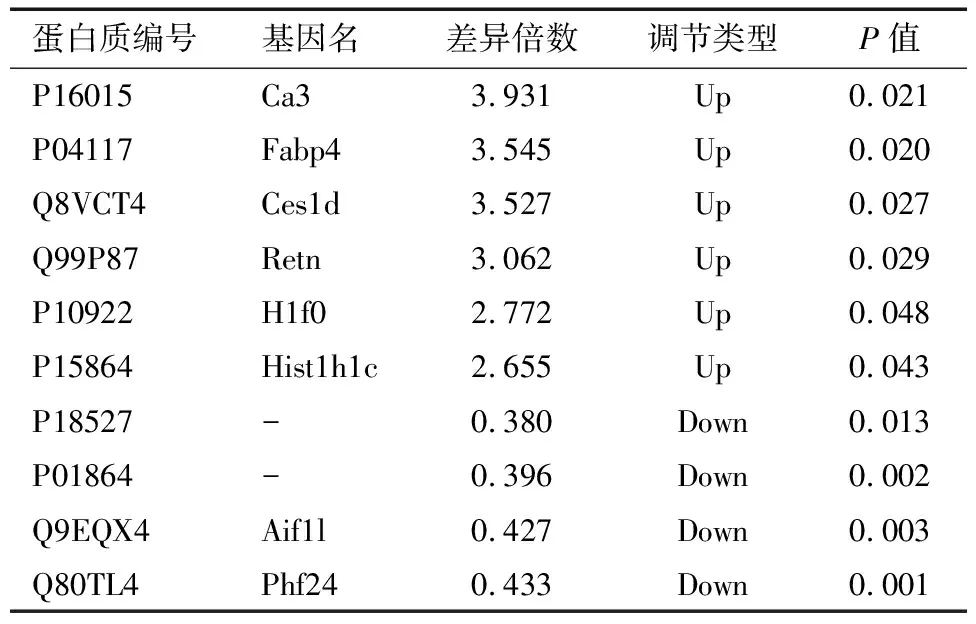
表2 DOR组与对照组部分差异表达蛋白
2.3 差异蛋白亚细胞定位结果 使用Wolfpsort软件分析差异表达蛋白的亚细胞定位,两组不同蛋白的亚细胞定位结果如下(图4)。两组差异蛋白质亚细胞定位按百分比大小依次排列均为细胞核、细胞质、细胞外,其次是线粒体和质膜、内质网,除此之外DOR组还有两个差异蛋白定位在其他细胞器。
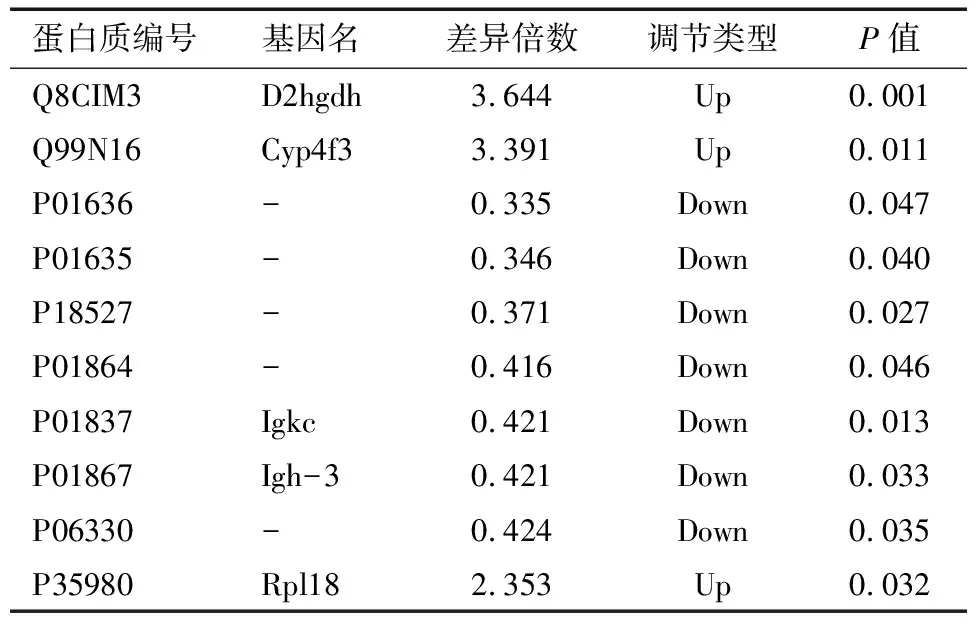
表3 POF组与对照组部分差异表达蛋白

注:A和B分别代表DOR组和POF组差异表达蛋白的定位,饼图中的数字代表显着差异表达蛋白的数量,百分比代表结构中差异表达蛋白的数量占总差异表达蛋白的百分比
2.4 差异表达蛋白的GO功能注释 Gene Ontology(GO)是一个重要的生物信息学分析方法和工具,用于表述基因和基因产物的各种属性。 GO注释分为3个大类:生物进程(biological process,BP),细胞组成(cellular component,CC)和分子功能(molecular function,MF)[6]。针对BP、CC、MF中涉及的GO节点列出对应的蛋白数量,对差异表达蛋白在GO二级注释中的分布进行统计(图5)。在生物学过程这一类别中DOR组和POF组差异表达蛋白占比最多的都是细胞过程,其次是信号转导过程;在细胞组分这一类别中,均是细胞的数量最多,其次是细胞器;参与分子功能的差异表达蛋白中,其中结合与催化活性二者最多。在所有亚类中,细胞过程、细胞、细胞器和结合注释的差异蛋白数量最多。与此同时,对其差异表达蛋白进行GO富集分析(图6),发现DOR组GO富集分析显示差异蛋白主要参与了维生素B6代谢过程、磷酸吡哆醛生物合成过程、磷酸吡哆醛代谢过程、蛋白质-DNA复合物组装、胆固醇稳态的正调节、对氧化应激反应的调节等生物过程;POF组GO富集分析显示差异蛋白主要参与了细胞脂质分解代谢过程、甘油脂分解代谢过程、前列腺素反应、微绒毛组织的调节、辅基代谢过程、白细胞介素6生产的调节、对抗原刺激的炎症反应等生物进程。
2.5 差异蛋白KEGG通路富集分析 KEGG是关于通路的公共数据库,为了进一步探究差异蛋白发生作用的通路,将其具有显著差异的蛋白纳入KEGG数据库检索,得出差异表达蛋白在KEGG通路中富集分布气泡图,见图7。DOR组中的差异蛋白主要与维生素B6代谢、α-亚麻酸代谢、PPAR信号通路相关,其中最显著相关的是维生素B6代谢通路,富集蛋白最多的通路是PPAR信号通路;POF组中的差异蛋白主要与同源重组、错配修复、鞘糖脂生物合成、花生四烯酸代谢、核糖体、糖鞘脂生物合成-神经节系列、DNA复制等通路显著相关,其中与与同源重组、错配修复通路最显著相关,富集蛋白最多的一条信号通路是核糖体通路。P值最小的前5条通路具体见表4、5。
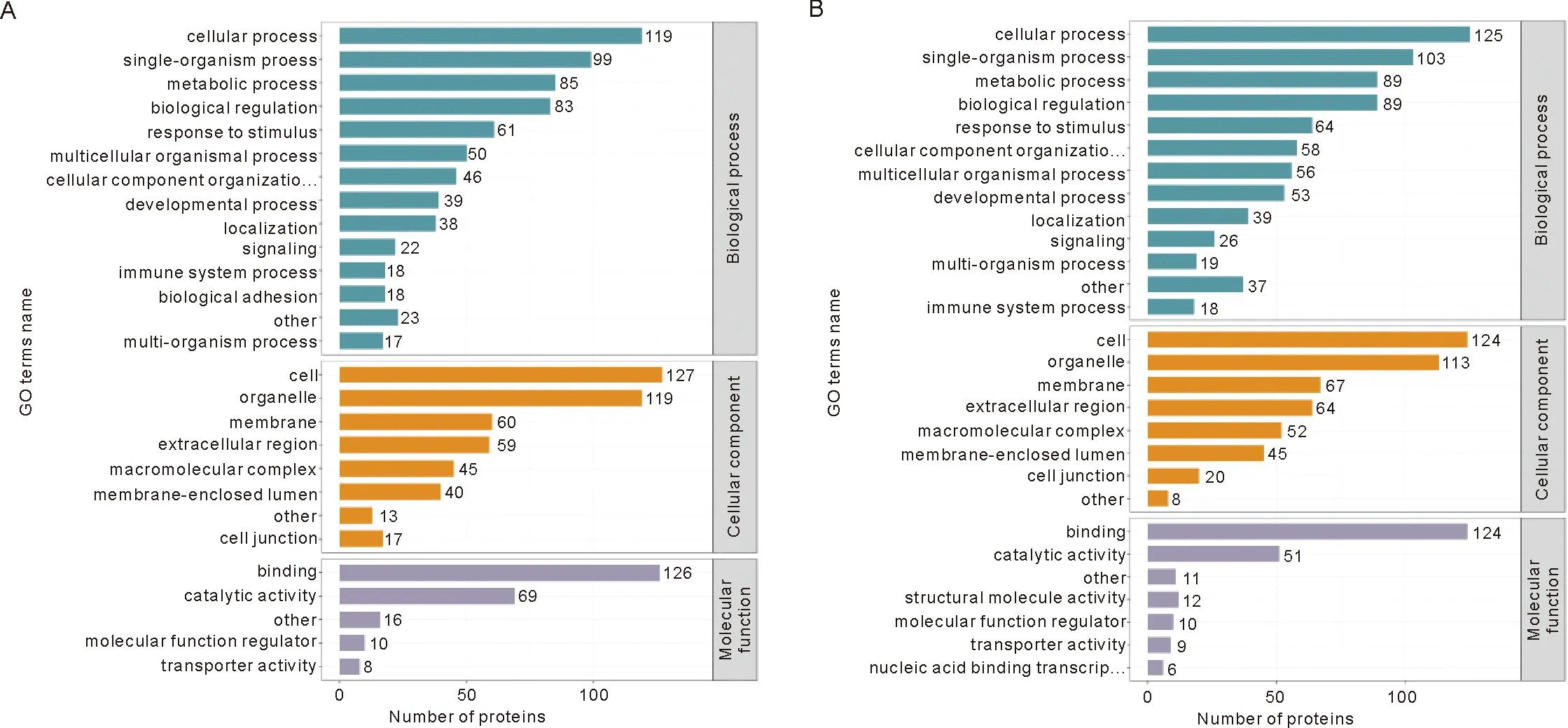
注:A、B分别代表DOR组和POF组差异表达蛋白在GO二级分类中的统计分布

注:A、B分别为DOR组和POF组BP、CC、MF三类差异蛋白富集分析,C、D分别为DOR、POF组BP的富集气泡图
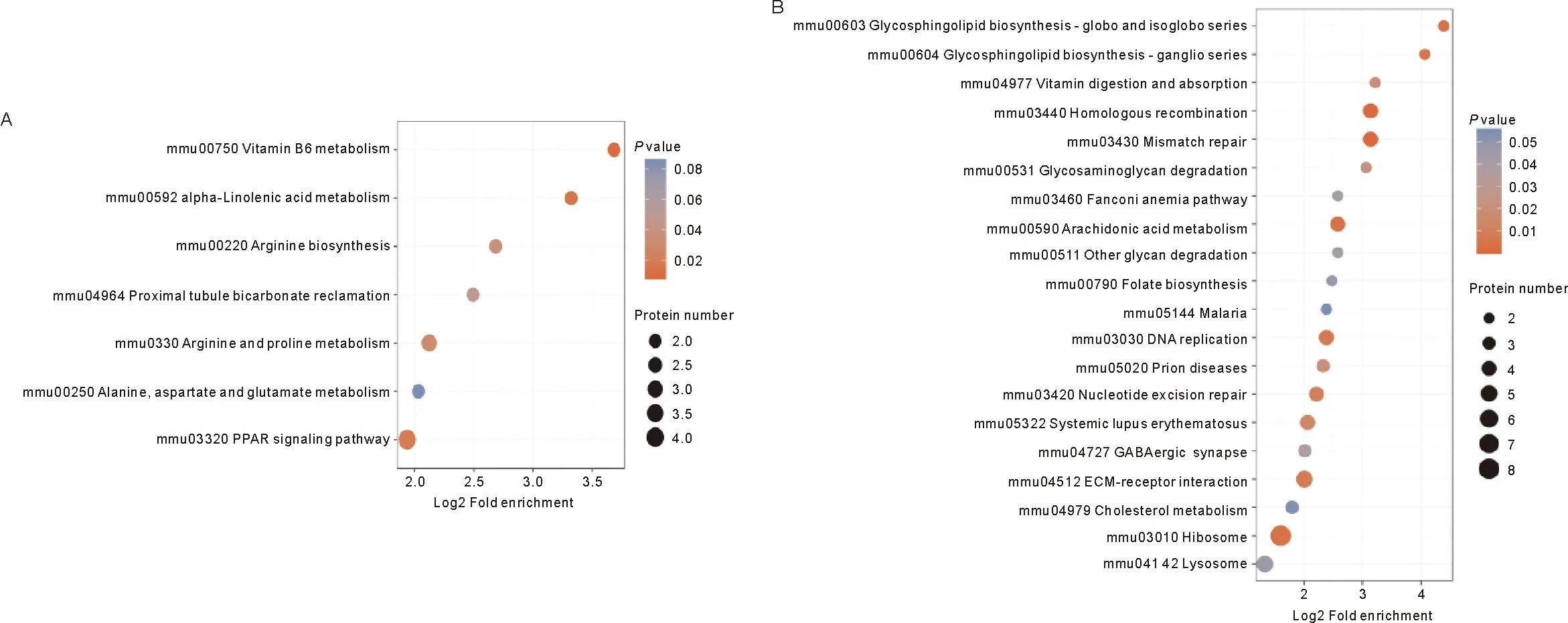
注:A为DOR组,B为POF组。横坐标为P值的-Log10 转换值,纵坐标为通路的名称,圆圈大小代表富集该通路的差异蛋白数目,颜色代表P值的大小
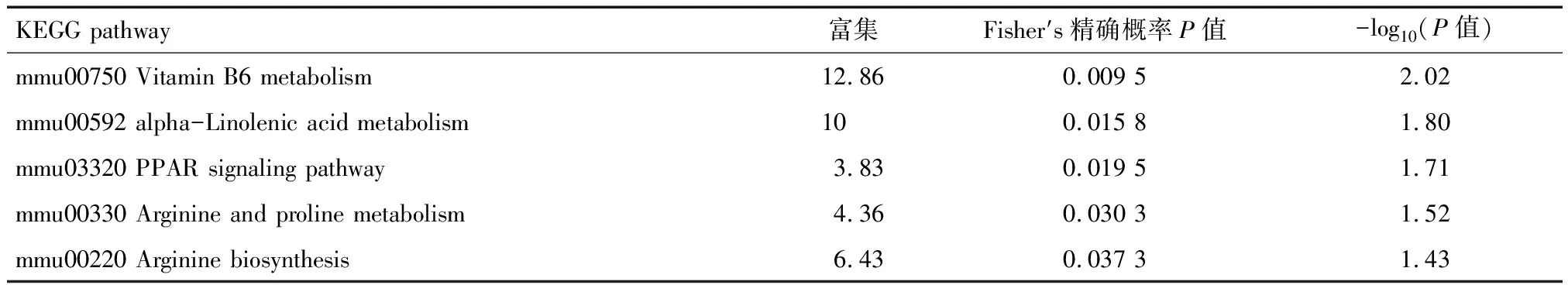
表4 DOR组差异表达蛋白KEGG通路富集结果(top 5)

表5 POF组差异表达蛋白KEGG通路富集结果(top 5)
3 讨论
DOR是卵巢衰老或衰竭的前期,这是由于卵巢中可募集的卵泡数量减少或卵母细胞受精能力下降所致,发生率约10%,是月经过少的常见原因[7],若不重视后期会发展为POF。POF是指在40岁之前失去正常的卵巢功能,这种情况影响约1%的40岁以下女性和0.1%的30岁以下女性。它的生化特征是闭经伴有低雌激素和高促性腺激素性疾病,在某些情况下会导致生育能力丧失[8]。卵巢早衰通病因大多未确定[9],Fraison等[10]认为,POF是由潜在机制引起的,例如早期卵泡耗竭,卵泡成熟受阻或卵母细胞库破坏以及抵抗性卵巢综合征,可能涉及这些机制的POF的已确定原因分为两类:遗传和非遗传原因。遗传原因涉及各种遗传异常,而非遗传原因包括自身免疫和代谢紊乱、感染、环境因素和医源性程序[11]。目前已经采用了各种方法来治疗POF,但效果不显。
蛋白质组学通过比较生物体或组织中所有蛋白质的差异表达[12],揭示了蛋白质分子水平的物质基础和机制。在此实验中,采用高分辨质谱仪进行TMT标记,进行鉴定和量化,通过生物信息学技术对差异蛋白进行分析来探究DOR、POF可能的靶点和通路。结果发现,DOR组小鼠卵巢有148个显著表达蛋白,POF组小鼠卵巢有149个显著差异表达蛋白,二者差异表达蛋白重叠有23个,其中HIST1H1C、RPL18、HIST1H1E、D2HGDH等蛋白在两组中都呈现显著高表达,二者重叠蛋白差异倍数趋势一致。在DOR组中CA3、FABP4、RETN等蛋白显著高表达,POF组D2HGDH、CYP4F3等蛋白显著高表达,这些表达差异倍数较大的蛋白可能在疾病发展过程中起关键的作用。
差异表达蛋白的亚细胞结构定位表明,占比最多的是细胞核、细胞质和胞外,其次是线粒体、内质网。线粒体是多功能细胞器,其主要功能包括以ATP形式产生细胞能量,维持细胞内钙稳态,活性氧(ROS)形成,细胞凋亡,脂肪酸氧化和类固醇合成。线粒体功能障碍是衰老的标志之一,线粒体功能障碍可由多种途径引起,如线粒体DNA异常或逐渐累积损伤、氧化应激、Ca2+直接损伤线粒体,导致卵子发育潜力下降,诱导卵子凋亡,引起卵巢储备功能下降,进而发展为卵巢早衰[13]。目前普遍认为氧化是导致衰老的重要因素,而线粒体和内质网中未折叠蛋白反应调节的氧化折叠机制是自由基的两大来源[14]。内质网应激可能导致钙和氧化还原稳态受损,引起氧化应激,从而影响线粒体功能。从内质网释放的钙增加了线粒体活性氧(ROS)的产生,内质网和线粒体内ROS的毒性积累会干扰基本的细胞器功能。持续的内质网应激可能引发炎症反应,通过炎症或线粒体功能障碍产生的ROS可能会加速内质网功能障碍[15]。D2HGDH、ATP9A、MRPl16、MTMR14、FAM162A等蛋白的功能与线粒体、内质网关系密切,可见,线粒体和内质网是关于DOR、POF疾病发生的重要细胞器,另外DOR组中有两个差异蛋白定位在其他细胞器中,具体信息尚不清楚,仍需进行进一步的研究。
GO富集分析结果显示DOR、POF疾病的发生、发展涉及氧化应激、炎症等多种生物学过程。氧化应激指机体在受到各种有害刺激时,产生过多的自由基,且氧化物清除能力下降,体内氧化与抗氧化之间的不平衡[16],是导致衰老的重要因素。ROS主要是线粒体氧化磷酸化的副产物,当机体受到某些疾病或外源性物质攻击时,导致组织细胞氧化应激损伤,于是细胞利用多种抗氧化机制阻断ROS的形成或中和其代谢过程中产生的ROS。当ROS的产生超过细胞的排泄能力时,细胞因ROS的过度积累而引起异常的炎症反应[17]。Bauer等[18]实验证明,氧化应激是卵巢衰老过程的主要驱动力,并有助于与卵巢衰老相关的其他病因的发展,如端粒缩短、线粒体功能障碍、细胞凋亡和炎症。衰老器官中血清炎症因子(如IL-6、IL-8、TNF-α)水平显著升高,说明衰老与炎症相关[19]。
GPX7是谷胱甘肽过氧化物酶家族(抗氧化)的成员,可有效控制过氧化物氢酶(H2O2)和通过还原谷胱甘肽的有机过氧化氢,它的主要作用是参与机体氧化还原稳态的维持[20]。TRIM家族,是一类具有E3泛素连接酶活性的蛋白质,其功能广泛,能够影响细胞增殖、分化、先天免疫、凋亡调控等,其中TRIM24是炎症反应的负调节剂。GPX7在两组中的蛋白表达较空白对照组相比均有所下降,TRIM24在两组中的蛋白表达均有所上升,说明两组小鼠体内氧化应激、炎症反应较均有所增加。越来越多的证据表明,接头组蛋白HIST1H1C(H1.2)在多个细胞过程中具有重要功能,包括细胞凋亡、自噬、基因转录等[21]。Wang等[22]发现组蛋白H1.2的过表达上可以导致自噬相关蛋白的上调,从而促进自噬,炎症和病变形成。H1.2蛋白在两组结果中都显著高表达,说明其在两种疾病中都发挥重要作用。D2HGDH是一种依赖FAD的线粒体酶,D2-羟基戊二酸(D2-HG)被认为是细胞代谢的不需要的副产物,D2HGDH介导D2-HG向α-酮戊二酸(α-KG)的转化,研究表明D2HGDH表达的增加会提高细胞内α-KG的水平[23]。α-KG不仅是三羧酸(TCA)循环中的重要代谢产物,它可以抑制ATP合成酶,减少细胞耗氧量从而延缓衰老,此外其在脂质合成、氧化应激、细胞死亡等生理过程中也具有重要的调控作用。蛋白组学研究发现D2HGDH在DOR、POF组中都呈现高表达,说明细胞内α-KG升高,机体抗氧化能力升高,尤其在POF组中作用更加显著。CA3是碳酸酐酶基因家族中的一员,在体内主要参与氧化代谢和离子交换等生理过程,其通过二硫键可逆结合到谷胱甘肽,可避免细胞受到氧化应激的伤害[24]。FABP4作为脂肪酸结合蛋白家族成员,在调节氧化应激、脂质代谢和炎症反应等方面发挥重要的作用[25],可以直接促进炎性细胞因子的释放和ROS的产生[26]。CA3和FABP4在DOR组中显著高表达说明CA3、FABP4可能是DOR发生过程中的关键蛋白。
KEGG通路富集结果显示DOR和POF疾病的发生发展是通过多条通路进行协同调控的,而不能单以一条通路来概括。目前我们课题组比较关注的通路是α-亚麻酸信号通路和花生四烯酸代谢通路。α-亚麻酸(ALA)和花生四烯酸(AA)都是多不饱和脂肪酸,多不饱和脂肪酸目前分为n-3、n-6、n-7和n-9这四个家族,其中ALA属于n-3家族,AA属于n-6家族。张怡等[27]研究发现多不饱和脂肪酸可影响卵巢脂肪酸含量、卵泡线粒体功能和卵泡氧化应激。n-3和n-6多不饱和脂肪酸可以调节生殖功能,因为它们会影响前列腺素合成和类固醇生成[28]。另外有研究[29]表示ALA能够调节体内的氧化还原平衡。Wakefield等[30]研究发现在卵巢成熟过程中,卵母细胞暴露于富含n-3多不饱和脂肪酸的环境中会导致线粒体分布和钙水平改变,并增加活性氧的产生,发现n-3 可以增加受精卵数量并能提高卵泡的线粒体功能和氧含量。Wathes等[28]认为卵母细胞的多不饱和脂肪酸含量会影响成熟、冷冻保存和随后的发育能力。ALA与卵母细胞生长和分化、调节生发囊泡阶段的减数分裂停滞以及防止生发囊泡破裂有关。近期的研究结果发现ALA可以抑制颗粒细胞的凋亡,可以通过抑制颗粒细胞中胆固醇的合成从而抑制类固醇激素的合成,导致E2分泌降低[31]。服用ALA后,体内谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)的活性升高,自由基代谢产物丙二醛(MDA)的生成减少,揭示ALA有抗衰老作用。由此可见,ALA与氧化、炎症、衰老关系密切,因此,认为α-亚麻酸信号通路是DOR疾病发展中的一条重要通路。
AA是细胞膜脂质的主要成分,它能进一步被环氧合酶(COX)、脂氧合酶(LOX)和细胞色素P450(CYP450)酶三种酶催化代谢,基于这三种代谢途径,AA可以转化为引发不同炎症反应的各种代谢物[32]。AA是促炎前列腺素的前体,可介导卵泡成熟和排卵过程[33]。张金铭等[34]发现,AA会损害人卵巢颗粒肿瘤细胞系的分泌和线粒体功能,能有效地诱导氧化应激,然后发挥促凋亡作用,长期食用AA会使小鼠卵巢闭锁卵泡增多。这些研究都辅助说明了花生四烯酸代谢通路是POF疾病发生中的一条重要通路。据报道,CYP4F亚家族成员主要参与花生四烯酸和异生素的代谢。CYP4F3是脂肪酸环氧化物氧化的主要催化剂,参与重要细胞介质的氧化[35]。CYP4F3过表达可诱导花生四烯酸增加,ROS积累和脂质过氧化,最终引起铁死亡[36]。蛋白组学结果显示POF组中CYP4F3显著上调,导致ROS积累和AA代谢途径激活,可见CYP4F3在花生四烯酸代谢通路中的重要作用。
综上所述,通过对DOR组和POF组小鼠的差异蛋白进行生物信息学分析发现这两种疾病是多蛋白、多生物学过程、多通路协同调控的。二者的发生都涉及氧化应激、炎症反应等生物学过程;α-亚麻酸信号通路可能是参与DOR发生的一条重要通路,HIST1H1C、CA3、FABP4可能是其发生的关键靶点;花生四烯酸代谢信号通路可能是参与POF发生的一条重要通路,HIST1H1C、D2HGDH、CYP4F3可能是POF发生的重要靶点;本研究是基于多个数据模型得出的生物信息学假设,其具体发病机制有待进一步实验验证。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:李晓荣研究方案设计、论文修改指导;仲佳雯、高婷撰写论文、实验操作、统计分析;秦岭、罗玉雪文献检索、原始结果的整理与分析;马小红负责方案可行性分析、论文修改、研究指导。

