BAIAP2L2在肝癌中的表达及与预后的关系
袁克荣, 戈英男, 潘红艳, 龚达, 莫佳业, 邓雪松△
1深圳大学第一附属医院、深圳市第二人民医院肝胆胰外科(广东深圳 518035); 2华中科技大学协和深圳医院消化内科(广东深圳 518052)
原发性肝癌属于高度恶性肿瘤,其组织类型以肝细胞癌(liver hepatocellular carcinoma, LIHC)占绝大多数,被喻为我国癌症中的第二号杀手[1]。我国肿瘤登记中心最新统计数据表明,LIHC每年新发病例约38.88万,位居全国恶性肿瘤发病的第4位,发病率为28.12/10万;LIHC每年死亡病例约33.64万,位居全国恶性肿瘤死亡的第2位,死亡率为24.33/10万[1]。目前,临床上LIHC的主要治疗手段有手术切除、肝脏移植、放疗、化疗、栓塞、局部治疗和分子靶向药物治疗等。尽管LIHC治疗手段多,但是治疗后极易复发与转移,远期存活率并未得到明显提高[2-3]。随着研究的深入,越来越多的肿瘤基因,及其参与肿瘤发生、发展的作用和分子机制逐渐得到认识[4-11]。因此,进一步探讨LIHC的分子调控机制,寻找特异、高敏感的分子标志物,对指导LIHC早诊早治、评估预后和监测复发转移具有重要意义。脑组织特异性血管生成抑制因子1关联蛋白2同类基因2(brain-specific angiogenesis inhibitor 1-associated protein 2-like 2, BAIAP2L2)定位于人染色体22q13.1,CDS区域 1590bp,含530个氨基酸,分子量大约58kD[12],主要位于细胞膜、细胞核、细胞质和线粒体,可与磷酸肌醇4,5二磷酸结合,具有促进平面或弯曲细胞膜结构形成的作用[13]。新近研究表明,BAIAP2L2在基因调控和转录后蛋白编码过程中表现“脚手架”调控的作用,受胰岛素受体和胰岛素相关生长因子受体酪氨酸磷酸化激活,调控亚细胞结构的基质膜形成、肌动蛋白移行和伪足形成,参与多种实体肿瘤细胞的发育、分化、增殖、侵袭和迁移等分子生物行为[14-19]。然而,国内外关于BAIAP2L2在LIHC中的相关研究报道较少。近年来,仅有2篇采用生物信息学方法对BAIAP2L2在LIHC表达、作用和潜在调节机制的报道,但未通过临床病例和细胞功能学实验进行验证[20-21]。因此,本研究在生物信息分析的基础上,结合临床病例探讨BAIAP2L2在LIHC的表达与临床特征的相关性,为揭示LIHC的发病机制和预测预后提供理论参考。
1 资料与方法
1.1 数据来源 从TCGA和GTEx数据库(https://TCGAData.nci.nih.gov/TCGA/))获取33种肿瘤[注:肾上腺皮质癌(ACC);膀胱癌(BLCA);乳腺癌(BRCA);宫颈鳞癌和腺癌(CESC);胆管癌(CHOL);结肠癌(COAD);弥漫性大B细胞淋巴瘤(DLBC);食管癌(ESCA);脑胶质瘤(GBM);头颈癌(HNSC);肾嫌色细胞癌(KICH);肾透明细胞癌(KIRC);肾乳头状细胞癌(KIRP);急性髓性白血病(LAML);低级别脑胶质瘤(LGG);肝细胞癌(LIHC);肺腺癌(LUAD);肺鳞癌(LUSC);间皮瘤(MESO);卵巢癌(OV);胰腺癌(PAAD);嗜铬细胞瘤和副神经节瘤(PCPG);前列腺癌(PRAD);直肠腺癌(READ);肉瘤(SARC);黑色素瘤(SKCM);胃癌(STAD);睾丸癌(TGCT);甲状腺癌(THCA);胸腺癌(THYM);子宫内膜癌(UCEC);子宫肉瘤(UCS);葡萄膜黑色素瘤(UVM)。]的BAIAP2L2表达的相关数据,计算基因表达的FPKM水平(fragments per kilobase million)用于后续的比较分析;公共数据库GEPIA(http://gepia2.cancer-pku.cn/#index)和TIMER(https://cistrome.shinyapps.io/timer/)计算差异表达分析,采用秩和检验的方法进行比较(*P<0.05、**P<0.01、***P<0.001)。GEO数据集的基因表达分析使用BEST网站(https://rookieutopia.com/app_direct/BEST/#PageHomeAnalysisModuleSelection)的临床信息相关性分析功能进行统计分析。
1.2 预后分析 为了探讨BAIAP2L2表达对肿瘤预后的影响,每种肿瘤患者以BAIAP2L2表达的中位数为界值分成两组(高表达组和低表达组),本研究通过单因素COX比例回归风险模型分析了BAIAP2L2表达与总体生存率(overall survival, OS)的相关性,使用Forestplot包绘制森林图;Kaplan-Meier方法分析BAIAP2L2高表达组和低表达组的无瘤生存期(disease free survival, DFS)差异,在GEPIA数据库(http://gepia2.cancer-pku.cn/#index)进行Kaplan-Meier生存曲线作图。
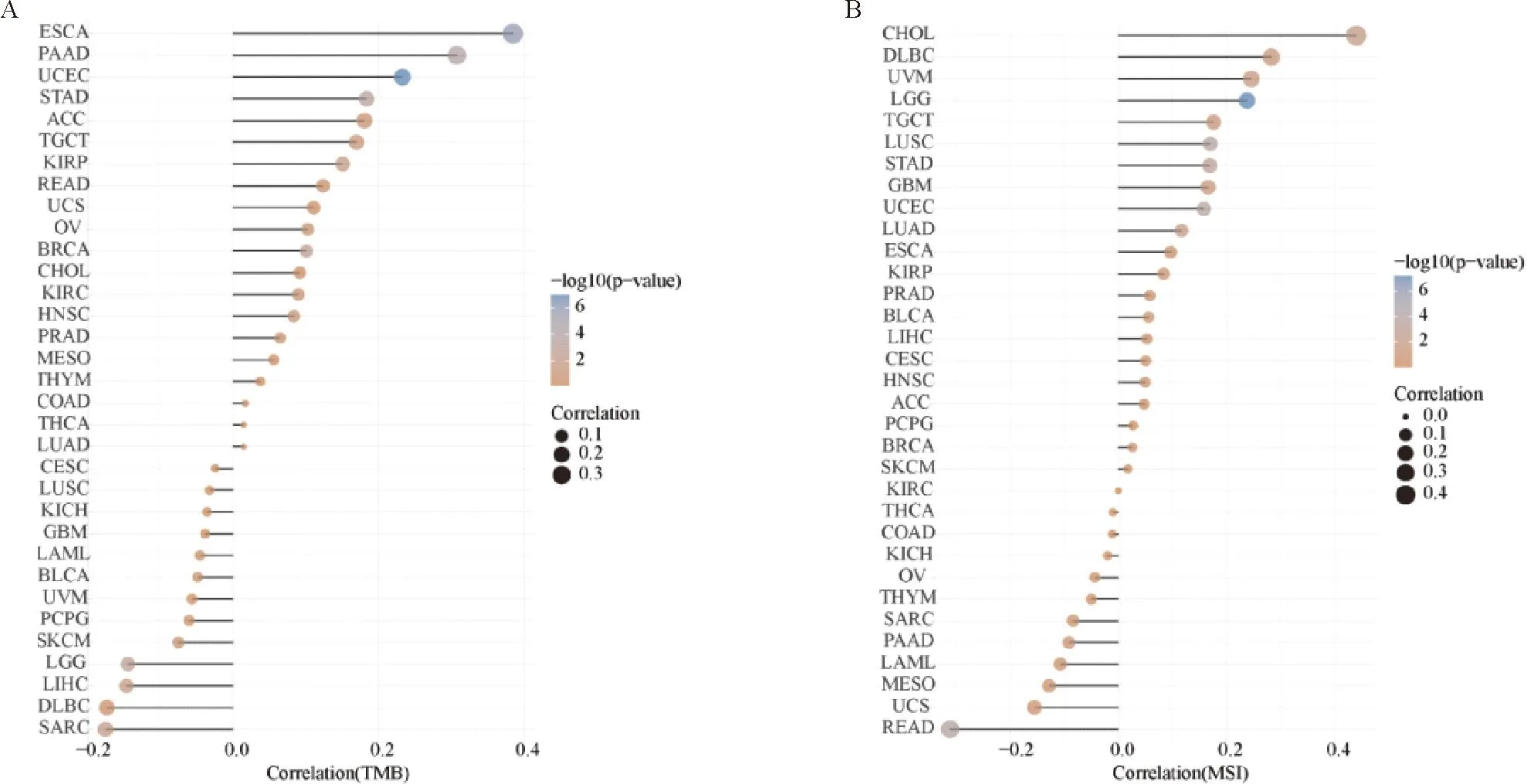
1.3 肿瘤突变负荷(tumor mutational burden, TMB)和微卫星含量(microsatellite instability, MSI)分析 基于来自TCGA数据库(https://portal.gdc.com)的RNA-seq数据,按既往文献的方法计算33种肿瘤的TMB[22]和MSI水平[23],分析BAIAP2L2表达水平与各肿瘤的TMB、MSI的相关性,以P<0.05且|r|>0.2认为显著相关。
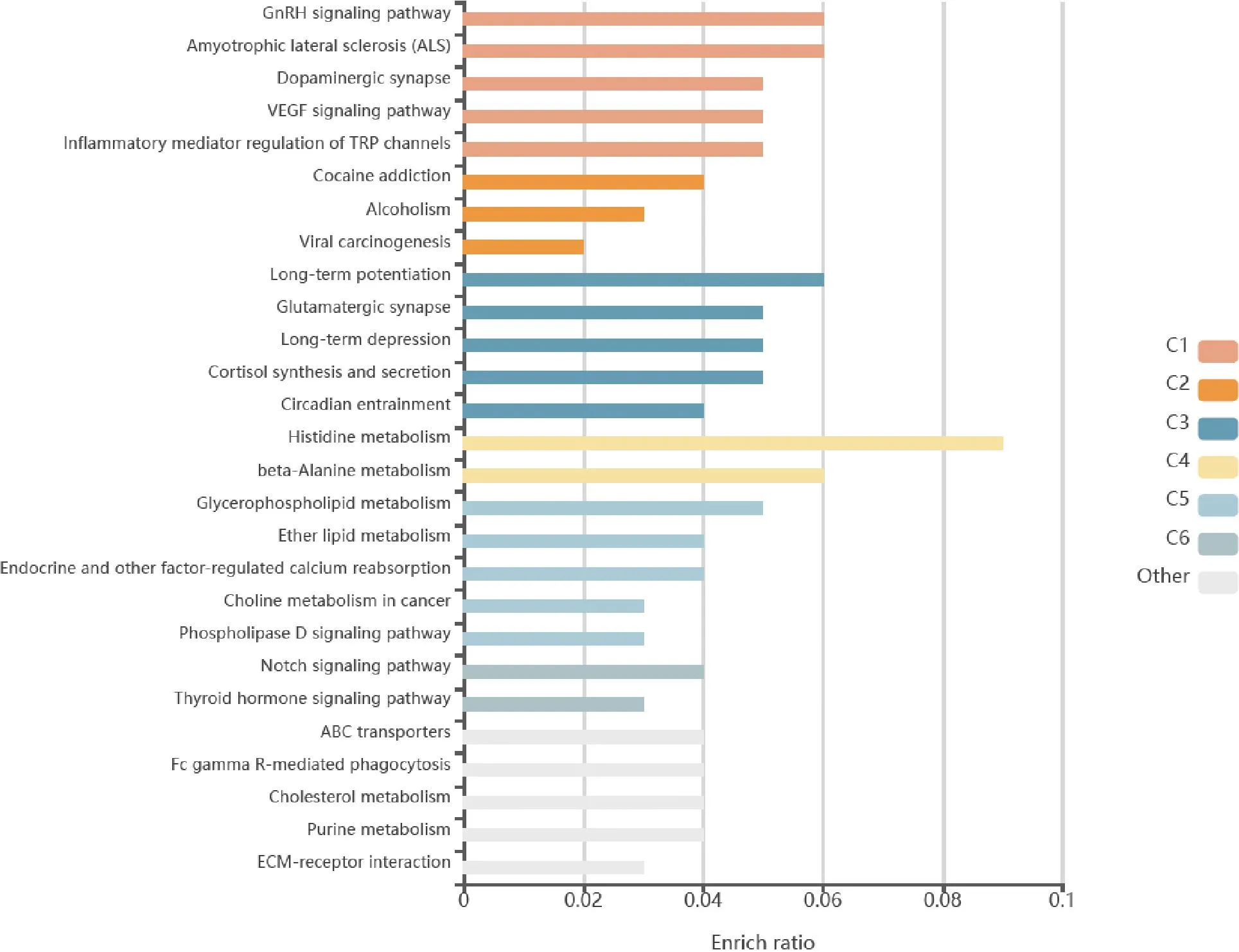
1.4 信号通路的富集分析 收集105个肿瘤明星信号通路的基因集合[24]并通过R包GSVA的method=′ssgsea′功能实现ssGSEA算法[25],基于ssGSEA算法计算LIHC中105个肿瘤明星信号通路,探讨其与BAIAP2L2基因表达的Spearman相关性。分析BAIAP2L2表达与信号通路的相关性,以P<0.05且|r|≥0.3认为显著相关。通过Pearson相关性分析确定TCGA数据库LIHC与BAIAP2L2表达正相关前300的基因,通过WEB-based GEne SeT Analysis Tookit (http://www.webgestalt.org/)工具实现KEGG通路富集分析,设定最小基因数为5,同种类型的通路用同样颜色标记,校准P<0.05、标准化富集分数绝对值(normalized enrichment score, |NES|>1)和错误发现率(false discovery rate, FDR q<0.025)的信号通路被认为是显著富集的通路。
1.5 临床病例资料 2020年1月至2022年6月在我院首次行LIHC根治术的患者55例,术前未接受放、化疗等辅助治疗,术后病理确诊为LIHC;以及同期因肝外伤、肝良性病变接受手术的患者10例。留取LIHC组织、癌旁组织(距肿瘤边缘>1 cm)和正常肝组织标本,存于-80℃冰箱中备用。手术当天开始计算生存时间和无瘤生存时间。对LIHC患者进行术后随访,建立随访档案,所有统计信息截至2023年3月。本研究已获我院临床科研伦理委员会批准(20190724),所有组织标本的收集均取得患者的知情同意。
1.6 组织标本的免疫组织化学检测与结果判读 常温下解冻组织标本,经甲醛固定,脱水、石蜡包埋,切片,厚度为3 μm,依次按步骤进行烤片、脱蜡、抗原修复、内源性过氧化物酶灭活和封闭,孵育一抗(1∶100稀释Anti-Pinkbar;品牌:abcam/艾博抗,广州巴本生物科技有限公司),4℃冰箱封闭过夜,TBST浸洗切片4次(5 min/次),孵育二抗,37℃恒温箱孵育30min,TBST浸洗切片4次(5 min/次),DAB显色,再次脱水,脱酒精,最后封片、晾干。
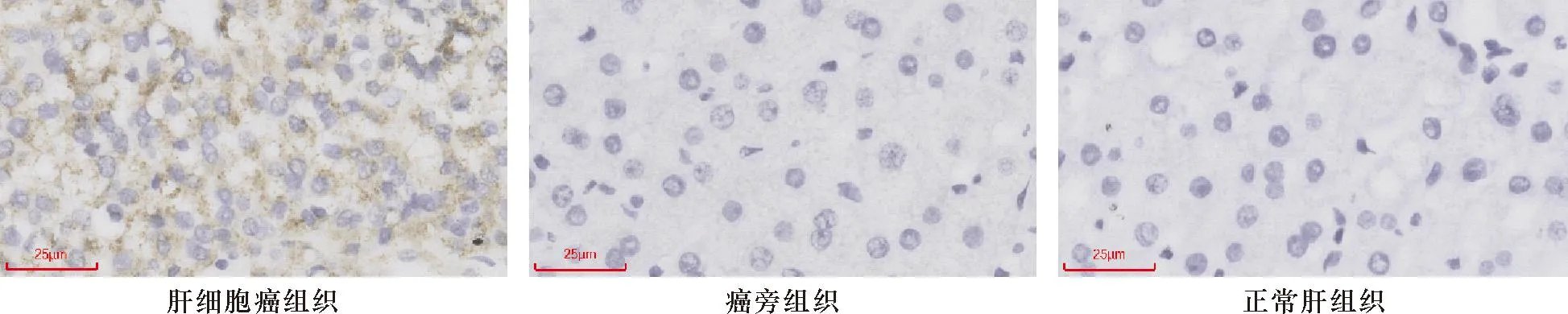
BAIAP2L2表达的蛋白分布于细胞核外,弥散在细胞质中,因此将细胞质染棕色定义为阳性。制备好的组织切片采用玻片扫描影像系统(型号:SQS-40P;深圳市生强科技有限公司)进行扫描成像,经过放大80倍视野并截取图像,每一切片图像随机选取3个视野以.tiff格式进行保存,通过image J软件(型号:2.15.0 WIN;美国National Institutes of Health)对于图像的积分光密度值(integrated optical density, IOD)进行统计分析,取3个视野的平均值作为最后结果,计算积分光密度值,即得出标本的染色强度,代表BAIAP2L2的表达量。
2 结果
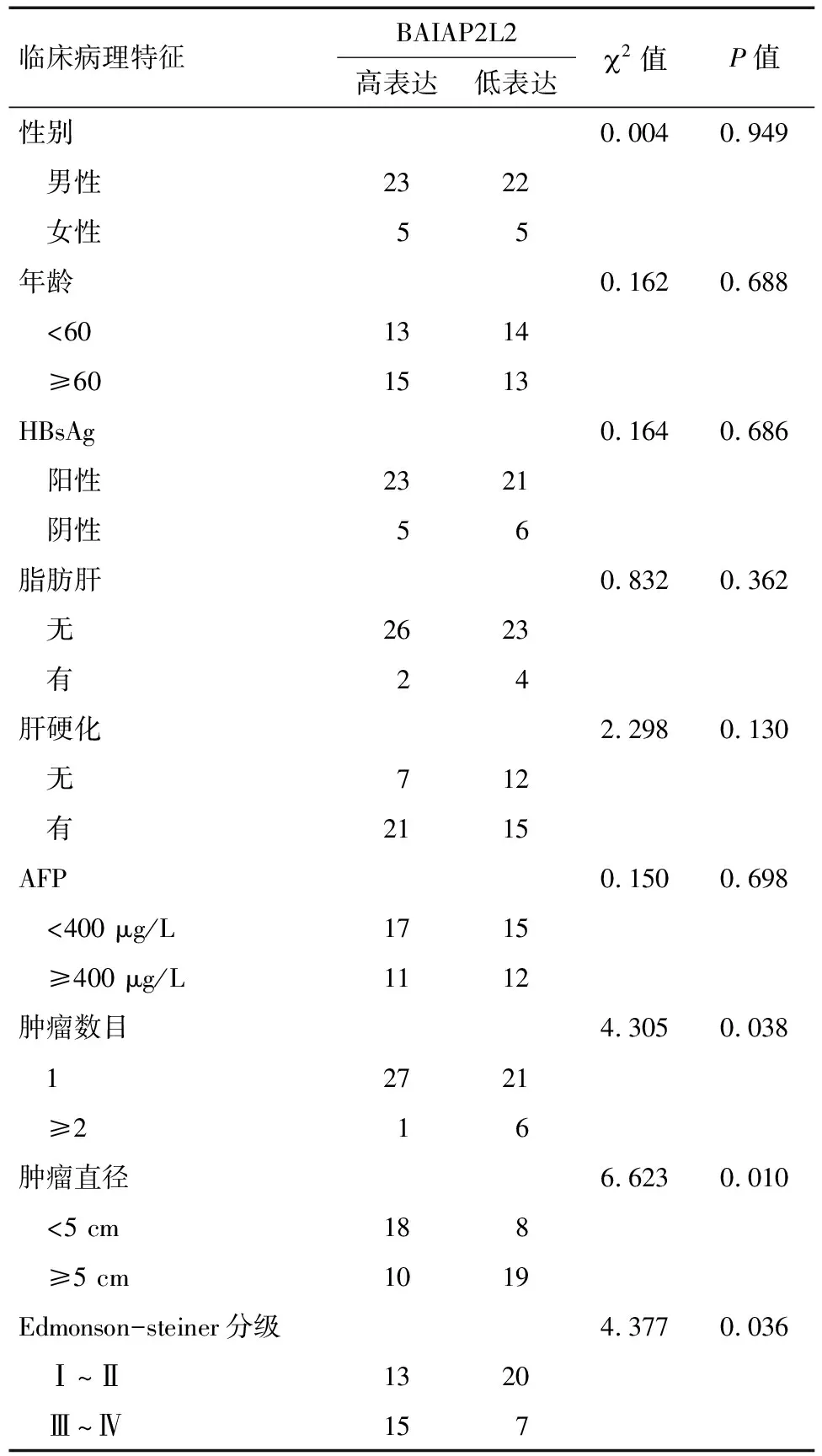
2.1 BAIAP2L2在泛癌中的表达 采用TCGA和GTEx数据库分析BAIAP2L2在33种肿瘤组织、癌旁组织和正常组织的表达水平,利用limma方法进行差异表达的检验,结果表明:BAIAP2L2在BLCA、CHOL、COAD、ESCA、HNSC、KICH、KIRC、LIHC、LUAD、LUSC、PRAD、STAD、THCA等13种肿瘤组织的表达显著高于对应的癌旁组织,在SKCM原发癌组织的表达显著高于转移癌组织(图1A);BAIAP2L2在BLCA、CHOL、ESCA、HNSC、KIRC、LIHC、LUAD、LUSC、STAD等9种肿瘤组织的表达显著高于对应的正常组织,在PRAD肿瘤组织的表达与对应的正常组织比较无明显差异(图1B)。GEO数据库分析结果显示,BAIAP2L2在LIHC组织中的表达显著高于正常肝组织(图1C)。
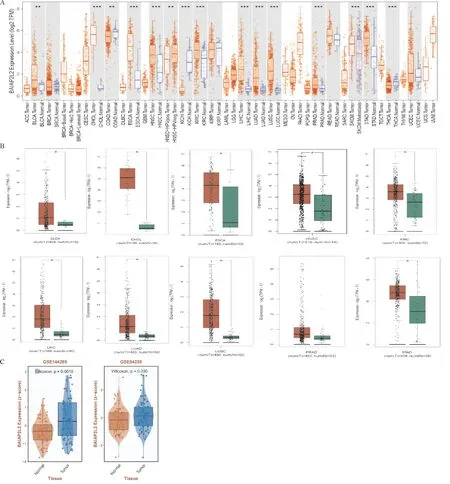
注:A: 癌组织与癌旁组织的比较;B: 癌组织与对应正常组织的比较;C: BAIAP2L2在LIHC组织与正常肝组织的比较(*P<0.05; **P<0.01; ***P<0.001)
2.2 BAIAP2L2表达在泛癌中预后评估的价值 DFS森林图结果显示,BAIAP2L2高表达是ACC、LGG、MESO、PRAD、SKCM、UCEC和UVM等7种肿瘤的危险因素(图2A)。生存分析结果表明,BAIAP2L2表达与ACC、LGG、SKCM、和UVM等4种肿瘤的DFS相关(P<0.05)(图2B), 与LIHC的DFS没有明显相关;BAIAP2L2表达与ACC、LIHC、MESO、UVM、PRAD、SKCM和LUAD等7种肿瘤的OS相关(P<0.05)(图2C)。
2.3 BAIAP2L2表达对泛癌中基因组不稳定性的影响 分析结果显示,BAIAP2L2表达水平与ESCA、PAAD、UCEC的TMB显著正相关(P<0.05,r>0.2),与LIHC的TMB无明显相关性(-0.2 注:A: DFS森林图;B: BAIAP2L2表达与4种肿瘤DFS的相关性; C: BAIAP2L2表达与7种肿瘤OS的相关性 2.4 BAIAP2L2在LIHC潜在调控的信号通路 采用ssGSEA方法,分析105条肿瘤明星信号通路在LIHC发生、发展中的作用与相关性,结果显示BAIAP2L2表达水平与16条潜在调控信号通路显著相关(图4和表1)。其中,BAIAP2L2表达参与的正性调控的信号通路有鞘糖脂生物合成/新乳糖合成、G2/M期检查点、肿瘤增殖、鞘脂代谢和糖胺聚糖生物合成硫酸角蛋白等5条通路;参与的负性调控的信号通路有脂肪酸降解、初级胆汁酸生物合成、β-丙氨酸代谢、生物素代谢、丁酸代谢、赖氨酸降解、D-精氨酸/D-鸟氨酸的代谢、硒化合物代谢、缬氨酸/亮氨酸/异亮氨酸的降解、色氨酸代谢和咖啡因代谢等11条通路。 注:A:BAIAP2L2与TMB的相关性;B:BAIAP2L2与MSI的相关性 图4 BAIAP2L2表达与肿瘤明星信号通路的相关性 表1 BAIAP2L2表达与肿瘤明星通路的相关性 基于Pearson相关分析,计算各肿瘤与BAIAP2L2最相关的前300个基因,并进行KEGG生物学通路富集分析。结果表明,BAIAP2L2参与了LIHC的组氨酸代谢、β-丙氨酸代谢、GnRH、VEGF等信号通路的调节。见图5。 图5 LIHC中与BAIAP2L2表达最相关的前300个基因富集的KEGG通路图 2.5 临床病例中BAIAP2L2在LIHC组织的表达明显增高 BAIAP2L2在LIHC表达的IOD(0.32±0.12)水平显著高于对应的癌旁组织(0.23±0.08)(P=1.09e-05,95%CI:-0.10362~-0.046545)和正常肝组织(0.25±0.05)(P=0.003 6,95%CI:-0.10867~-0.021028) (图6、7),与TCGA数据库LIHC数据的结果一致。 图6 LIHC组织、癌旁组织和正常肝组织BAIAP2L2的表达(×80) 注:A: LIHC与癌旁组织BAIAP2L2表达的比较;B: LIHC与正常组织BAIAP2L2表达的比较 2.6 在LIHC病例中,BAIAP2L2的表达水平与临床病理特征的相关性 根据组织标本的免疫组织化学结果,以LIHC组织IOD值的中位数为参考界值,将LIHC病例分为BAIAP2L2高表达组(n=28)与低表达组(n=27)。相关性分析结果显示,BAIAP2L2表达水平与肿瘤数目、直径和分化程度密切相关(均P<0.05),而与患者性别、年龄、HBV感染、脂肪肝、肝硬化、AFP等其他临床病理特征无明显相关(均P>0.05)(表2)。BAIAP2L2高表达组中位生存期15个月,低表达组中位生存期21个月,两组比较的差异具有统计学意义(P=0.0182)。进一步单因素COX分析,结果显示BAIAP2L2表达水平与LIHC患者生存预后相关(P=0.03,HR0.281, 95%CI: 0.089~0.884)。 BAIAP2L2表达蛋白又名为Pinkbar蛋白,含有Bin-Amphipysin-RVS(BAR)结构域,是一个反向平行的全螺旋二聚体,具有形似香蕉的弯曲外形,通过其带正电荷的凹面与细胞膜结合,通过静电相互作用结合富含磷脂膜,并在体外诱导肌醇磷脂聚集,从而产生正膜曲率的外力,主要在细胞膜的形成、细胞膜的内吞、细胞的运动和细胞整体的形态发生变化等过程中发挥关键作用,参与多种实体肿瘤细胞的增殖、侵袭、迁移等多种生物行为[14, 15, 27-29]。近年来的研究表明,BAIAP2L2在多种不同类型的肿瘤组织均有表达,如LUAD、STAD、骨肉瘤和PRAD等[16-19]。Xu等[16]报道,BAIAP2L2在LUAD组织和多种LUAD细胞株的表达上调,在体外实验显示,下调BAIAP2L2的表达可导致LUAD细胞株A549和H1299细胞存活、克隆形成能力下降,促进细胞的凋亡,通过抑制雌激素介导的细胞进入S期,进而抑制肿瘤细胞的增殖。Liu等[17]研究表明,BAIAP2L2在STAD组织中呈现高表达,与肿瘤直径、T分期、pTNM分期和淋巴结转移显著相关;进一步机制研究表明,BAIAP2L2通过激活AKT/mTOR通路促进STAD细胞的增殖、迁移和侵袭。Guo等[18]研究显示,BAIAP2L2在骨肉瘤组织和细胞株MG-63、U2OS的表达显著上调,与肿瘤直径密切相关,通过介导Wnt3a/β-catenin通路的激活促进了骨肉瘤细胞的增殖、侵袭和转移。Song等[19]研究表明,BAIAP2L2在PRAD组织和细胞株LNCaP和PC-3的表达上调,通过调控VEGF通路关键蛋白VEGFA、VEGFR和FAK的表达,促进癌细胞的增殖、迁移和侵袭。 表2 LIHC患者的BAIAP2L2表达水平与临床特征的相关性 例 本研究中,我们采用生物信息学分析的方法,通过TCGA和GTEx数据库分析BAIAP2L2在33种肿瘤、对应的癌旁组织和正常组织的表达水平,结果发现BAIAP2L2在泛癌组织普遍呈现高表达,具体表现在BLCA、CHOL、COAD、ESCA、HNSC、KICH、KIRC、LIHC、LUAD、LUSC、PRAD、STAD、THCA等13种肿瘤组织的BAIAP2L2表达显著高于对应的癌旁组织,在BLCA、CHOL、ESCA、HNSC、KIRC、LIHC、LUAD、LUSC、STAD等9种肿瘤组织的BAIAP2L2表达显著高于对应的正常组织。为了进一步探讨BAIAP2L2高表达对肿瘤预后的影响,我们以每种肿瘤患者BAIAP2L2表达的中位数为界值分成两组(高表达组和低表达组)进行预后分析。DFS森林图结果显示,BAIAP2L2高表达是ACC、LGG、MESO、PRAD、SKCM、UCEC和UVM等7种肿瘤的危险因素。生存分析结果表明,BAIAP2L2表达与ACC、LGG、SKCM、和UVM等4种肿瘤的DFS相关,与LIHC的DFS没有明显相关。BAIAP2L2表达与LIHC、ACC、LGG、SKCM、UVM、MESO和PRAD等7种肿瘤的OS相关。上述结果表明,BAIAP2L2在癌组织的高表达,提示患者OS和DFS较差,是促进肿瘤进展和导致不良预后的重要因素,有可能成为预后肿瘤预测的潜在分子标志物,与文献报道的一致[16-19]。 众多研究表明,肿瘤的发生、发展是一个多因素、多基因、多步骤、多阶段的复杂过程,所涉及的调控因素、基因和信号通路繁多,常常与miRNA异常表达、基因缺失/突变/表达异常、关键功能蛋白活性改变和多种信号通路的失调密切相关[4-11, 16-23]。既然BAIAP2L2异常表达参与肿瘤的发生发展,但是其潜在的生物学功能、分子机制和相关调控通路仍有待于进一步发掘。为此,我们进一步提取TCGA数据库RNA-seq数据,分析泛癌中33种肿瘤的TMB和MSI水平,采用ssGSEA方法从105个肿瘤明星信号通路中去分析BAIAP2L2高、低表达与信号通路的富集差异,通过Pearson相关性分析,计算BAIAP2L2表达与各肿瘤最相关的前300个基因,并进行KEGG功能通路富集分析。TMB是肿瘤基因组中除种系突变外的体细胞突变的数量[22]。MSI反映了肿瘤细胞中缺陷DNA错配修复的程度[23]。较高的TMB和MSI则表示肿瘤细胞可以产生更多的新抗原,此类新抗原可被免疫细胞识别为非自身抗原并触发抗肿瘤免疫反应[30]。因此,我们评估了33种肿瘤中BAIAP2L2表达与TMB、MSI的相关性。分析结果显示,BAIAP2L2表达水平与3种预后相关肿瘤ESCA、PAAD、UCEC的TMB显著正相关,与4种预后相关肿瘤CHOL、DLBC、UVM和LGG的MSI正相关,与READ的MSI呈负相关。由此,我们推测BAIAP2L2可能通过调节肿瘤免疫细胞水平和状况,在促进肿瘤的进展和影响的预后等方面具有一定的潜在作用。ssGSEA分析结果表明,BAIAP2L2表达水平与16条LIHC潜在调控信号通路显著相关,BAIAP2L2表达参与的负性调控的信号通路有脂肪酸降解、初级胆汁酸生物合成、β-丙氨酸代谢、生物素代谢、丁酸代谢、赖氨酸降解、D-精氨酸/D-鸟氨酸的代谢、硒化合物代谢、缬氨酸/亮氨酸/异亮氨酸的降解、色氨酸代谢和咖啡因代谢等11条通路;参与的正性调控的信号通路有鞘糖脂生物合成/新乳糖合成、G2/M期检查点、肿瘤增殖、鞘脂代谢和糖胺聚糖生物合成硫酸角蛋白等5条通路。由此可见,BAIAP2L2基因的表达上调有可能导致氨基酸的代谢和降解的抑制,引起重要化合物与关键功能蛋白的合成障碍、癌信号通路的调控异常,进而促进肿瘤的发生和发展。KEGG生物学通路富集分析表明,大部分肿瘤主要富集在代谢、细胞周期和凋亡调控等相关的信号通路。其中,BAIAP2L2参与了LIHC的组氨酸代谢、β-丙氨酸代谢、GnRH、VEGF等信号通路的调节,表现促癌的生物学功能。上述研究结果,为进一步揭示BAIAP2L2异常表达在泛癌中的促癌作用、可能的分子机制和相关调控通路提供了理论基础。 为了在临床病例中进一步探讨BAIAP2L2在LIHC表达情况与临床特征的相关性,本研究对收集了55例接受根治术LIHC患者的癌组织、癌旁组织标本,以及10例正常肝组织标本,采用免疫组织化学方法检测BAIAP2L2表达水平,LIHC患者均得到术后随访,最后结合临床资料进行统计分析。研究结果表明,BAIAP2L2在LIHC表达水平显著高于对应的癌旁组织和正常肝组织,与TCGA数据库LIHC数据的结果一致。相关性分析结果显示,BAIAP2L2表达水平与肿瘤数目、直径和分化程度密切相关;BAIAP2L2高表达组中位生存期明显低于低表达组中位生存期;BAIAP2L2表达水平与LIHC患者生存预后相关。上述临床研究结果表明,BAIAP2L2在LIHC高表达是促进肿瘤进展和导致不良预后的重要因素,提示BAIAP2L2高表达有可能作为预测LIHC预后的分子标记物,与其在泛癌数据分析结果一致。BAIAP2L2在LIHC异常表达与呈现的作用,与其在新近文献报道的LUAD、STAD、骨肉瘤和PRAD所起的生物学功能相类似[16-19]。 本研究尚存在一定的局限性:(1)本研究主要基于公共数据库的数据,以及55例患者随访39月的资料,下一步需要扩大临床样本量和延长术后随访时间,去验证BAIAP2L2异常表达对LIHC患者预后的影响;(2)需要进一步深入研究确定BAIAP2L2表达在LIHC细胞株和动物模型的生物学功能、以及相关调控分子机制。 综上所述,本研究利用TCGA和GTEx数据进行生物信息学分析,发现BAIAP2L2在泛癌组织中普遍高表达,通过影响TMB和MSI水平、调控相关的信号通路参与肿瘤的发生、发展。进一步临床数据研究表明,BAIAP2L2在LIHC表达水平显著高于对应的癌旁组织和正常肝组织,与肿瘤数目、直径和分化程度密切相关,是促进肿瘤进展和导致不良预后的重要因素,有助于为阐明HCC的发病机制和预测预后提供新的线索。 利益相关声明:所有作者共同认可论文无利益冲突。 作者贡献说明:袁克荣负责数据统计分析、论文撰写;戈英男负责研究方案执行与实施和数据整理;潘红艳负责实验结果作图和分析;龚达负责患者组织标本的收集和术后随访;莫佳业负责组织标本存取和免疫组织化学检测;邓雪松负责研究设计、全过程管理、论文审校和修改。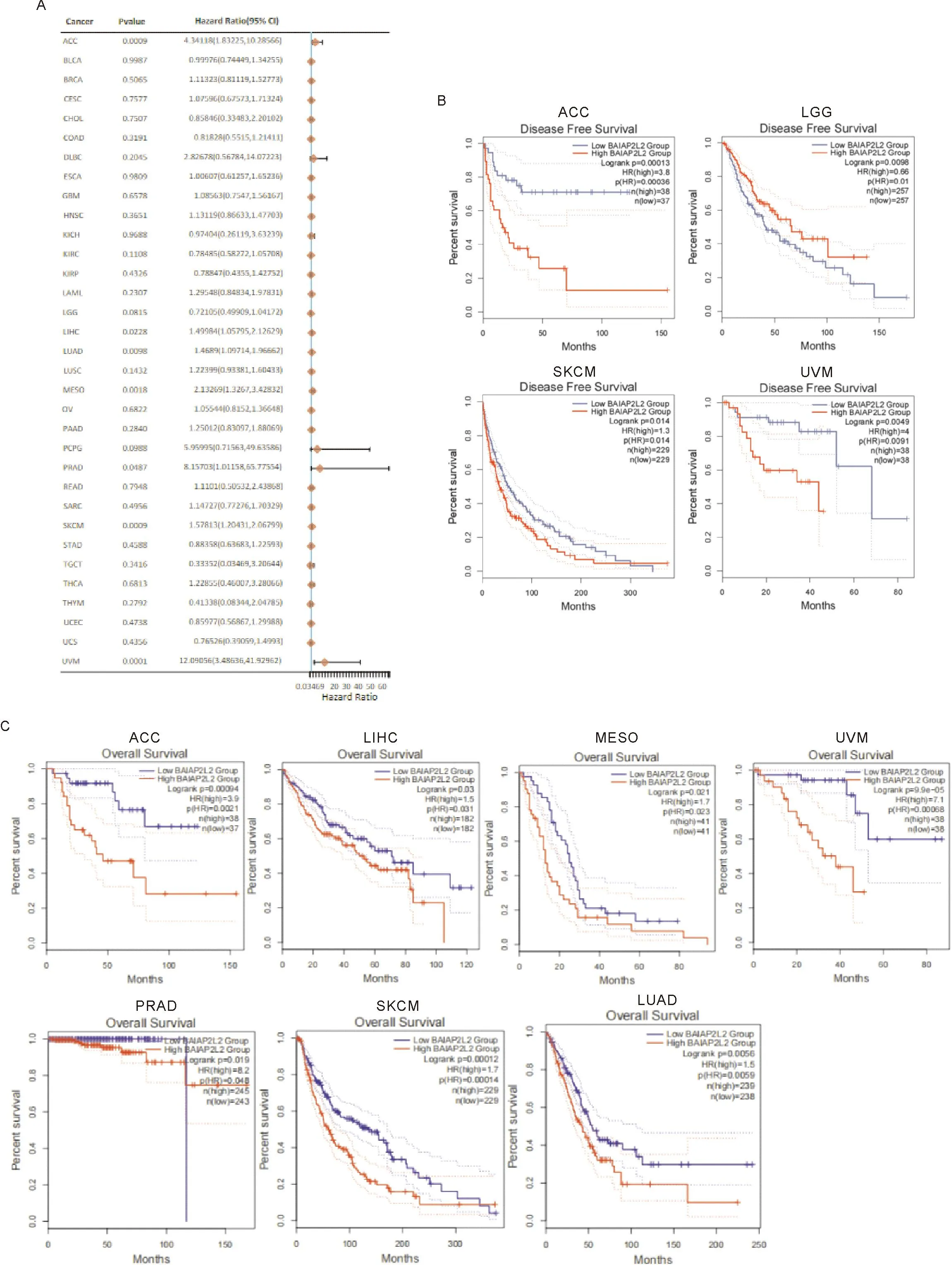



3 讨论