LncRNA-NEAT1调控miR-182-5p表达对狼疮性肾炎肾系膜细胞损伤的影响
张路路, 谢锐, 廖志敏, 吴刚, 万波, 孙威, 周莲红
凉山州第二人民医院 1肾内科, 2检验科(四川凉山 615000)
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)的主要并发症,也是导致患者死亡的重要原因之一。从肾脏病理组织的角度来讲,已确诊的SLE患者约35%~75%表现为肾脏受累,导致SLE患者发生肾功能衰竭,对SLE患者的生命健康威胁极大[1]。LN发病率约占SLE患者的38%,主要病因是肾系膜细胞的过度增殖,从而引起炎症因子的大量释放,使得炎症加重并导致肾小球硬化[2]。目前,LN的发病率逐年增加,临床上通常采用药物治疗缓解患者的病情进展,并不能彻底将其治愈[3]。因此,探究LN的具体作用机制对提高患者治愈率来说非常重要。有研究表明,长链非编码RNA(long non-coding RNA,LncRNA)能够通过与微小RNA(microRNA,miRNA)结合来调控下游基因的表达从而参与调节细胞的生物学进程[4]。核旁丛组装转录本1(nuclear paraspeckle assembly transcript 1,NEAT1)是新发现的LncRNA。有研究显示,NEAT1下调通过吞噬miR-128抑制氧化低密度脂蛋白诱导的动脉粥样硬化发展中的炎症和氧化应激[5];NEAT1过表达不仅能够通过靶向miR-204和激活核因子-κB(NF-κB)通路加重脂多糖诱导的急性肺损伤[6],也能通过HMGB1/RAGE信号通路诱导肺泡上皮细胞损伤和炎症的发生[7],还能够吸附miR-139-5p来调控肝纤维化过程[8]。此外,NEAT1通过靶向miR-146b促进TRAF6的表达,加速LN肾系膜细胞损伤[9]。最近的研究[10]显示,在急性肺损伤中,NEAT1与miR-182-5p存在靶向关系,NEAT1过表达可抑制其细胞活力,促进细胞凋亡和炎症反应。miR-182-5p被证明与LN的进展有关,可调节肾脏纤维化[11]。然而,NEAT1与miR-182-5p在LN肾系膜细胞中的作用关系还不清楚。此外,叉头盒蛋白O1(forkhead box O1,FoxO1)在LN患者和LN小鼠中处于激活状态,说明FoxO1对LN进展起促进作用,而β-连环蛋白(β-catenin)位于FoxO1的下游,二者在炎症环境下相互作用,FoxO1缺失会破坏FoxO1-β-catenin轴,进而阻碍炎症的发生[12-13]。因此,本研究基于FoxO1/β-catenin通路,探讨NEAT1对LN肾系膜细胞损伤的影响及其与miR-182-5p的调控关系,进一步揭示其发挥作用的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞、主要试剂和仪器 人肾系膜细胞株,购自湖南丰晖生物科技有限公司;NEAT1小干扰RNA或过表达载体质粒(si-NEAT1/pcDNA-NEAT1)及相应对照(si-NC/pcDNA)、miR-182-5p模拟物(miR-182-5p mimics)和阴性对照miR-NC、miR-182-5p抑制物(anti-miR-182-5p)及阴性对照anti-miR-NC,购自上海生工生物公司;兔抗鼠FoxO1、β-catenin多克隆抗体及辣根过氧化物酶标记的二抗、酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒、乳酸脱氢酶(LDH)检测试剂盒,购自美国Abcam公司;Lipofectamine2000试剂、酶标仪、流式细胞仪均购自美国BD公司;Annexin V-FITC/PI凋亡试剂盒、SYBR Premix Ex Taq II试剂盒,购自南京诺唯赞公司;细胞计数试剂盒8(cell counting kit 8,CCK-8)试剂、逆转录试剂盒,购自上海碧云天生物公司。CO2细胞培养箱,购自德国Eppendorf公司;超净工作台、实时定量PCR仪,购自美国伯腾仪器有限公司。
1.1.2 临床样本来源 收集2019年3月至2021年7月在凉山州第二人民医院接受治疗的32例经过肾穿确诊的LN患者外周血,称为LN组。其中,5例为Ⅰ型,8例为Ⅱ型,13例为Ⅲ型,6例为Ⅳ型。LN患者均符合1982年修订的美国风湿病学会SLE分类标准,并且SLEDAI积分均>10分。按照SLEDAI评分标准评估疾病活动情况,同时符合排除标准。
排除标准:(1)药物性狼疮;(2)孕妇及哺乳期妇女;(3)合并其他自身免疫性疾病;(4)合并严重心、肺、肾脏等重要脏器病变及血液系统、内分泌系统相关疾病;(5)慢性感染及近期感染史;(6)恶性肿瘤。
同时,收集同期在本院体检的32例健康者的外周血,称为对照组。分别分离外周血单个核细胞和血清,置于-80℃冰箱保存待用。本研究方案经凉山州第二人民医院伦理委员会批准进行(伦审科2019第(97)号),所有患者均签署知情同意书。
1.2 方法
1.2.1 细胞模型的制备、转染及分组 取出冻存的肾系膜细胞复苏,于37℃、5% CO2细胞培养箱中进行传代培养,在超净工作台中,向细胞培养瓶中加入10%正常人血清和10%、15%、20% Ⅳ型LN患者血清继续培养[14],96 h后,收集细胞,建立LN肾系膜细胞。然后用5 μg/mL细菌脂多糖(lipopolysaccharides,LPS)[9]处理LN肾系膜细胞8 h。将构建好的LN肾系细胞膜采用Lipofectamine2000试剂进行转染,并随机分组为:对照组(正常培养,不转染)、模型组(细胞中加入5 μg/mL 脂多糖继续培养)、si-NC组(细胞转染si-NC后加入5 μg/mL 脂多糖继续培养)、si-NEAT1组(细胞转染si-NEAT1后加入5 μg/mL 脂多糖继续培养)、si-NEAT1+anti-miR-NC组(细胞共转染si-NEAT1和anti-miR-NC后加入5 μg/mL 脂多糖继续培养)、si-NEAT1+anti-miR-182-5p组(细胞共转染si-NEAT1和anti-miR-182-5p后加入5 μg/mL 脂多糖继续培养)。
1.2.2 实时荧光定量聚合酶链反应(quantitative real-time PCR,qRT-PCR) 取LN组和对照组外周血单个核细胞,采用逆转录试剂盒把提取的外周血单个核细胞总RNA反转录成cDNA,然后,根据qRT-PCR仪的使用说明利用SYBR Premix Ex Taq II试剂盒和特异性的定量引物进行PCR扩增。以GAPDH或U6作为内参基因,采用2-ΔΔCt方法计算NEAT1以及miR-182-5p、FoxO1、β-catenin mRNA的相对表达水平。引物序列见表1。

表1 引物序列
1.2.3 酶联免疫吸附试验 对临床患者的血清和转染后的各组细胞利用相关ELISA试剂盒检测炎症细胞因子:肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)的浓度。
1.2.4 CCK-8实验 收集转染后的各组肾系膜细胞,将其置于96孔细胞板(1×105个细胞/孔)中过夜培养。然后,分别加入CCK-8(5 mg/mL)试剂10 μL,室温下,继续培养3 h。使用酶标仪,在450 nm处检测各组细胞的吸光度值。
1.2.5 细胞凋亡实验 将收集好的各组肾系膜细胞制备成悬浮液,依次加入Annexin V-FITC和PI溶液,避光反应15 min,接着使用流式细胞仪分析各组细胞凋亡情况。
1.2.6 LDH分析 收集各组细胞上清液,使用LDH检测试剂盒测定各组细胞内LDH含量。
1.2.7 免疫印迹分析 提取细胞总蛋白并对其定量,接着使用SDS-PAGE电泳进行蛋白分离,然后转膜,再加入脱脂奶粉进行封闭,1 h后,加入FoxO1、β-catenin、GAPDH一抗,次日加入对应二抗,使用ECL系统分析各组蛋白表达情况。
1.3 统计学方法 实验数据均为计量资料,采用平均数±标准差的方式表示,采用SPSS 23.0软件进行统计分析,两组比较采用成组t检验(含校正t检验),多组比较采用单因素方差分析+两两比较HSD-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 LN患者外周血单个核细胞中NEAT1、miR-182-5p、FoxO1和β-catenin mRNA的表达水平 与对照组比较,LN组患者外周血单个核细胞中NEAT1、FoxO1和β-catenin mRNA表达水平均显著上升,miR-182-5p表达水平显著下降(P<0.05),见表2。

表2 各组NEAT1、miR-182-5p、FoxO1和β-catenin表达水平
2.2 LN患者血清中TNF-α、IL-6和IL-1β的含量 LN组患者血清中TNF-α、IL-6和IL-1β含量均显著高于对照组(P<0.05)。见表3。

表3 各组TNF-α、IL-6和IL-1β的含量
2.3 LN肾系膜细胞模型建立 与10%健康者血清组比较,10%、15%、20% LN患者血清组细胞活力均显著升高(P<0.05),由于20% LN患者血清组细胞活力最高,故选择20% LN患者血清诱导的LN肾系膜细胞模型,见表4。

表4 各组细胞活力比较
2.4 敲低NEAT1对LN肾系膜细胞模型细胞增殖、凋亡的影响 与对照组相比,模型组中NEAT1表达水平明显升高,miR-182-5p表达水平明显降低,细胞活力显著上升(P<0.05);与模型组和si-NC组相比,si-NEAT1组中NEAT1表达水平和细胞活力明显降低,miR-182-5p表达水平显著升高(P<0.05);与si-NEAT1组和si-NEAT1+anti-miR-NC组比较,si-NEAT1+anti-miR-182-5p组中NEAT1表达水平和细胞活力显著上升,miR-182-5p表达水平显著下降(P<0.05);而各组细胞之间凋亡率差异无统计学意义(P>0.05),见图1、表5。
2.5 敲低NEAT1对LN肾系膜细胞模型中炎症因子的影响 较对照组而言,模型组中LDH、TNF-α、IL-6和IL-1β的含量均明显升高(P<0.05);si-NEAT1组中LDH、TNF-α、IL-6和IL-1β的含量明显低于si-NC组和模型组(P<0.05);si-NEAT1+anti-miR-182-5p组中LDH、TNF-α、IL-6和IL-1β的含量显著高于si-NEAT1+anti-miR-NC组和si-NEAT1组(P<0.05),见表6。
2.6 各组细胞中FoxO1和β-catenin蛋白表达比较 模型组中FoxO1和β-catenin蛋白表达水平均显著高于对照组(P<0.05);si-NEAT1组中FoxO1和β-catenin蛋白表达水平均明显低于si-NC组和模型组(P<0.05);si-NEAT1+anti-miR-182-5p组中FoxO1和β-catenin蛋白表达水平均显著高于si-NEAT1+anti-miR-NC组和si-NEAT1组(P<0.05),而si-NC组和模型组、si-NEAT1+anti-miR-NC组和si-NEAT1组间比较的FoxO1和β-catenin蛋白表达水平没有显著变化(P>0.05)。见图2、表7。
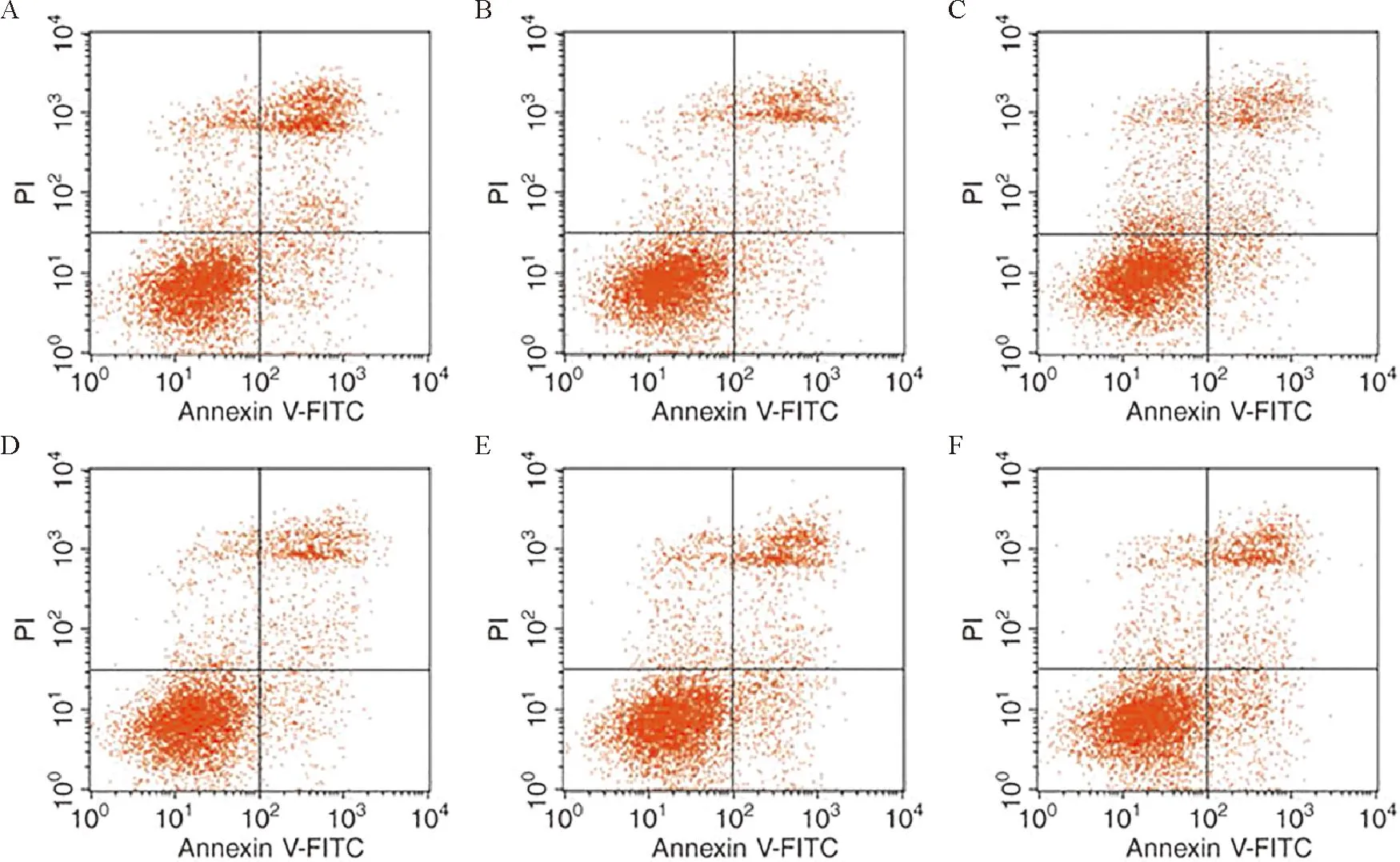
注:A:对照组;B:模型组;C:si-NC组;D:si-NEAT1组;E:si-NEAT1+anti-miR-NC组;F:si-NEAT1+anti-miR-182-5p组

表5 敲低NEAT1对LN肾系膜细胞模型细胞增殖、凋亡的影响

表6 敲低NEAT1对LN肾系膜细胞模型中炎症因子的影响
3 讨论
LN是导致SLE发病和致死的重要原因[15],目前LN患者的治疗方式主要是利用免疫抑制剂、B细胞调节疗法或钙调磷酸酶抑制剂[16]。有研究表明,LncRNA与多种疾病包括LN的发生、发展密切相关。据报道[17],LncRNA NEAT1在败血症肝损伤患者中高表达,且抑制NEAT1表达可降低体外炎症细胞因子的水平。在非酒精性脂肪肝模型中,NEAT1表达上调,其过表达可通过靶向调控miR-146a-5p进而促进脂质积累[18];另外,NEAT1和miR-140协同作用可加剧非酒精性脂肪肝进展[19]。Zhang等[20]的研究显示,NEAT1在SLE患者中高表达,NEAT1表达的增加可能导致SLE患者产生IL-6等大量细胞因子和趋化因子。而且,在LN中NEAT1可加速肾系膜细胞损伤[9]。但是,其在LN中的分子机制尚不完全清楚。因此,本研究首先以收集的LN患者的外周血单个核细胞和血清为研究对象来检测NEAT1和炎症因子的表达情况,结果显示,与对照组比较,LN组患者外周血单个核细胞中NEAT1表达水平和血清中炎症因子TNF-α、IL-6和IL-1β含量均显著上升,说明NEAT1促进LN发展。肾系膜细胞可调节机体的免疫反应,能够影响炎症环境,是致使LN发生肾小球纤维化损伤的重要因素。本研究通过向肾系膜细胞中加入10%正常人血清和10%、15%、20%的Ⅳ型LN患者血清继续培养,发现20% LN患者血清组细胞活力最高。因此,本研究选择20% LN患者血清来构建LN肾系膜细胞模型。接着,本研究采用LPS诱导LN肾系膜细胞,结果显示,模型组细胞活力显著升高,炎症因子(TNF-α、IL-6和IL-1β)含量明显增加,揭示LPS可促进LN肾系膜细胞增殖和炎症因子的释放,而细胞损伤标志物LDH含量的显著升高,说明LPS能够促进LN肾系膜细胞损伤,提示体外LN肾系膜细胞损伤模型构建成功。

注:A:对照组;B:模型组;C:si-NC组;D:si-NEAT1组;E:si-NEAT1+anti-miR-NC组;F:si-NEAT1+anti-miR-182-5p组

表7 各组细胞中FoxO1和β-catenin蛋白表达比较
LncRNA通常与miRNA相互作用进而调控细胞的增殖、凋亡、损伤等过程[21]。已有研究[10]表明,NEAT1靶向负调控miR-182-5p水平,敲低NEAT1能改善急性肺损伤进展。另外,Zhu等[22]研究也表明,在LPS刺激的急性肺损伤小鼠和RAW264.7细胞中,miR-182-5p表达降低,且其过表达可通过减少炎症因子的释放而抑制炎症反应。而miR-182-5p在LN中发挥重要的调控作用[11]。故本研究以NEAT1和miR-182-5p的靶向关系为基础,进而探讨二者在LN肾系膜细胞损伤中的作用和调控机制。结果显示,LN患者外周血单个核细胞和LN肾系膜细胞中NEAT1的表达均显著升高,miR-182-5p的表达均显著降低,二者趋势正好相反,提示在LN中,NEAT1可能通过调控miR-182-5p发挥作用。敲低NEAT1后,细胞中NEAT1表达水平、细胞活力以及LDH、TNF-α、IL-6和IL-1β的含量均明显降低,miR-182-5p表达水平显著升高,凋亡率差异不大,说明抑制NEAT1表达能够抑制细胞增殖和炎症反应的发生。而在敲低NEAT1的基础上抑制miR-182-5p表达后,细胞活力及LDH、TNF-α、IL-6和IL-1β含量均显著上升,但凋亡率无明显变化,揭示抑制miR-182-5p表达可减弱NEAT1敲低对LN肾系膜细胞损伤模型细胞增殖和炎症因子的影响,进一步表明敲低NEAT1通过靶向调节miR-182-5p水平减轻了LN肾系膜细胞模型细胞损伤。但是,NEAT1靶向miR-182-5p减轻细胞损伤的具体机制还不清楚,还需进一步研究。
Wang等[11]研究表明,FoxO1在SLE患者中高表达,既是miR-182-5p的靶基因,也是肾功能的保护因子;同时,Wang等[23]发现,LINC01018能够通过吞噬miR-182-5p上调FoxO1,抑制肝癌细胞的增殖和周期进展。而FoxO1/β-catenin通路与氧化应激过程关系密切,抑制FoxO1/β-catenin通路能够促进细胞凋亡和损伤[24]。FoxO1与β-catenin协同作用,激活Wnt/β-catenin信号进而促进肝癌进展[25]。LPS刺激后巨噬细胞中Foxol和β-catenin蛋白表达增加,髓系FoxO1缺失消除了FoxO1与β-catenin的相互作用,进而抵抗氧化应激诱导的肝细胞损伤[13]。本研究发现,FoxO1和β-catenin mRNA表达水平在LN组患者外周血单个核细胞中明显升高;敲低NEAT1后,FoxO1和β-catenin蛋白表达水平明显降低,而抑制miR-182-5p表达可减弱NEAT1敲低对FoxO1和β-catenin蛋白表达的影响,揭示敲低NEAT1通过靶向上调miR-182-5p表达,抑制FoxO1和β-catenin蛋白表达,进而减轻LN肾系膜细胞模型的细胞损伤。
综上所述,敲低NEAT1可通过负调控miR-182-5p表达,抑制LN肾系膜细胞过度增殖,降低炎症反应,其可能与FoxO1、β-catenin下调表达有关,NEAT1有望成为LN治疗的靶标,为研究LN的发展机制提供新思路。但是,本研究还存在一些不足之处,首先,LN患者血清中本身可能存在较高的炎症因子水平,而本研究以LN患者血清建立的体外LN肾系膜细胞模型为基础来观察LPS诱导后炎症因子的表达情况,并不能完全排除血清本身的影响。其次,本研究只是在体外探讨了NEAT1的功能,NEAT1在体内是否具有同样的作用还需进一步研究。
利益相关声明:所有作者声明不存在任何利益冲突。
作者贡献说明:张路路进行了论文选题、试验设计、数据采集及论文初稿撰写等工作。谢锐和廖志敏为实施试验、数据提取、数据分析和统计分析提供了协助。吴刚和万波进行了文献检索和论文编辑等工作。孙威和周莲红进行了论文审查与修订等工作。

