PTBP3对食管鳞状细胞癌细胞增殖与迁移的影响及机制研究
吕莹 郝明硕 钱阳 王蕊 相龙全
1济宁医学院临床医学院,济宁 272067;2济宁市第一人民医院病理科,济宁 272002
食管癌是全球最常见恶性肿瘤,尤其在亚洲一些地区,其发病率和病死率均居高不下。食管鳞状细胞癌(ESCC)占食管癌的90%,随着手术、放疗、化疗等多种治疗手段的发展,5年生存率不足20%[1-2]。ESCC早期症状不明显,疾病进展迅速,大多数患者在诊断时已进入晚期,治疗效果差。多嘧啶束结合蛋白3(PTBP3)属于RNA结合蛋白PTB家族,与多种肿瘤发生过程密切相关,包括RNA的剪接、稳定和转运等。既往研究发现,PTBP3在肺癌、胰腺癌、胃癌、结直肠癌中蛋白水平升高[3-4]。本研究探讨PTBP3在ESCC中的表达情况及其作用机制,为ESCC的诊断及治疗提供新思路和方法。
材料与方法
1.细胞培养和转染
本研究使用的人ESCC细胞株有ECA109(北纳生物)、KYSE150(诺普赛生物)、KYSE30(上海中乔新舟生物科技有限公司)。细胞培养于含有10%胎牛血清(FBS,Gibco Australia)的RPMI 1640培养基(Gibco Australia)中,在37 ℃的5% CO2加湿培养箱中培养。转染小干扰siRNA时,将细胞接种于6孔板中,24 h后细胞密度40%~60%时用riboFECTTMCP转染试剂(Ribobio)转染miRNA mimic(Ribobio)。
2.组织样本
收集2021年1月至2023年5月济宁市第一人民医院的6例ESCC标本及其癌旁正常组织标本。所有患者均经病理诊断,手术切除前均未接受化疗或放疗。ESCC组织标本均通过组织病理学检查确定肿瘤大小、组织学分级、TNM分期和淋巴结转移情况。本研究符合《赫尔辛基宣言》要求,所有患者均签署知情同意书。
3.慢病毒感染
感染前24 h将细胞接种于6孔板,按照感染倍数加入PTBP3 shRNA的慢病毒。转染72 h后用2 mg/L嘌呤霉素处理,选择稳定的细胞系。采用实时荧光定量PCR(qRT-PCR)和蛋白质印迹(Western blotting)检测PTBP3的转染效率。
4.Western blotting
细胞在含有1%磷酸酶和蛋白酶抑制剂的RIPA裂解缓冲液中裂解,并用BCA Protein Assay Kit(Beyotime)测定蛋白浓度。使用10% SDS-PAGE凝胶电泳分离蛋白,并将蛋白转移到聚偏氟乙烯(PVDF)膜上。将膜置于5%脱脂牛奶中,在旋转摇床上放置1 h,阻断非特异性结合位点,然后与一抗特异性抗体在4 ℃下孵育过夜。用1× TBST缓冲液洗涤3次(10 min/次)后,加入辣根过氧化物酶(HRP)标记的二抗,室温孵育1 h。再次洗涤后,使用电化学发光(ECL)检测试剂(Beyotime)进行免疫印迹分析。
5.qRT-PCR
用TRIZOL(Invitrogen,USA)提取RNA,用SupersmartTM6 min耐热首链cDNA合成试剂盒(中实基因科技有限公司)合成cDNA。采用Ribo mRNA qRT-PCR Starter Kit试剂盒(Ribobio)进行实时PCR。U6、miR29a-3p、miR29b-3p及miR29c-3p引物购自锐博生物,使用miDETECT A TrackTMmiRNA qRT-PCR Starter Kit试剂盒(Ribobio)进行实时PCR,其余用于RT-PCR分析引物如下:GAPDH Forward Primer:GAACGGGAAGCTCACTGG;GAPDH Reverse Primer:GCCTGCTTCACCACCTTCT;PTBP3 Forward Primer:TGTCCCACCAACTATTCATCCA;PTBP3 Reverse Primer:CTCTGGAACATATGCCTCAGGT。
6.细胞计数试剂盒(CCK-8)
CCK-8(Dojindo,日本)检测细胞增殖。将慢病毒感染24 h的肿瘤细胞以每孔1 000个细胞密度接种到96孔细胞培养板中,体积为100 µl,在正常条件下培养24 h,然后每孔加入10 µl CCK-8试剂,2 h后,使用酶标仪在450 nm处测量吸光度值。每组试验重复3次。
7.细胞划痕试验
将细胞接种到6孔板上,孵育24 h后,用100 µl无菌吸管尖划伤融合细胞单层,加入无血清培养基。0 h、24 h和48 h倒置显微镜测量划痕间隙距离,显微镜拍摄图片经Image J软件计算细胞迁移距离。
8.生信数据分析
使用UALCAN数据库(http://ualcan.path.uab.edu/)、癌症基因组图谱(TCGA)数据库分析食管癌组织及正常食管组织PTBP3的表达差异及PTBP3与miR29家族的关系。
9.统计学分析
采用SPSS 20.0软件进行统计分析,符合正态分布的计量资料采用均数±标准差()表示,组间比较采用独立样本t检验,组内采用配对t检验,以P<0.05为差异有统计学意义。
结 果
1.ESCC组织中PTBP3基因表达水平
利用TCGA数据研究ESCC组织和正常食管组织PTBP3的表达水平,结果显示,ESCC组织中PTBP3基因的表达量高于正常食管组织(P<0.001),且与食管腺癌及正常食管组织相比,ESCC组织中的PTBP3表达水平较高(P<0.05)。PTBP3表达水平和临床分期、病理分化程度以及淋巴结转移程度关系不明显(图1A~D)。正常食管鳞状上皮组织以及ESCC组织中PTBP3蛋白和mRNA的表达水平,结果表明,与正常食管鳞状上皮组织相比,PTBP3在ESCC组织中高表达,与TCGA数据库中数据一致(图1E~G)。
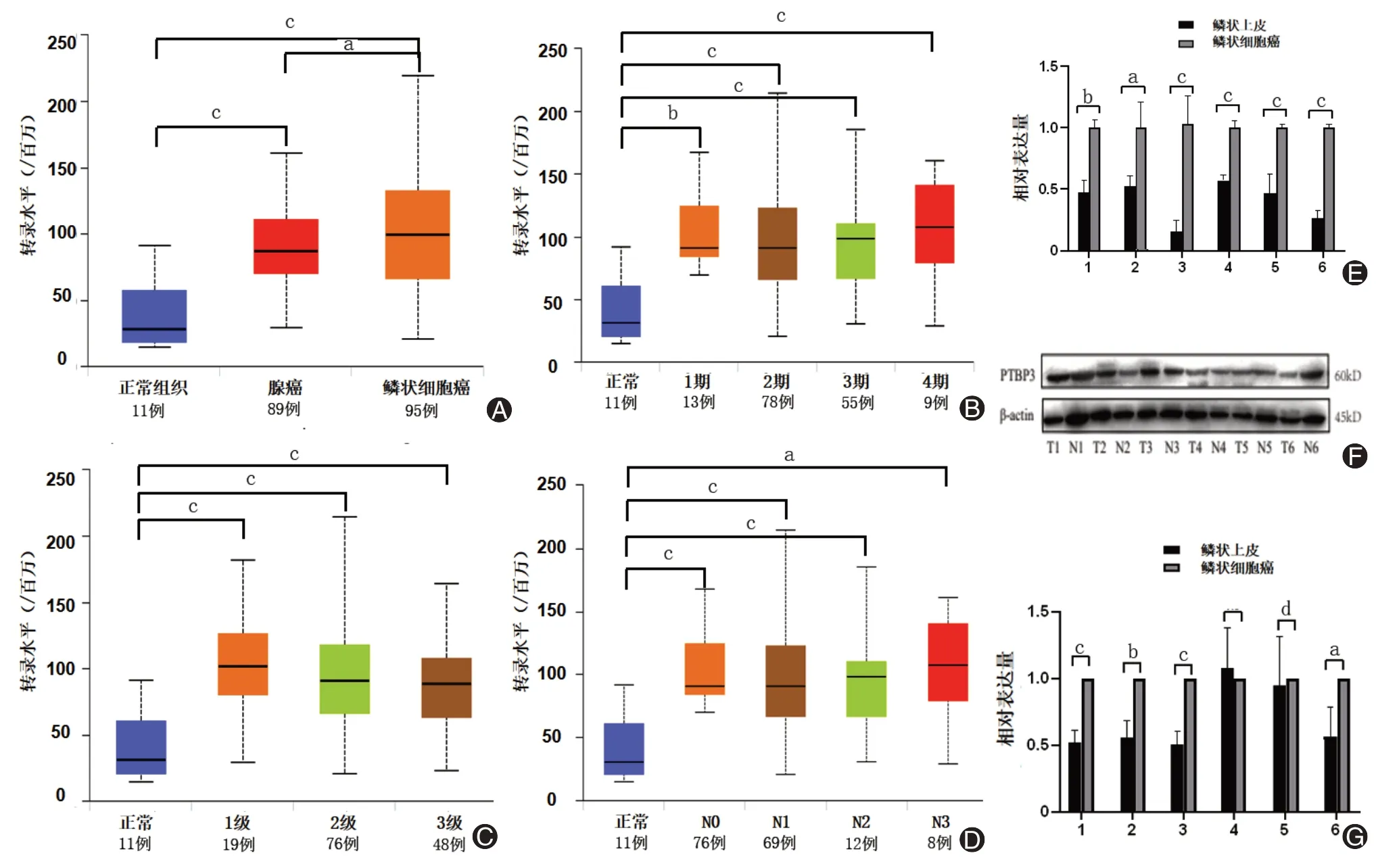
图1 PTBP3在ESCC组织中高表达。A为TCGA数据库中PTBP3在食管癌与正常食管组织中的表达差异,B为TCGA数据库中PTBP3基因表达与临床分期的关系,C为TCGA数据库中PTBP3基因表达与肿瘤分化程度的关系,D为TCGA数据库中淋巴结转移与PTBP3基因表达关系,E为qRT-PCR检测ESCC和食管鳞状上皮组织中PTBP3 mRNA的表达情况,F、G为Western blotting检测ESCC和食管鳞状上皮组织中的PTBP3蛋白表达水平
2.PTBP3敲低抑制ESCC细胞株迁移和增殖
慢病毒感染构建PTBP3稳定敲低的ESCC细胞,qRT-PCR和Western blotting结果显示,ECA109细胞、KYSE150细胞、KYSE30细胞中PTBP3 mRNA和蛋白水平降低(图2A~C)。CCK-8试验结果显示,敲低PTBP3能抑制ECA109细胞、KYSE150细胞及KYSE30细胞增殖能力(图2D)。细胞划痕试验结果显示,PTBP3敲低能抑制ESCC细胞迁移能力(图2E~F)。
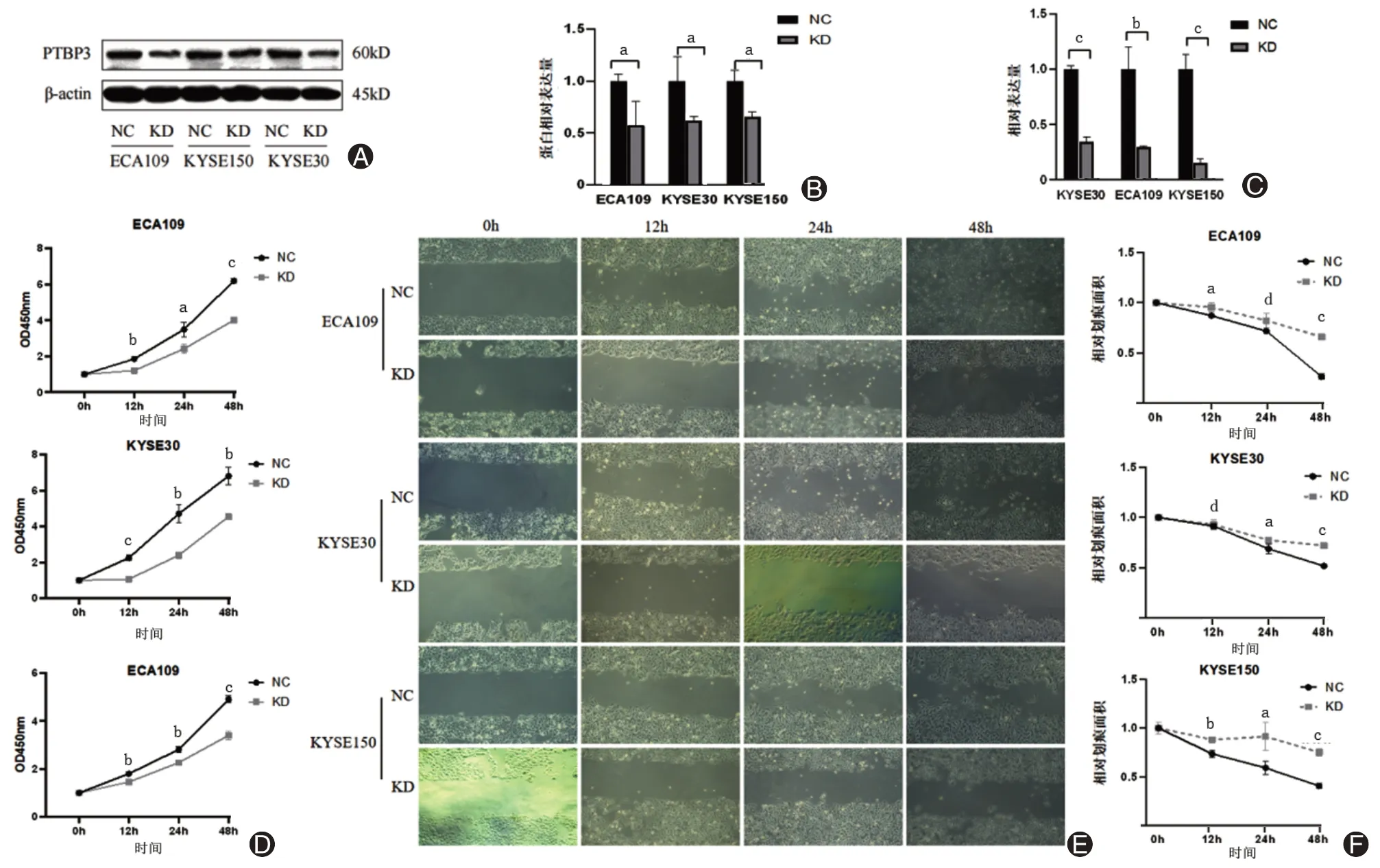
图2 感染PTBP3敲低病毒能降低ESCC细胞活力和迁移能力。A、B为Western blotting检测细胞中PTBP3蛋白表达情况,C为qRT-PCR检测细胞中PTBP3 mRNA表达情况,D为CCK-8试验检测ESCC细胞活力,E、F为细胞划痕试验检测ESCC细胞的迁移能力
3.PTBP3敲低可降低ESCC细胞miR-29a-3p与miR-29c-3p的表达水平
PTBP3在miRNA前体转录过程中发挥作用。通过TCGA数据库筛选PTBP3潜在的下游靶点分子,结果发现,在食管癌组织中,PTBP3基因表达与hsa-miR29-3p的表达相关。qRT-PCR结果表明,与对照病毒组相比,3种ESCC细胞(KYSE30、ECA109、KYSE150)的PTBP3敲低组中miR-29a-3p与miR-29c-3p表达水平下调(t=29.007、7.057、4.844、12.625、15.612、18.861,均P<0.05),而miR-29b-3p的表达在KYSE30、ECA109细胞中差别较大(图3A~C)。
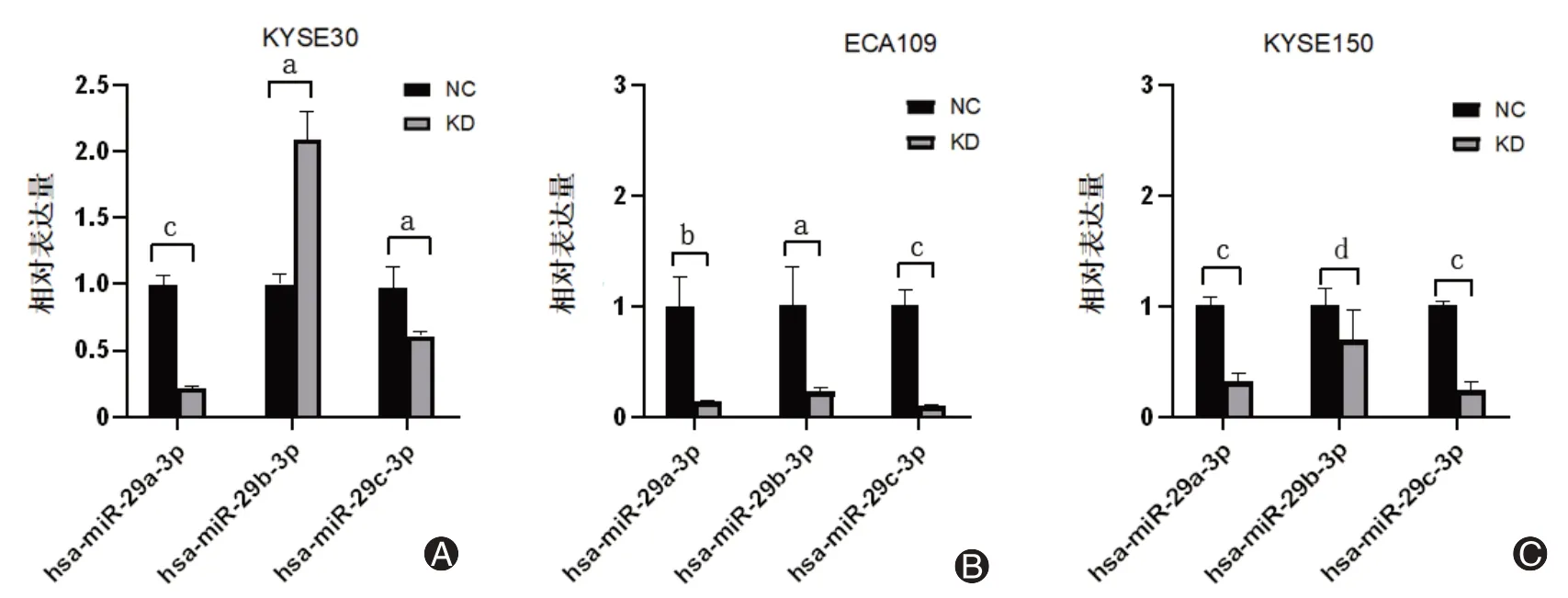
图3 PTBP3敲低可降低ESCC细胞中miR-29a-3p与miR-29c-3p的表达量。A~C为qRT-PCR检测ESCC细胞中miR-29家族表达情况
4.ESCC组织中miR-29与PTBP3的表达水平
qRT-PCR结果表明,与正常食管鳞状上皮组织相比,miR-29家族在ESCC组织中高表达(图4A~C)。ESCC组织中miR-29a-3p、miR-29b-3p、miR-29c-3p相对表达量与PTBP3相对表达量进行相关性分析,结果表明,ESCC组织中miR-29a-3p和miR-29c-3p表达量与PTBP3表达量相关。
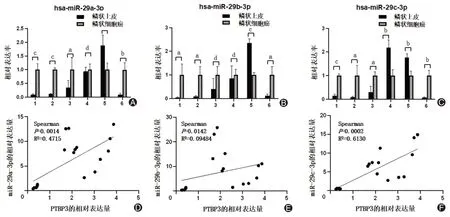
图4 ESCC组织中miR-29家族表达升高,且与PTBP3表达相关。A~C为qRT-PCR检测ESCC组织中miR-29家族表达情况,D~F为ESCC组织中miR-29家族与PTBP3表达情况相关性
讨论
PTBP家族成员主要参与RNA剪接,可以在细胞质和细胞核之间穿梭,优先结合富含多嘧啶的RNA片段[5]。PTBP1和PTBP2的相关研究较多,而PTBP3的相关功能近年来才引起学者们的关注[6-8]。Yamamoto等[7]文献表明,PTBP3能够作为调节蛋白参与细胞分化。也有文献证实,PTBP3与多种恶性肿瘤进展密切相关,并且可能具有组织特异性,在肺癌、乳腺癌、胃癌中PTBP3蛋白水平升高,而胶质母细胞瘤中PTBP3表达水平低于周围正常组织[3,8-10]。PTBP3通过选择性剪接参与胃癌转移、分化和迁移,抑制PTBP3可诱导胃癌细胞凋亡及细胞周期阻滞,增强5-氟尿嘧啶对胃癌细胞的毒性[11-12]。另外,PTBP3能够通过调节缺氧诱导因子-1α翻译激活,维持UBE4A mRNA稳定性,从而调控P53表达,促进结直肠癌细胞增殖与迁移[4,13]。本研究证实PTBP3在ESCC患者中高表达,PTBP3表达可抑制ESCC细胞增殖和迁移。
Treiber等[14]研究提示,PTBP3对miR-29家族成员进行转录后调控,促进pre-miRNA剪接在miRNA成熟过程中发挥作用。miR-29家族由miR-29a、miR-29b和miR-29c组成,它们在基因序列和生物学功能上有很高的保守性。miR-29家族已被证明在多种癌症中起着重要作用,主要通过与靶基因3'非编码区域结合,抑制靶基因表达,发挥抑癌或促癌作用,如磷脂酰肌醇3激酶/蛋白激酶B信号通路中的重要蛋白位点[15]。有研究发现,当miR-29被沉默时,食管癌细胞增殖能力降低,细胞周期被阻断在G1期,与食管癌进展和预后相关[16-17]。在miR-29家族中,miR-29-3p是主要发挥功能的片段,因此,选择miR-29-3p作为主要研究对象[18-19]。本研究结果表明,PTBP3敲低之后,ESCC细胞中miR-29a-3p与miR-29c-3p表达降低。miR-29b-3p的表达具有个体差异性,在KYSE30细胞中表达升高,ECA109 细胞中表达降低,KYSE150细胞中差异不明显,深层次的表达差异机制需要我们更进一步探索。此外,在ESCC组织中,我们发现PTBP3表达与miR-29家族成员表达均呈正相关性。因此,我们猜测PTBP3可以参与pre-miR-29家族成员的转录后调控,促进成熟miR-29形成,而其中的具体机制需要进一步研究。
本研究初步探讨PTBP3在ESCC细胞中的表达水平以及PTBP3在ESCC细胞增殖和迁移方面的功能作用,并且证明PTBP3可通过与前体miRNA结合调控miR-29家族表达,进而调节ESCC细胞活性和迁移。PTBP3是ESCC的一个重要分子标志物和潜在治疗靶点,可为ESCC早期诊断和治疗提供新思路和方法。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明吕莹:实施研究,采集、分析/解释数据,起草文章,对文章的知识性内容作批评性审阅,统计分析;郝明硕:酝酿和设计试验,实施研究,起草文章,指导,支持性贡献;钱阳:实施研究,采集、分析/解释数据,起草文章,统计分析;王蕊:实施研究,采集数据,起草文章,统计分析;相龙全:酝酿和设计试验,实施研究,对文章的知识性内容作批评性审阅,行政、技术或材料支持,指导,支持性贡献

