miR-124a通过抑制TGF-β通路促进人胎盘间充质干细胞向胰腺祖细胞分化
陈冬梅,马海滨,刘淑丹,王立斌,李玉奎,魏 军
(宁夏医科大学总医院干细胞研究所生育力保持教育部重点实验室,宁夏银川750004)
胎盘间充质干细胞(placenta mesenchymal stem cells,PMSCs),免疫原性低[1],具有跨胚层分化为内胚层来源细胞的潜能,可能成为β 细胞缺失替代治疗的重要方法[2]。研究显示组织特异性转录因子的异源表达能够有效提高间充质干细胞(mesenchymal stem cells,MSCs)向胰岛素生成细胞分化,例如:外源过表达PDX-1 能够产生具有糖反应能力的胰岛素生成细胞[3]。同样外源过表达组织特异的微小RNA(microRNA,miRNA)也能够调控细胞的表型。目前还没有利用外源表达miRNA 成功获得胰岛素生成细胞的报道。胚胎发育过程中,上皮间质转化(epithelial-mesenchymal transition,EMT)是细胞分化的重要事件,这一过程中TGF-β 信号起了主导作用[4]。本研究试图通过研究miR-124a 参与的转录后调控,通过抑制TGF-β 信号通路受体:转化生长因子β Ⅰ型受体(transforming growth factor beta type Ⅰreceptor,TGFBR1)和骨形成蛋白β Ⅰ型受体(bone morphogenic proteins receptor type ⅠB,BMPR1B)的表达,阻断TGF-β 信号通路,实现细胞的间质上皮转化(mesenchymal-epithelial transition,MET),同时阻止细胞的成骨分化,促进PMSCs 向胰腺祖细胞的分化,为进一步获得胰腺功能细胞提供实验基础。
1 材料与方法
1.1 材料
人胎盘来源于宁夏医科大学总医院行剖腹产的健康产妇,经医院伦理学委员会批准且获得患者知情同意。HEK293FT 细胞(宁夏人类干细胞研究所保存)。胎牛血清、L-DMEM、H-DMEM、胰蛋白酶和Trizol(Invitrogen 公司);Activin A(R&D 公司);DNA酶Ⅰ、A 型胶原蛋白酶(Roche 公司);反转录试剂盒、转染试剂TurboFect 和qPCR 试剂盒(Thermo 公司);限制性内切酶,T4 连接酶和T-载体(TAKARA 公司);四环素诱导型慢病毒载体系统Tet-On 3G(Clontech公司);山羊抗人多克隆抗体Insulin 和PDX-1(Santa cruz 公司);CY3 和FITC 标记兔抗山羊二抗(博士德公司)。
1.2 方法
1.2.1 细胞培养:人胎盘胎儿侧MSCs 分离培养及鉴定见参考文献[5]。诱导分化培养基:DMEM 高糖添加100 mL/L 胎牛血清,8 ng/mL bFGF,4 nmol/L Activin A。
1.2.2 生物信息学分析与靶基因预测:利用star-Base v2.0 综合分析各预测软件的结果,搜索hsamiR-124a 的靶基因并取交集,GO 分析TGF-β 通路相关的基因。
1.2.3 细胞RNA 提取及实时定量PCR 检测:Trizol提取样本总RNA 后,紫外分光光度计和电泳检测RNA 浓度、纯度和完整性。通过随机引物体外反转录获取cDNA,用SYBR Green 染料法获得不同样本中目的基因的相对表达量。通过2-ΔΔCt算法,计算统计分析目的基因mRNA 相对内参GAPDH 基因表达水平的差异。microRNA 的检测则通过特异的stem-loop 颈环引物体外反转录获取cDNA,获得不同样本中microRNA 相对内参U6 表达水平的差异,引物序列见表1。
1.2.4 pri-hsa-miR-124a 重组慢病毒表达载体的构建与病毒包装及细胞感染:以人基因组DNA 为模板,在miR-124a 初始转录(primary,pri)序列前后100 bp 左右位置设计克隆引物,添加酶切位点和保护碱基,扩增pri-miR-124a 目的片段。目的片段经过T-载体扩增,酶切、纯化、回收后连接入病毒载体中,转化感受态细胞扩增,并进行酶切与测序鉴定。重组慢病毒载体pLVX-TRE3-miR-124a用TurboFect 转染293FT 包装细胞,收取上清获取感染性病毒。感染293FT 方法测定病毒滴度,最终以MOI=10 的感染复数感染人胎盘胎儿侧间充质干细胞(n=3)。
1.2.5 hsa-miR-124a antagomir 抑制物的合成及细胞转染:hsa-miR-124a 反义寡核苷酸(antagomir)及阴性对照由上海吉玛公司合成,序列见表2。合成的antagomir 用DEPC 水溶解成浓度为20 μmol/L的溶液,将opti-MEM 培养液400 μL 与antagomir和阴性对照各5 μL 充分混和,再与转染试剂TurboFect 6 μL混合,将最终混合物加入含新鲜培养基的胎盘间充质干细胞中,在37 ℃和5% CO2培养箱中继续培养至24 h,换液后继续培养48 h,提取RNA 供检测。
1.2.6 免疫荧光染色:各处理组细胞经4%多聚甲醛固定,0.3% TritonX-100 细胞膜穿孔10 min,根据二抗选择山羊或兔血清封闭,次序与一抗、荧光标记二抗孵育、洗涤,同时设置以PBS 缓冲液代替一抗,其他步骤不变的空白对照,DAPI 染核,倒置荧光显微镜下观察细胞特异性发光情况。
1.2.7 Western blot 分析:提取样本总蛋白,BCA法检测蛋白浓度,等量上样,SDS-聚丙烯酰胺凝胶电泳分离蛋白,转膜后5%脱脂奶粉封闭,次序与一抗、二抗孵育,利用ECL 法检测目的蛋白条带。
1.3 统计学分析
数据由SPSS16.0 统计软件统计分析,以均数±标准差(±s)表示应用统计学软件对实验结果进行单因素方差分析及LSD 多重比较。
2 结果
2.1 生物信息学分析与靶基因预测
starBase v2.0 分析hsa-miR-124a 的作用靶点,其中与TGF-β 信号通路功能相关的靶基因包括ACVR2B,BMP6,BMPR1B,E2F5,MAPK1,RBL1,ROCK2,RPS6KB1,SMAD5,SP1 和TGFBR1,本实验选取TGF-β 通路的TGF-β 信号受体TGFBR1 和BMP 信号受体BMPR1B 进行进一步实验验证。

表1 用于qPCR 和hsa-miR-124a 克隆的引物序列Table 1 Primer sequences for qPCR and hsa-miR-124a cloning
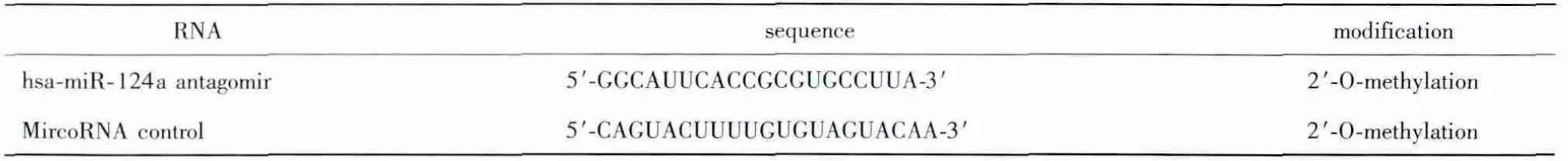
表2 miR-124a 反义寡核苷酸序列Table 2 miR-124a antisense oligonucleotides sequence
2.2 Pri-hsa-miR-124a 重组慢病毒表达载体的构建,病毒包装及细胞感染
实验从基因组中扩增获得333 bp 的pri-hsamiR-124a 序列,通过Mlu Ⅰ/EcoR Ⅰ酶切位点克隆至pLVX-TRE3G 载体中并测序正确,载体构建成功。将重组载体pLVX-TRE3G-miR124a 与四环素诱导载体pLVX-TET 分别混合包装质粒并转染293FT 细胞,细胞发生融合、皱缩病变(图1A)。GFP 阳性对照显示病毒感染效率在80%以上(图1B)。用MOI 为10 的病毒上清感染胎盘间充质干细胞,感染后两周观察细胞形态,部分细胞由之前的间充质细胞形态(图1C)转变为胰腺祖细胞具有的上皮细胞形态(图1D)。
2.3 miR-124a 过表达和抑制表达对靶基因TGFBR1和BMPR1B 的表达调控
miR-124a 重组慢病毒感染胎盘PMSCs 后检测细胞中miR-124a 过表达情况,结果显示感染后的细胞中成熟miR-124a 相对U6 的表达量增高,而其靶基因TGFBR1 和BMPR1B 相对GAPDH 的表达量较转染前降低(P<0.05)(图2A,B)。
合成的miR-124a 抑制物转染胎盘间充质干细胞后,细胞中miR-124a 的表达较空白对照组下降,而其靶基因TGFBR1 和BMPR1B 表达上升(P<0.05)(图2C,D)。
2.4 胰腺祖细胞特征基因表达变化
试验检测了miR-124a 过表达前后,胰腺祖细胞特异性基因Ngn3、PDX-1、Nkx6.1 和胰腺β 细胞标志基因Insulin 的表达情况。结果显示相对GAPDH的表达量均呈现上升,其中Ngn3、Nkx6.1 和PDX-1表达差异极显著(P<0.01),Insulin 的表达差异显著(P<0.05)(图3A)。过表达miR-124a 使胎盘间充质干细胞中表达胰腺祖细胞标志蛋白PDX-1,同时检测出胰岛素蛋白表达(图3B)。
2.5 miR-124a 过表达的PMSCs 中胰腺祖细胞特异性蛋白表达
过表达miR-124a 后的胎盘间充质干细胞中表达PDX-1 和Insulin 蛋白的细胞数量较转染前明显增多(图4)。
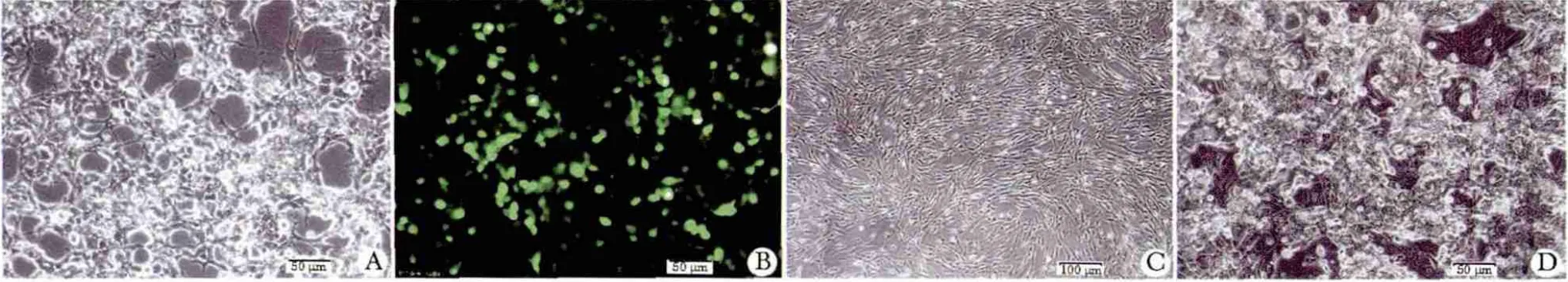
图1 慢病毒包装与PMSCs 细胞感染Fig 1 Lentiviral packaging and PMSCs infection

图2 miR-124a 与其靶基因的调控关系Fig 2 Relationship between miR-124a and its target genes
图3 miR-124a 及其靶基因对下游基因调控关系Fig 3 miR-124a and its targets are involved in regulation of the downstream genes

图4 胰腺祖细胞特异蛋白表达Fig 4 Expression of pancreatic progenitor cellspecific protein
3 讨论
PMSCs 为获取低免疫原性的胰岛素分泌细胞提供了可能。胰腺的发育经历终末内胚层,胰腺祖细胞,内分泌祖细胞和成熟β 细胞等多个关键事件,已有研究显示,终末内胚层的分化能够有效地获得,但胰腺祖细胞和功能性β 细胞在体外还不能很有效的分化。如何提高PMSCs 向胰腺祖细胞的转化能力,对糖尿病和胰腺功能退化等疾病的临床细胞治疗有重要应用价值。借助外源基因的表达能够促进MSCs 向内分泌细胞的分化已有研究报道,例如转录因子PDX-1,MAFA,NGN3 等都能够诱导MSCs 向胰岛细胞分化[6-7]。研究表明在小鼠胚胎发育中,miR-124 通过抑制靶基因PTBP1,Sox9,NeuroD1 的表达,促进祖细胞向成熟神经元的分化[8]。同时研究发现发育过程中的神经祖细胞和胰岛祖细胞的表型有许多相似之处,研究显示作为miR-124a 参与调控的NeuroD1,Sox9 和PAX6 可能间接调控胰腺发育的关键基因PDX1,而参与调控胰腺祖细胞的形成[9]。本研究结果说明过表达和抑制表达miR-124a,能反向调控其靶基因TGFBR1和BMPR1B 的表达,证明两者存在相互作用。同时显示出Pdx1,Nkx6.1 表达显著升高,说明过表达miR-124a 间接调控了这些胰腺祖细胞特异性基因的表达,指导了PMSCs 向胰腺祖细胞的分化。此外,部分细胞表现出胰岛素合成功能,初步证明了PMSCs 转化来的胰腺祖细胞能够产生部分功能性β细胞,并揭示了这可能与TGFβ 通路被抑制导致PMSCs 发生MET 有关。有研究显示,TGFβ 通路在胚胎发育过程中起重要作用,并与EMT 密切相关,通过抑制TGFβ 通路能促进间充质干细胞向诱导多能干细胞转化[10]。MSCs 向上皮样细胞转分化必然经过MET 的过程,实验证明MSCs 具有向上皮方向转化的能力[11]。同时,TGFβ 家族成员BMP4 指导细胞的成骨和成脂分化[12],通过抑制BMP4 蛋白的作用,抑制MSCs 向成骨和脂肪细胞的分化,可能也是miR-124a 促进PMSCs 发生胰腺祖细胞转化的原因。本研究通过研究miR-124a 抑制TGFBR1 和BMPR1B 的表达,达到了提高PMSCs 向胰腺祖细胞分化效率,对揭示PMSCs 体内的作用机制以及体外分化获得大量的功能细胞,直接参与细胞和组织重建具有重要意义。
[1]王华阳,董绍刚,曲迅.蜕膜间充质干细胞免疫调节作用及临床应用研究进展[J].基础医学与临床,2012,32:340-344.
[2]Kadam S,Govindasamy V,Bhonde R.Generation of functional islets from human umbilical cord and placenta derived mesenchymal stem cells[J].Methods Mol Biol,2012,879:291-313.
[3]Rahmati S,Alijani N,Kadivar M.In vitro generation of glucose-responsive insulin producing cells using lentiviral based PDX-1 gene transduction of mouse (C57BL/6)mesenchymal stem cells[J].Biochem Biophys Res Commun,2013,437:413-419.
[4]Mainez J,Bertran E,Fabra A,et al.TGF-beta and epithelial-mesenchymal transition (EMT):a step forward to apoptosis-resistance and stemness phenotype[J].Febs Journal,2012,279:60-60.
[5]朱永朝,马海滨,刘婷,等.扰素-γ 对人胎盘胎儿来源间充质干细胞免疫调节功能的影响[J].细胞与分子免疫学杂志,2012,28:1058-1061.
[6]Hu He K,Juhl K,Karadimos M,et al.Differentiation of pancreatic endocrine progenitors reversibly blocked by premature induction of MafA[J].Dev Biol,2014,385:2-12.
[7]Xu H,Tsang KS,Chan JC,et al.The combined expression of Pdx1 and MafA with either Ngn3 or NeuroD improves the differentiation efficiency of mouse embryonic stem cells into insulin-producing cells[J].Cell Transplant,2013,22:147-158.
[8]Liu K,Liu Y,Mo W,et al.miR-124 regulates early neurogenesis in the optic vesicle and forebrain,targeting NeuroD1[J].Nucleic Acids Res,2011,39:2869-2879.
[9]Ham DS,Shin J,Kim JW,et al.Generation of Functional Insulin-Producing Cells from Neonatal Porcine Liver-Derived Cells by PDX1/VP16,BETA2/NeuroD and MafA[J].PLoS One,2013,8:doi:10.1371/journal.pone.0079076.
[10]Massague J.TGFbeta signalling in context[J].Nat Rev Mol Cell Biol,2012,13:616-630.
[11]杨倩,张丽娜,李康华,等.体外诱导脂肪来源间充质干细胞间质上皮转化[J].基础医学与临床,2012,32:124-127.
[12]Wei X,Li G,Yang X,et al.Effects of bone morphogenetic protein-4 (BMP-4)on adipocyte differentiation from mouse adipose-derived stem cells[J].Cell Prolif,2013,46:416-424.

