LPS上调大鼠HIF-1和GLUT表达
严洁萍,俞 佳,吴 越,吕良忠,2*
(1.浙江省人民医院药学部临床药学室,浙江杭州310014;2.浙江中医药大学药学院药理教研室,浙江杭州310053)
葡萄糖转运体(glucose transporter,GLUT)是一类调控细胞外葡萄糖进入细胞内的跨膜蛋白家族,参与糖代谢,炎性反应和免疫应答等过程[1]。本研究前期已发现大鼠腹腔注射脂多糖(lipopolysacchride,LPS)可致内毒素血症[2],引起代谢因子应激变化[3-4],影响葡萄糖吸收和GLUT1 表达变化[5]。病理状态GLUT 表达丰度和变化趋势都不尽相同,其分布和功能具有潜在的选择特异性值得进一步探讨。
低氧诱导因子(hypoxia-inducible factor-1,HIF-1)参与调控GLUT 表达,HIF-1 活性调节依赖于HIF-1的稳定表达。前期已发现LPS 促ALD A 表达呈HIF-1 依赖性上调[2],提示HIF-1 可参与调控葡萄糖代谢。
本研究观察LPS 对GLUT 家族表达影响及HIF-1可能的调控作用,以揭示GLUT 在病理状态可能的生物学功能。
1 试剂与方法
1.1 主要试剂与材料
LPS(Sigma 公司);PMSF,aprotinin,leupeptin,丙烯酰胺,双丙稀酰胺,Tris,甘氨酸,引物序列及RTPCR 反应试剂(上海生工生物工程);IL-1 测定试剂盒(南京建成生物有限公司);硝酸纤维素膜(Milipore 公司);Western blot 所用二抗为辣根过氧化物酶标记的抗羊IgG,辣根过氧化物酶标记的抗兔IgG,辣根过氧化物酶标记的抗鼠IgG 和β-actin 抗体(Santa Cruz Biotechnology 公司);ECL 化学发光试剂盒(Pierce 公司);Lowry 法测蛋白含量试剂盒(Bio-Rad 公司);GLUT1 抗体(杭州安博公司);HIF-1抗体(ABCam 公司)。
1.2 实验动物
清洁级SD 大鼠,雄性,体质量180~250 g[浙江大学医学实验动物中心,动物合格证号:SCXK(浙)2004-0014]。
1.3 LPS 给药、体温检测和样本采集
大鼠12 只均分为对照组(腹腔注射0.9%氯化钠注射液)及LPS 给药组(注射2 mg/kg LPS)。LPS给药后0、6、12、16 和24 h 检测两组大鼠肛温。LPS作用24 h 后,下腔静脉取血备用。处死大鼠,取其脑、心脏和肝等组织备用。
1.4 血清IL-1 水平检测
取血后静置30 min,3 000 ×g 离心5 min,取上清液备用。按试剂盒说明书检测血清IL-1 水平。
1.5 RT-PCR 法检测组织GLUT 家族mRNA表达
取新鲜组织,加入液氮碾磨,OMEGA 总RNA提取试剂盒提取总RNA。反转录条件:RNA 3 μg,随机引物2 μL,0.1% DEPC 补足至12 μL,65 ℃变性15 min。加入4 μL 反转录缓冲液,3 μL 10 mmol/L dNTP,40 U M-MuLV 反转录酶,0.5 μL RNA酶抑制剂,25 ℃10 min、42 ℃1 h、72 ℃15 min 反转录得cDNA。PCR 的扩增条件如下:5.0 μL 缓冲液;1.0 μL dNTP(10 mmol/L);上、下游引物各2 μL;cDNA 1.5 μL;0.5 μL Taq DNA 聚合酶(2.5 U);3 μL Mg2+溶液;水补至50 μL 进行PCR 扩增。各引物序列、退火温度和循环轮数如表1 所示。PCR 反应产物进行1.5%琼脂糖凝胶电泳,溴化乙锭染色后用凝胶成像系统记录结果。

表1 目标基因引物序列以及PCR 扩增条件Table 1 Primers and conditions for RT-PCR
1.6 Western blot 法检测细胞蛋白表达
裂解液充分裂解组织,冰浴中反复吹打放置20~30 min,4 ℃13 000 × g 离心30 min。用Bio-Rad 试剂盒测定样本蛋白溶液浓度。于10% SDS-聚丙烯酰胺凝胶中电泳1~2 h,用电转膜仪将蛋白转印至硝酸纤维素膜上;5%脱脂牛奶封闭1 h;加入目标蛋白一抗,4 ℃过夜;次日加入辣根过氧化物酶标记二抗1 h,采用ECL 法检测印迹膜。Quantity OneTM4.2.2 分析结果。
1.7 统计学分析
2 结果
2.1 LPS 对大鼠体温及血清炎性因子影响
LPS 作用18 和24 h 可分别升高大鼠体温(P<0.05,P<0.01)(图1A);与对照组相比,LPS 作用24 h大鼠血清中IL-1 水平上调(P<0.05)(图1B)。
2.2 LPS 对GLUT 家族mRNA 表达的影响
GLUT1、GLUT2、GLUT3 和GLUT4 在脑组织均有表达;LPS 明显上调GLUT1 mRNA 水平(P<0.05)(图2A,B)。GLUT1 和GLUT4 在心脏组织有表达;给LPS 后GLUT1 和GLUT4 mRNA 水平变化无显著变化(图2A,C)。GLUT1、GLUT2 和GLUT4 在肝脏组织中有表达;LPS 对其肝脏GLUT 家族并无明显影响(图2A,D)。
2.3 GLUT1 和HIF-1 的表达

图1 LPS 对大鼠体温及血清IL-1 水平影响Fig 1 The body temperature and IL-1 level in serum in LPS-challenged rats(±s,n=6)
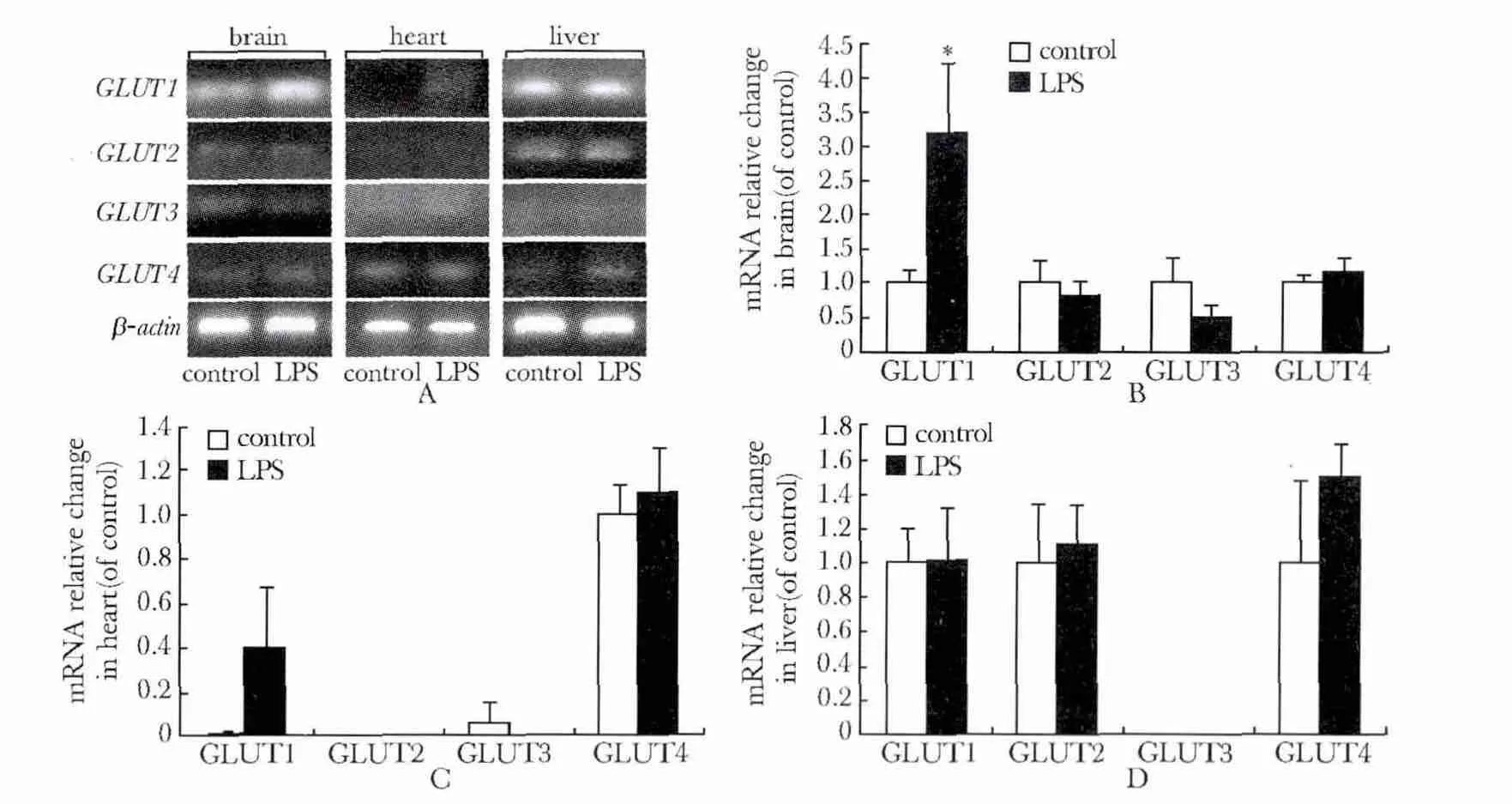
图2 LPS 对大鼠脑、心脏和肝脏GLUT 家族mRNA 表达的影响Fig 2 Effects of LPS on GLUT family mRNA expression in brain,heart and liver in rats(±s,n=6)
对照组脑组织中,HIF-1 呈低水平表达或不表达,给LPS 后HIF-1 稳定表达,较对照组显著上调(P<0.001)。在脑组织中,LPS 给药组GLUT1 蛋白表达较对照组显著上调(P<0.05),与HIF-1 表达一致(图3A)。在心脏、肝脏中,对照组和LPS 组HIF-1 呈较低水平表达或不表达;两组GLUT1 表达均无变化(图3B,C)。

图3 LPS 对大鼠脑、心和肝等组织HIF-1 和GLUT1 蛋白表达的影响FigEffect of LPS on HIF-1 and GLUT1 protein expressions in brain,heart and liver in rats(n=6)
3 讨论
GLUT 作为糖摄取的关键因子,其表达水平与机体糖代谢密切相关。本研究观察到GLUT 家族在各器官的可能功能亚型:GLUT1 和GLUT4 在脑、心和肝组织中均有表达;GLUT2 在脑、肝组织中表达;GLUT3 仅在脑组织特异性表达。
研究报道通过激活白细胞上调GLUT1,GLUT3 和GLUT4 等表达从而影响糖吸收过程[6]。在LPS 敏感小鼠(C57BL/6)和LPS 抵抗小鼠(C3H/HeJ)模型中,LPS 影响腹膜和脾脏细胞的氧化代谢,也可激活腹膜巨噬细胞炎性因子,如TLR-1/MD-2 受体,CD14 受体和TNF-β 表达[7]。这种方式被认为是一种免疫应激反应。本结果显示LPS 可上调脑组织GLUT1 表达,提示GLUT1 表达变化可能与机体应激反应密切相关,部分揭示了GLUT 家族作为应激蛋白参与调控代谢的生物学本质。低氧或应激状态均发现HIF-1 可通过调控GLUT 或催化酶控制糖酵解流量,为提供机体所需ATP[8]。本结果LPS 上调脑组织GLUT1 表达,与HIF-1 稳定表达相平行,提示其表达可能受HIF-1 调控。
综上所述,GLUT 家族在大鼠脑、心脏和肝脏组织中的表达具有器官特异性;LPS 可能通过促HIF-1 稳定表达上调GLUT1 表达参与调控糖代谢过程。
[1]Garnett JP,Nguyen TT,Moffatt JD,et al.Proinflammatory mediators disrupt glucose homeostasis in airway surface liquid[J].J Immunol,2012,189:373-380.
[2]Yan J,Shi Q,Chen Z,et al.Skeletal muscle aldolase an overexpression in endotoxemic rats and inhibited by GSNO via potential role for S-nitrosylation in vitro[J].J Surg Res,2011,170:57-63.
[3]江丽丽,张建斌,谢平,等.LPS 预处理增加CoCl2 诱导小鼠巨噬细胞表达HIF-1[J].基础医学与临床,2013,33:1297-1301.
[4]杨敏,姜明红,高静,等.miR-23a 对LPS 诱导小鼠巨噬细胞促炎性细胞因子表达的影响[J].基础医学与临床,2013,33:666-670.
[5]Tavakoli S,Zamora D,Ullevig S,et al.Bioenergetic Profiles Diverge During Macrophage Polarization:Implications for the Interpretation of 18F-FDG PET Imaging of Atherosclerosis[J].J Nucl Med,2013,54:1661-1667.
[6]Reddy AB,Srivastava SK,Ramana KV.Aldose reductase inhibition prevents lipopolysaccharide-induced glucose uptake and glucose transporter 3 expression in RAW264.7 macrophages[J].Int J Biochem Cell Biol,2010,42:1039-1045.
[7]杨峰,周娅,曹相原,等.槐定碱抑制脂多糖诱导巨噬细胞系NF-κB 表达[J].基础医学与临床,2011,31:1320-1325.
[8]Gessi S,Merighi S,Stefanelli A,et al.A and A adenosine receptors inhibit LPS-induced hypoxia-inducible factor-1 accumulation in murine astrocytes[J].Pharmacol Res,2013,76:157-170.

